
Углекислый газ – вред или польза?
Всякий необходимо причиняет пользу,
употреблённый на своём месте.
Козьма Прутков
Выполнили:
Паксялина В.
Сурмалян И.
Шлепцова Е
Якушева Н.

Гипотеза
Углекислый газ может быть полезен человеку и природе.

Ход исследований
- Получить углекислый газ в лаборатории и выяснить, не является работа с ним опасной для здоровья.
- Попытаться перелить углекислый газ из одного стакана в другой и объяснить загадку «собачьей пещеры» .
- Получить содовую воду и, не пробуя, определить её вкус.
- Подтвердить экспериментально, что выдыхаемый воздух содержит углекислый газ.
- Выяснить, как в природе образуются сталактиты и сталагмиты.

Результаты исследований
- Прежде чем приступить к работе, изучили литературу и нашли ответ на вопрос: «Не является ли работа с углекислым газом опасной для нашего здоровья?»
Вывод: можно не опасаясь приступить к работе, т.к. в ходе опытов с углекислым газом его концентрация в воздухе не превысит 0,1%.
головная боль;
учащение сердцебиения
учащение сердцебиения
повышение кровяного давления;
повышение кровяного давления;
головная боль;
стимулирует сердечную деятельность;
стимулирует сердечную деятельность;
возбуждает дыхательные центры мозга
возбуждает дыхательные центры мозга

В 16 в. в Голландии жил известный естествоиспытатель, врач и алхимик Иоганн Баптист Ван Гельмонт. Его любимым занятием было измерение массы и объёма продуктов химических реакций. Однажы учёный сжёг 62 фунта (около 20 кг) древесного угля и получил примерно 1 фунт золы. Ван Гельмонт сделал вывод, что остальная масса угля превратилась в «лесной дух». Не трудно догадаться, что «лесным духом» был образовавшийся в результате горения угля углекислый газ. Ван Гельмонт настойчиво пытался получить «лесной дух» при протекании других реакций, но сделать этого не смог. Опыт 1. Цель опыта : разгадать загадку Ван Гельмонта и не сжигая угля, получить углекислый газ.
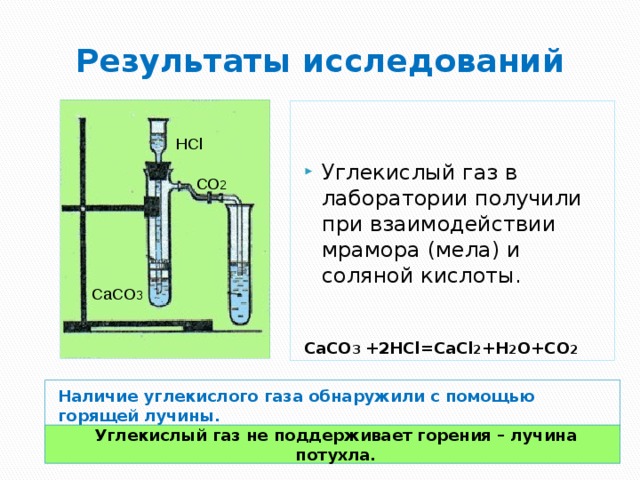
Результаты исследований
- Углекислый газ в лаборатории получили при взаимодействии мрамора (мела) и соляной кислоты.
CaCO 3 +2HCl=CaCl 2 +H 2 O+CO 2
HCl
СО 2
CaCO 3
Наличие углекислого газа обнаружили с помощью горящей лучины.
Углекислый газ не поддерживает горения – лучина потухла.
4

Белорусский писатель В.С. Короткевич в романе «Чёрный замок Ольшанский» пишет: «Вы слышали об эффекте «собачьей пещеры» в Италии… Из вулканической трещины в пещере выделяется углекислый газ… Человек войдёт и ходит, а собака или кролик погибают через несколько минут…»
Опыт 2.
Цель : перелить углекислый газ из одного стакана в другой и, основываясь на результатах опыта, объяснить загадку «собачьей пещеры».
1.Наполнили первый стакан углекислым газом.
2. На дно второго стакана поместили зажжённые свечи разной высоты.
3. «Перелили» углекислый газ из первого стакана во второй.

В Италии, близ Неаполя, есть знаменитая "Собачья пещера ". В ней непрерывно выделяется и скапливается внизу углекислый газ. Человек беспрепятственно может зайти в эту пещеру, для собаки же такая прогулка кончается плохо». Почему?

Результаты исследований
- Углекислый газ тяжелее воздуха в 1,5 раза, поэтому его можно перелить из одного стакана в другой.
- В атмосфере углекислого газа свечи погасли – первой погасла свеча на нижней ступеньке, затем средняя, последней – самая верхняя.
- Углекислый газ постепенно заполняет стакан, вытесняя из него воздух.
При повышении концентрации углекислого газа в плохо проветриваемом помещении содержание кислорода в воздухе уменьшается настолько, что животное или человек могут задохнуться.
т Тайна «собачьей пещеры» разгадана.
4

Результаты исследований
В начале 19 в. в Англии знаменитому химику и философу Джозефу Пристли был выдан патент на изготовление содовой воды. Содовая вода – это насыщенный раствор оксида углерода (IV) в воде.
Опыт 3.
Цель: получить содовую воду и, не пробуя, определить её вкус.
- При растворении оксида углерода (IV) в воде образуется слабая угольная кислота, окрашивающая универсальную индикаторную бумажку в красный цвет.
CO 2 +H 2 O=H 2 CO 3
- Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий.
- Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий.
- Угольная кислота улучшает вкусовые качества газированных напитков и предотвращает рост бактерий.

Результаты исследований Опыт 4 Цель: доказать наличие углекислого газа в выдыхаемом воздухе
- При помощи стеклянной трубки пропустили выдыхаемый воздух через известковую воду.
- Ca(OH) 2 +CO 2 =CaCO 3 +H 2 O
- Наблюдали помутнение известковой воды, т.к. в ходе реакции образовался нерастворимый карбонат кальция.
Данная реакция является качественной реакцией на оксид углерода (IV).

В земной коре в разных частях света есть бездонные пещеры - своеобразные черные дыры, происхождение которых овеяно легендами и преданиями. Решающую роль в появлении этих пещер играет углекислый газ, который извлекается из воздуха дождевой водой. Потоки дождевой воды попадают на пласты известняка (карбоната кальция) и превращают его в растворимый гидрокарбонат кальция, который уносится подземными водами. Внутри подземных известковых пластов образуются огромные полости - карстовые пещеры. В недрах Земли грунтовые воды (раствор гидрокарбоната кальция) могут нагреваться. Стекая со стен пещеры, раствор гидрокарбоната кальция испаряется, а сама соль разлагается с образованием нерастворимого карбоната кальция. Так природа создает сталактиты и сталагмиты.

Результаты исследований
Опыт 5
Цель: экспериментально осуществить реакции, в результате которых в природе образуются сталактиты и сталагмиты.
- Пропускали углекислый газ через известковую воду, сначала вода помутнела из-за выпавшего в осадок нерастворимого в воде карбоната кальция. Ca(OH) 2 +CO 2 =CaCO 3 +H 2 O
- При дальнейшем пропускании углекислого газа помутнение исчезает в результате образования растворимого гидрокарбоната кальция:
CaCO 3 +H 2 O+CO 2 =Ca(HCO 3 ) 2
- При нагревании растворимый гидрокарбонат кальция превращается в нерастворимый карбонат:
Ca(HCO 3 ) 2 =CaCO 3 +H 2 O+CO 2

Гипотеза подтвердилась Углекислый газ может быть полезен человеку и природе

Источник фотосинтеза
Антиоксидант (длительное хранение продуктов)
Применение углекислого газа
Тушение пожаров
Активизация сердечной деятельности (анестезия)
Хладагент
Карбонизация воды и напитков

Общий вывод
Несмотря на то, что избыточное содержание углекислого газа в атмосфере приводит к ухудшению состояния человека, подавляет процесс фотосинтеза и вызывает «парниковый эффект», существует много областей, где углекислый газ незаменим .

Информационные ресурсы
- О.С. Габриелян Химия 11 класс. М.: Дрофа,2007
- Н.М. Кузьменок, Е.А. Стрельцов Экология на уроках химии. Мн.: Красико – принт 2000
- А.А. Воротников Физика и химия. Мн.: «Харвест» 1998
- В.Н. Головнер Интересно о химии. М.: «Издательство НЦ ЭНАС», 2005
- www.school.holm.ru Школьный мир. Каталог образовательных ресурсов
- window.edu.ru Электронная библиотека учебников и методических материалов









































