МКОУ «Кужникская СОШ»
ТРЕНАЖЕР ЕГЭ ПО ХИМИИ
ЗАДАНИЕ №3 «ВАЛЕНТНОСТЬ И СТЕПЕНЬ ОКИСЛЕНИЯ»
Автор: Махмудов А. М.,
учитель химии и биологии
2021 г.
2. Валентность и степень окисления химических элементов.
2.1. Валентность и валентные возможности атомов химических элементов.
Валентность - это способность атома данного элемента образовывать определенное количество химических связей.
Валентность определяется числом ковалентных связей, которыми данный атом соединен с другими атомами, или числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентность, в большинстве случаев, определяется номером группы, в котором расположен элемент.
| ПЕРИОДЫ | Г Р У П П Ы Э Л Е М Е Н Т О В |
| I | II | III | IV | V | VI | VII | VIII |
| I | 1 H водород 1,0079 |
|
|
|
|
|
| 2 He гелий 4,0026 | -s-элементы -p-элементы -d-элементы -f-элементы |
| II | 3 Li литий 6,941 | 4 Be бериллий 9,01218 | 5 B бор 10,811 | 6 C углерод 12,011 | 7 N азот 14,0067 | 8 O кислород 15,9994 | 9 F фтор 18,9984 | 10 Ne неон 20,179 |
| III | 11 Na натрий 22,98977 | 12 Mg магний 24,305 | 13 Al алюминий 26,98154 | 14 Si кремний 28,0855 | 15 P фосфор 30,97376 | 16 S сера 32,066 | 17 Cl хлор 35,453 | 18 Ar аргон 39,948 |
| IV | 19 K калий 39,0983 | 20 Ca кальций 40,078 | 21 Sc скандий 44,95591 | 22 Ti титан 47,88 | 23 V ванадий 50,9415 | 24 Cr хром 51,9961 | 25 Mn марганец 54,9380 | 26 Fe железо 55,847 | 27 Co кобальт 58,9332 | 28 Ni никель 58,69 |
| 29 Cu медь 63,546 | 30 Zn цинк 65,39 | 31 Ga галлий 69,723 | 32 Ge германий 72,59 | 33 As мышьяк 74,9216 | 34 Se селен 78,96 | 35 Br бром 79,904 | 36 Kr криптон 83,80 |
|
| V | 37 Rb рубидий 85,4678 | 38 Sr стронций 87,62 | 39 Y иттрий 88,9059 | 40 Zr цирконий 91,224 | 41 Nb ниобий 92,9064 | 42 Mo молибден 95,94 | 43 Tc технеций 98,9062 | 44 Ru рутений 101,07 | 45 Rh родий 102,9055 | 46 Pd палладий 106,42 |
| 47 Ag серебро 107,8682 | 48 Cd кадмий 112,41 | 49 In индий 114,82 | 50 Sn олово 118,710 | 51 Sb сурьма 121,75 | 52 Te теллур 127,60 | 53 I иод 126,9045 | 54 Xe ксенон 131,29 |
|
| VI | 55 Cs цезий 132,9054 | 56 Ba барий 137,33 | 57* La лантан 138,9055 | 72 Hf гафний 178,49 | 73 Ta тантал 180,9479 | 74 W вольфрам 183,85 | 75 Re рений 186,207 | 76 Os осмий 190,2 | 77 Ir иридий 192,22 | 78 Pt платина 195,08 |
| 79 Au золото 196,9665 | 80 Hg ртуть 200,59 | 81 Tl таллий 204,383 | 82 Pb свинец 207,2 | 83 Bi висмут 208,9804 | 84 Po полоний 208,9824 | 85 At астат 210,9871 | 86 Rn радон 222,0176 |
|
| VII | 87 Fr франций 223,0197 | 88 Ra радий 226,0254 | 89** Ac актиний 227,0278 | 104 Rf резерфордий [261] | 105 Db дубний [262] | 106 Sg сиборгий [263] | 107 Bh борий [264] | 108 Hs хассий [265] | 109 Mt мейтнерий [268] | 110 Ds дармштадтий [271] |
У водорода и щелочных металлов валентность I, это исходит из строения их атомов:
| 1s1 +1H …  |
По одному неспаренному электрону на внешнем слое. |
| 2s1 2p0 +3Li …   |
| 3s1 3p0 3d0 +11Na …   
|
| 2s1 2p1 +4Be* …   |
По два неспаренных электрона во внешнем слое в возбужденном состоянии. |
| 3s1 3p1 3d0 +12Mg* …    |
| 4s1 4p1 4d0 4f0 +20Ca* …    … …
|
| 2s1 2p2 +5B* …   |
По три неспаренных электрона во внешнем слое в возбужденном состоянии.
|
| 3s1 3p2 3d0 +13Al* …   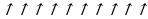 |
| 4s1 4p2 4d0 4f0 +21Ga* …   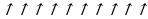 … …
|
| Таллий (Tl) может проявить валентность равную I и III. |
У элементов IVA группы валентность IV, в некоторых случаях - II:
| 2s1 2p3 +6C* …  
|
По четыре неспаренных электрона во внешнем слое в возбужденном состоянии.
|
| 3s1 3p3 3d0 +14Si* …   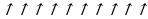
|
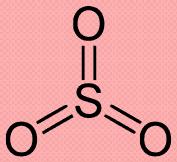
Примеры соединений углерода и кремния с валентностью IV:
| оксиды |
O=C=O | I ―O―Si―… I O I |
| Летучие водородные соединения | 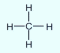
| 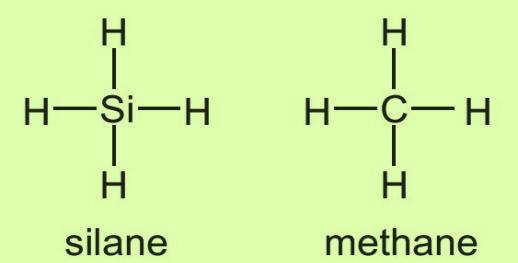
|
| В простых веществах | I I I ― C ― C ― C ― I I I
| I I I ― Si ― Si ― Si ― I I I
|
Валентность углерода в основном состоянии равна II, т. к. имеет два неспаренных электрона. 2s2 2p2
+6C … 

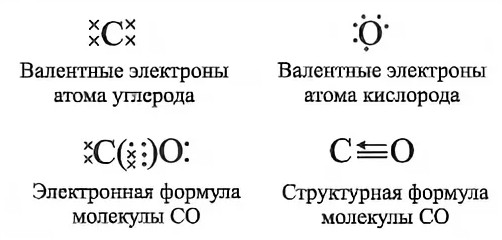
| В монооксиде углерода СО валентность углерода равна III, так как образует с кислородом три ковалентные связи. Третья связь образауется по донорно-акцепторному механизму, и обозначается стрелкой.
| 
|
У элементов VA группы высшая валентность V, у азота IV:
| 2s2 2p3 +7N …  
| У азота валентность III, высшую валентность равную номеру группы азот не проявляет, из-за отсутствия свободной орбитали. |
| 3s1 3p3 3d0 +15P …   
3s1 3p3 3d1 +15P* …   
|
У фосфора и остальных элементов VA группы в основном состоянии валентность III, а в возбужденном - V.
|
|
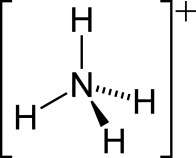
В ионе аммония и азотной кислоте валентность азота IV, за счет образования связи по донорно-акцепторному механизму. | 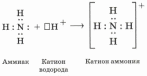
|
| 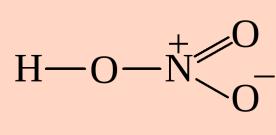
|
|
Ортофосфорная кислота, валентность фосфора V. | 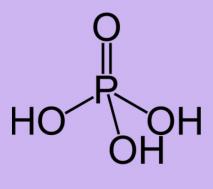
|
У элементов VIA группы высшая валентность VI, кроме кислорода:
| 2s2 2p4 +8O …   |
У кислорода валентность II.
|
| 3s2 3p4 3d0 +16S …   
3s2 3p3 3d1 +16S* …   
3s1 3p3 3d2 +16S** …    | У серы и остальных элементов VIA группы в основном состоянии валентность II, а в возбужденном – IV и VI. |
Валентность серы в различных соединениях.
У элементов VIIA группы высшая валентность VII, кроме фтора:
| 2s2 2p5 +9F …   | У фтора валентность I. Также, как и у азота и кислорода, у фтора отсутствует свободная орбиталь для распаривания электронов. |
| 3s2 3p5 3d0 +17Cl …   
3s2 3p4 3d1 +17 Cl* …   
3s2 3p3 3d2 +17 Cl** …   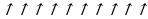
3s1 3p3 3d3 +17 Cl*** …   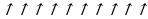
и т. д. | У хлора и остальных элементов VIIA группы (галогенов) в основном состоянии валентность I, а в возбужденном – до VII. |
У d-элементов высшая валентность совпадает с номером группы только в III – VIIВ группах, а в VIIIВ группе только у Fe, Ru, Os.
В I – IIB группах по-разному: Zn – II; Hg, Cu, Cd – I и II; Au, Ag – I, II и III.
У d-элементов в образовании химической связи могут участвовать электроны не только наружного, но и предвнешнего уровней (d-орбиталь).
| IV | 3d2 4s1 4p1 +22Ti* … 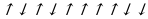   … … |
| V | 3d3 4s1 4p1 +23V* … 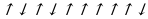   … … |
| VI | 3d5 4s1 +24Cr … 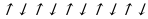  … … |
Выберите два элемента, проявляющие высшую валентность II.
1)As; 2) Сa; 3) I; 4) Te; 5) Mg.
Выберите два элемента, проявляющие одинаковую высшую валентность.
1)Cu; 2) V; 3) Cl; 4) Pb; 5) P.
3. Какие два, из перечисленных элементов, способны проявить валентность IV?
1)Ca; 2) Na; 3) Pb; 4) S; 5) Mg.
Укажите два элемента, которые не проявляют высшую валентность, равную номеру группы.
1)F; 2) O; 3) C; 4) Ge; 5) Ca.
5. У каких двух, из перечисленных элементов, высшая валентность не равна номеру группы?
1) Fe; 2) Ag; 3) Al; 4) N; 5) Mn.
6. Выберите два элемента, у которых валентность в высших оксидах равна номеру группы.
1)Ni; 2) Sn; 3) N; 4) P; 5) Cu.
7. Среди приведенных элементов выберите два, которые проявляют валентность III.
1)Ge; 2) S; 3)P; 4) Zn; 5) Al.
8. Какие два, из перечисленных элементов, проявляют валентность VII?
1)F; 2) Сr; 3) N; 4) Mn; 5) I.
9. Назовите два элемента, которые проявляют валентность II и IV.
1)Pb; 2) Si; 3) Sc; 4) P; 5) O.
10. Определите два элемента в ряду, способные проявить валентность I.
1)Na; 2) Sn; 3) Cl; 4) Ca; 5) Be.
2.2. Степень окисления.
Степень окисления (окислительное число) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций.
Степень окисления не является истинным зарядом атома в молекуле, она показывает число электронов отданных или приобретенных атомом.
Значение степени окисления показывается сверху знака химического элемента, а не сбоку, как заряд.
К примеру, 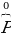 показывает как бы электронейтральный атом фосфора, т. е. число протонов и электронов в этом атоме равно.
показывает как бы электронейтральный атом фосфора, т. е. число протонов и электронов в этом атоме равно.
Запись 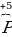 говорит о том, что у атома фосфора недостает 5 электронов (открывается положительный заряд).
говорит о том, что у атома фосфора недостает 5 электронов (открывается положительный заряд).
Запись 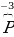 говорит, что у этого атома 3 лишних электрона (проявляется отрицательный заряд).
говорит, что у этого атома 3 лишних электрона (проявляется отрицательный заряд).
| Степень окисления свободных атомов и атомов молекулах простых веществ равна нулю. | Al, Ca, N2, Cl2, O2, H2 и т.д. |
| Металлы IA, IIA, IIIA групп в соединениях +1, +2, +3 соответственно. | 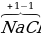 , , 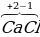 2, 2, 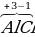 3 3 |
| Водород +1, в гидридах (NаН, СаН2 и т.д.) -1. | 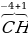 4, 4, 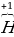 2 2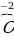 , , 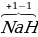 , , 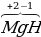
|
| Фтор в соединениях с другими элементами всегда -1. |
|
| Кислород -2, кроме фторидов и пероксидов. В фторидах +1 или +2. В пероксидах -1. | 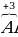 2 2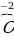 3 3
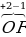 2, 2, 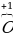 2 2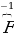 2, 2, 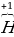 2 2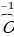 2 2
|
| Высшая степень окисления элемента = № группы.
| 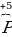 V группа V группа
|
| Низшая степень окисления неметалла = № группы – 8.
| 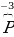 V – 8 = -3 V – 8 = -3
|
| Металлы не проявляют отрицательного степени окисления.
|
|
Сумма степеней окисления всех атомов в нейтральной молекуле = 0.
К примеру, в молекуле воды 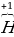 2
2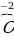 : +1 • 2 – 2 = 0
: +1 • 2 – 2 = 0
Сумма степеней окисления всех атомов в сложном ионе = заряд иона.
Например, в ионе аммония 4]+: (- 3) + 1 • 4 = +1
4]+: (- 3) + 1 • 4 = +1
Степень окисления и валентность часто численно совпадают, но не всегда.
| Примеры соединений | валентность | степень окисления |
|
Кислород в пероксидах | II | -1 |
|
H―O―O―H
|
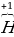 2 2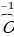 2 2
|
| Азот в ионе аммония | IV | -3 |
| 
|
 4]+ 4]+
|
| Азот в азотной кислоте | IV | +5 |
| 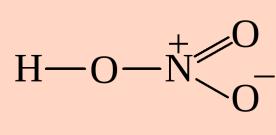
|
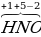 3 3
|
| Азот в гидразине | III | -2 |
|
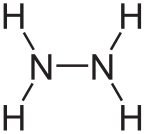
|
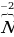 2 2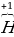 4 4
|
| Углерод в ацетиленидах, карбидах, органических соединениях | IV | -1 |
|
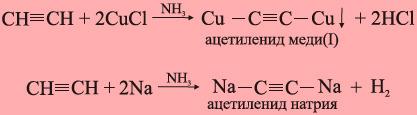
|
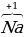 2 2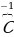 2 2
|
Атомы одного элемента, в одном и том же соединении, могут находиться в различных степенях окисления.
|
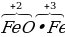 2 2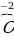 3 3
железо в железной окалине Fe3O4 |
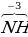 4 4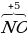 3 3
Азот в нитрате аммония |
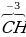 3 3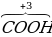
углерод в уксусной кислоте и других органических соединениях |
|
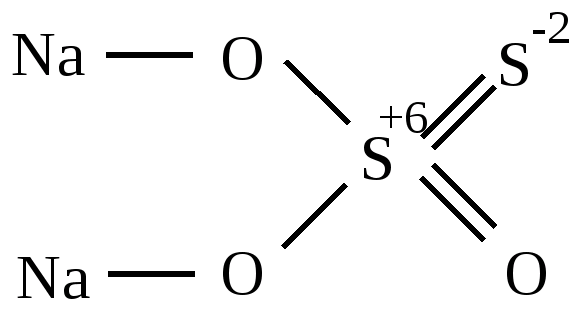
Сера в тиосульфате натрия
|
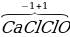
хлор в хлориде-гипохлорите кальция |
| Расставить степени окисления тех элементов, у которых они известны. Неизвестное обозначаем х. | 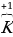 2 2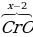 4 4
|
| Умножаем степени окисления на индексы, и записываем внизу. | 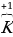 2 2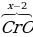 4 4
+2 -8 |
| Так как в молекуле суммарная степень окисления равна нулю, положительных и отрицательных «зарядов» должно быть одинаково. Для этого не хватает +6. | 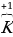 2 2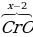 4 4
+2 +6 -8 |
| +6 делим на один атом хрома, у нас выходит степень окисления +6. | Х = +6 |
|
| 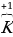 2 2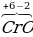 4 4
|
Еще проще в бинарных соединениях.
| Расставим степень окисления того элемента, у которого она известна. Неизвестное обозначаем х. | 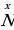 2 2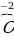 5 5
|
| Умножаем степени окисления на индексы, и записываем внизу. | 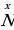 2 2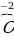 5 5
-10 |
| Так как в молекуле суммарная степень окисления равна нулю, положительных и отрицательных «зарядов» должно быть одинаково. Для этого не хватает +10. | 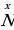 2 2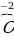 5 5
+10 -10 |
| +10 делим на два атома азота, у нас выходит степень окисления +5. | Х = +5 |
|
| 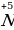 2 2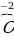 5 5
|
Для элементов в некоторых соединениях требуется запомнить степень окисления (в выше приведенных таблицах, для азота в ионе аммония и т.д.).
Для атомов металлов, с непостоянной степенью окисления (в солях) степень окисления находим исходя из заряда ионов (индексов).
| Видно, что в первом случае железо +2, а во втором +3. | FeSO4 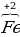 |
| Fe2(SO4)3 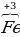 |
Определим степени окисления соединений в Fe2(SO4)3.
| Расставить степени окисления тех элементов, у которых они известны. Неизвестное обозначаем х. | 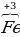 2 2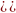 4)3 4)3
|
| Умножаем степени окисления на индексы, и записываем произведения внизу. +3 • 2 = +6 -2 • 4•3 = -24 | 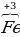 2 2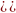 4)3 4)3
+6 -24 |
| Так как в молекуле суммарная степень окисления равна нулю, положительных и отрицательных «зарядов» должно быть одинаково. Для этого не хватает +18. | 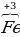 2 2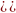 4)3 4)3
+6 +18 -24 |
| +18 делим на три атома серы, у нас выходит степень окисления серы +6. | Х = +6 |
|
| 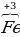 2 2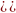 4)3 4)3
|
Вычисление степени окисления элементов в сложных ионах.
| Расставить степени окисления тех элементов, у которых они известны. Неизвестное обозначаем х. | 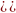 2 2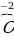 7]2- 7]2-
|
| Умножаем степени окисления на индексы, и записываем внизу. | 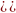 2 2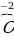 7]2- 7]2-
-14 |
| Здесь видно, что отрицательных «зарядов» должно быть на два больше. Для этого не хватает +12. | 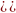 2 2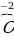 7]2- 7]2-
+12 -14 |
| +12 делим на два атома хрома, у нас выходит степень окисления +6. | Х = +6 |
|
| 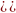 2 2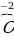 7]2- 7]2-
|
В положительном ионе:
| Расставить степени окисления тех элементов, у которых они известны. Неизвестное обозначаем х. |  4]+ 4]+
|
| Умножаем степени окисления на индексы, и записываем внизу. |  4]+ 4]+
+4 |
| Здесь видно, что положительных «зарядов» должно быть на один больше. Для этого не хватает -3. |  4]+ 4]+
-3 +4 |
| -3 делим на один атом фосфора, у нас выходит степень окисления фосфора -3. | Х = -3 |
|
|  4]+ 4]+
|
Рассчитайте степени окисления элементов в соединениях:
ClO, Cl2O, Cl2O7, HMnO4, Ca(NO3)2, K3PO4, Na2KPO4, (NH4)2SO4, NH4HCO3.
Вычислите степени окисления элементов в сложных ионах:
MnO4-, MnO42-, BrO4-, BrO3-.
11. Определите в ряду два элемента, которые проявляют степень окисления +7.
1)In; 2) Сl; 3) P; 4) Mn; 5) K.
12. Выберите в ряду два элемента, которые проявляют высшую степень окисления +1.
1)K; 2) N; 3) F; 4) O; 5) Li.
13. Какие два, из перечисленных элементов, НЕ проявляют отрицательного степени окисления?
1) Se; 2) Br; 3) H; 4) Ni; 5) Cd.
Выберите два элемента, проявляющие низшую степень окисления -3.
1)As; 2) Sn; 3) I; 4) N; 5) Br.
Выберите два элемента, НЕ проявляющие отрицательной степени окисления.
1)Cu; 2) F; 3) Cl; 4) Te; 5) K.
16. Какие два, из перечисленных элементов, проявляют в соединениях степень окисления +3?
1)Zn; 2) Mg; 3) Fe; 4) As; 5) S.
Укажите два элемента, которые проявляют низшую степень окисления -1.
1)S; 2) O; 3) I; 4) Ge; 5) Cl.
18. У каких двух, из перечисленных элементов, возможна степень окисления -1?
1) Fe; 2) O; 3) Al; 4) Br; 5) Rb.
19. Выберите два элемента, проявляющие степени окисления -4 и +4.
1)As; 2) Sn; 3) Pb; 4) Te; 5) S.
20. Среди приведенных элементов выберите два, которые проявляют степени окисления -2 и +6.
1)S; 2) Te; 3)I; 4) Br; 5) Cr.
21. Какие два, из перечисленных элементов, не проявляют высшей степени окисления, равной номеру группы?
1)Li; 2) O; 3) N; 4) Au; 5) Si.
22. Назовите два элемента, не проявляющие высшей степени окисления равной номеру группы.
1)F; 2) Si; 3) Sc; 4) P; 5) Ni.
23. Определите два элемента в ряду, у которых формула высшего оксида R2O5
1)I; 2) Mn; 3) Cl; 4) P; 5) V.
24. Выберите два элемента, высший оксид которых соответствует формуле R2O.
1)Si; 2) Cs; 3) K; 4) F; 5) Te.
25. Какие два из элементов проявляют степень окисления +4 в высших гидроксидах?
1)С; 2) Al; 3)Cu ; 4) Ag; 5) Si.
26. Выберите два элемента, образующие оксиды состава RO2.
1)B; 2) Be; 3) S; 4) K; 5) Mn.
27. Выберите два элемента, которые образуют водородные соединения состава RH2.
1)Rb; 2) O; 3) N; 4) P; 5) Se.
28. Укажите два элемента, образующие водородные соединения состава RH3.
1)S; 2) Ba; 3) N; 4) As; 5) Sr.
29. Назовите два элемента, проявляющие в простых веществах валентность I.
1)Сl; 2) Ge; 3) Ga; 4) F; 5) C.
30. Какие два, из перечисленных элементов, проявляют валентность III в простых веществах?
1) N; 2) O; 3) P; 4) Ar; 5) S.
31. Выберите два элемента, которые в соединениях проявляют постоянную степень окисления.
1)Ba; 2) N; 3) I; 4) F; 5) Br.
32. Выберите два элемента, проявляющие постоянную степень окисления в соединениях.
1)C; 2) O; 3) Al; 4) Cu; 5) Li.
33. Какие два из элементов проявляют степень окисления -4 в летучих водородных соединениях?
1)С; 2) Br; 3) Si; 4) N; 5) P.
34. У каких двух, из перечисленных элементов, встречаются степени окисления -1 и +1?
1) F; 2) Сl; 3) K; 4) H; 5) Rb.
35. Выберите два элемента, которые в оксидах проявляют степени окисления +1 и +3 .
N; 2) Cl; 3) Ge; 4) Al; 5) C.
Ответы:
| 1 | 25 | 11 | 24 | 21 | 24 | 31 | 14 |
| 2 | 25 | 12 | 15 | 22 | 15 | 32 | 35 |
| 3 | 34 | 13 | 45 | 23 | 45 | 33 | 13 |
| 4 | 12 | 14 | 14 | 24 | 23 | 34 | 24 |
| 5 | 24 | 15 | 15 | 25 | 15 | 35 | 12 |
| 6 | 24 | 16 | 34 | 26 | 35 |
|
|
| 7 | 35 | 17 | 35 | 27 | 25 |
|
|
| 8 | 45 | 18 | 24 | 28 | 34 |
|
|
| 9 | 12 | 19 | 23 | 29 | 14 |
|
|
| 10 | 13 | 20 | 12 | 30 | 13 |
|
|











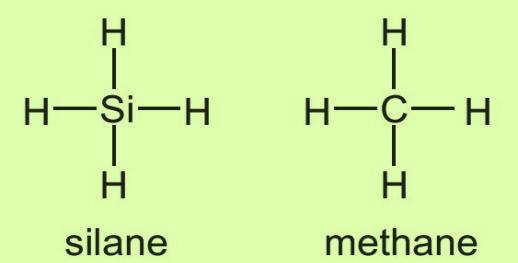

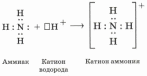
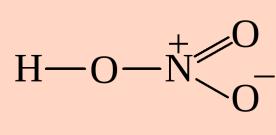

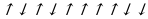
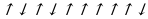
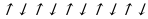
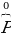 показывает как бы электронейтральный атом фосфора, т. е. число протонов и электронов в этом атоме равно.
показывает как бы электронейтральный атом фосфора, т. е. число протонов и электронов в этом атоме равно.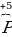 говорит о том, что у атома фосфора недостает 5 электронов (открывается положительный заряд).
говорит о том, что у атома фосфора недостает 5 электронов (открывается положительный заряд).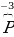 говорит, что у этого атома 3 лишних электрона (проявляется отрицательный заряд).
говорит, что у этого атома 3 лишних электрона (проявляется отрицательный заряд).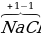 ,
, 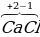 2,
2, 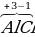 3
3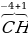 4,
4, 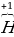 2
2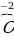 ,
, 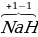 ,
, 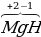
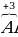 2
2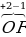 2,
2, 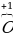 2
2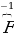 2,
2, 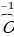 2
2  4]+: (- 3) + 1 • 4 = +1
4]+: (- 3) + 1 • 4 = +1
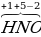 3
3
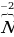 2
2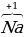 2
2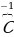 2
2 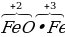 2
2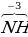 4
4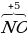 3
3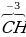 3
3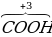

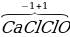
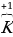 2
2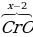 4
4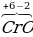 4
4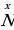 2
2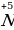 2
2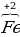
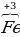
 4)3
4)3

















