
Титриметриялық (көлемдік) анализдер әдісі: Титриметриялық анализдің әдістері, қолданылу салалары. Фиксаналдар. Титрленген ерітінділерді дайындау. Титриметриялық анализдің нәтижелерін есептеу Орындаған: Молдабай Дана

Титриметриметриялы қ (көлемдік) әдістер - зерттелетін затпен химиялық реакцияға түсетін ерітінді реагенттін дәлме-дәл көлемін өлшеуге негізделген биохимиялық әдістің бірі болып табылады

Титрлеу тәсілдері
- Жеке өлшеу әдісінде аналитикалық таразыда дәл мөлшерде стандартты заттарды А өлшейді де , оны колбаға салып белгілі бір мөлшердегі суда ерітеді.
- Одан кейін индикатор косып , түстің өзгергеніне дейін титрлейді . Бюретканың көрсеткіші бойынша ерітіндінің көлемін яғни титрлеуге кеткен көлемді анықтап нақты титранттын концентрациясын білуге мүмкіндік береді.

Пипеткалық әдіс - өлшеуіш колбада стандартты заттың белгілі концентрациясын алып ерітінді дайындаймыз . Калибролық пипетканың көмегімен аликвотаны іріктейді − дәл өлшенген стандартты ерітіндінің көлемін, колбаға ауыстырады, оған индикатор қосып , оны жұмыс (стандартизируемым) ерітіндісімен титрлейді.
Бұл әдіс ен карапайым әрі жылдам әрі оңай әдіс болып табылады алайда әрқашанда накты емес.
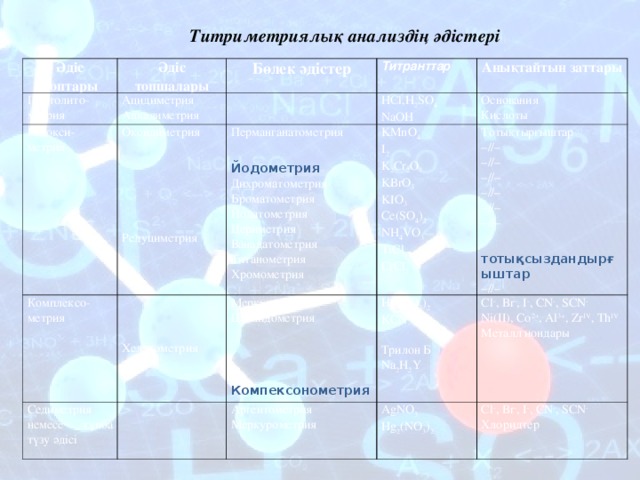
Титриметриялық анализдің әдістері
Әдіс топтары
Протолито-
метрия
Әдіс топшалары
Ацидиметрия
Алкалиметрия
Редокси-
метрия
Бөлек әдістер
Титранттар
Комплексо-метрия
Оксидиметрия
Редуциметрия
HCl,H 2 SO 4
NaOH
Перманганатометрия
Седиметрия немесе тұнба түзу әдісі
Хелатометрия
Анықтайтын заттары
Меркуриметрия
Цианидометрия
Йодометрия
Основания
Кислоты
KMnO 4
I 2
K 2 Cr 2 O 7
KВrO 3
KIO 3
Cе(SO 4 ) 2
NH 4 VO 3
TiCl 3
CrCl 2
Аргентометрия
Меркурометрия
Тотықтырғыштар
– //–
– //–
– //–
– //–
– //–
– //–
Hg(NO 3 ) 2
KCN
Трилон Б
Na 2 H 2 Y
Компексонометрия
Дихроматометрия
Броматометрия
Йодатометрия
Цериметрия
Ванадатометрия
Титанометрия
Хромометрия
Cl - , Br - , I - , CN - , SCN -
Ni(II), Co 2+ , Al 3+ , Zr IV , Th IV
Металл иондары
AgNO 3
Hg 2 (NO 3 ) 2
тотықсыздандырғыштар
– //–
Cl - , Br - , I - , CN - , SCN -
Хлоридтер

Титриметриялық анализ әдісінің негізі – өте жоғары дәлдік анализі және экспресстілік. Титриметрия фармацевтикалық анализде кеңінен қолданылады . Заттарды сандық анықтауда базалы түрде титриметрия физико-химиялық әдістермен негізделіп титрлеу жүреді: потенциометриялық, кондуктометриялық кулонометриялық, амперометриялық, спектрофотометриялық титрлеу. Емдік препараттарды алған кезде де бұл титрлеу әдістері оларды анықтап тексеру үшін пайдаланылады. Қышқылдар мен негіздердің күштерін өзгертуде, қасиеттерін жоғарылатуда дифференцирленген және нивелирленген ерітінділерді қолданады. Мысалы, офлоксацинді титрлеу мұз ацетат қышқылын және ацетат ангидридтің түзілуіне әкеледі. Осы кезде титрант ретінде перхлорид қышқылы ерітіндісін қолданады.

Калий перманганаты ерітіндісін перманганатометрия әдісімен дайындайды
![Иодометрияда:Кристаллдық йод суда аз ериді. Сондықтан да стандарт ретінде ылғи да КІ ерітіндісін қолданады. І 2 -ні еріткен кезде КІ-тан [І 3 ] - иондары түзіледі:](https://fsd.multiurok.ru/html/2017/02/10/s_589dd94926b7d/img7.jpg)
Иодометрияда:Кристаллдық йод суда аз ериді. Сондықтан да стандарт ретінде ылғи да КІ ерітіндісін қолданады. І 2 -ні еріткен кезде КІ-тан [І 3 ] - иондары түзіледі:

Броматометрия әдісінде метилоранж немесе метилқызыл индикаторларын пайдаланады

Фармацевтикалық анализда бұл әдісті органикалық қосылыстарды анықтауда, сонымен қатар кейбір органикалық қосылыстар бромдану реакциясына түсуге қабілетті, бұл бос броммен әрекеттескен кезде жүреді, мысалы:
С 6 Н 5 ОН + 3Вr 2 = C 6 H 2 Br 3 OH + 3HBr.
Бром КВrO 3 мен КВr қышқыл ортада әрекеттескенде түзіледі, бұл титрлеу кезінде орын алады, сол кезде органикалық қосылыстардың құрамына мән береді.
Броматометрия кезінде жұмыс ерітіндісі ретінде 0,1 н КВrO 3 ерітіндісі болып, қайта кристаллданған жағдайда және 150-180 С температурада құрғақ күйінде дайындайды.
Нитритометрикалық әдіс анализі фармацевтикалық препараттарды анықтауда жиі қолданылады, мысалы: стрептоцид, левомицетин, сульфометоксазол препараттарын анықтауда:

Титриметриметриялық әдістер анализі
Титриметрия кеңінен қолданылады, ерітіндідегі жоғары және орташа концентрациялы заттарды айқындау кезінде кеңінен қолданылады (1·10-4 моль/л немесе 10 мг/л).
Төменгі концентрациялы заттарды анықтау үшін мақсатталмаған титриметрияны қолдануға болады , себебі ол алдын ала концентрациялауды қажет етеді Ал ол анализді ұзаққа создырып қателіктін шығуына әкеледі . Жалпы орташа салыстырмалы қателік титриметриметриялық өлшеуде 2% - дан аспайды және пайдаланылатын өлшегіш ыдыс классымен анықталады.

Химиялық реакция типіне байланысты титриметриялық әдістің классификациясы
1. Қышқылды-негізді титрлеу әдісі
Бейтараптандыру реакциясын қолданіға негізделген Қышқылдар, негіздер және тұздарды анықтау үшін пайдаланады және олар гидролиз кезінде кышқылды негізді орта құрайды Әр түрлі тәсілдермен ұштаса отырып анықтау үшін әр түрлі параметрлері сынама алуда қолданылуы мүмкін.
Күкіртті органикалық және биологиялық материалдарда анықтау . Үлгіні оттегі тогында өртейді . Пайда болған күкірт оксиді ( IV) және ( VI) оны сутегі тотығы ерітіндісімен ерітеді:
SO 2 + H 2 O 2 = H 2 SO 4
Күкірт қышқылын стандартты сілітілі ерітіндімен титрлейді.

Химиялық реакция типіне байланысты титриметриялық әдістің классификациясы
2. Тұнбалы әдіспен титрлеу
Зерттелетін зат өзара титрантпен байланысқан кезде аз еритін қосылыстар түзеді.
Бұл әдістің кеңінен пайдаланатын түрі – аргентометриялық тирлреу болып табылады , ол өз алдында аниондардың концентрациясын анықтауға мүмкіндік береді ( Hal - , CN - , PO 4 3- , CrO 4 2- и др.), олар аз еритін заттармен байланысқа түседі:
Ag + + Cl - = AgCl ↓

Химиялық реакция типіне байланысты титриметриялық әдістің классификациясы
3. комплексометриялық әдістер бойынша титрлеу
Зерттелетін затпен титранттын нашар иондалған кешендерді түзуге негізделген .
Комплексонометриялық титрлеуде –трилон Б- мен титрлеу Na 2 H 2 Y · 2H 2 O :
Са 2+ + Н 2 Y 2- = CaH 2 Y Mg 2+ + Н 2 Y 2- = MgH 2 Y
Н 2 Y 2- =
Титрлеудің соңғы нүктесін металлиндикатормен немесе патенциометриялау арқылы анықтайды .

4. Перманганатометрия. Бихроматометрия. Иодометрия .
KMnO4 → K+ + MnO4- , MnO4- - күшті тотықтырғыш , ол реакция ортасына байланысты тотықсызданады: қышқыл ортада
MnO4- + 5e + 8H+→ Mn2+ + 4H2 O E = 1.51 в, m э = M(KMnO4)/5 = 31.5 г/моль. Негіздік, бейтарап ортада MnO4- + 3e + 3H2O→MnO(OH)2 +4OH-
m экв. = M( KMnO4)/3 = 52.68 г/моль, E = 0.59 в.
Бұл реакциялардан KMnO4 – тің қышқыл ортадағы тотықтырғыш қабілетінің жоғарылылығын көруге болады. Сонымен бірге түссіз Mn2+ - ионы түзіледі,сондықтан эквивалент нүктені анықтау қиындық туғызбайды. Перманганатометрия әдісі индикаторсыз жүреді. Перманганатта әр уақытта MnO2 қоспасы болады және күн сәулесінен, тотықсыздандырғыштар әсерінен тез айрылады,сондықтан оның концентрациясы алғашқы уақытта тез азаяды. Перманганат концентрациясын 7-10 күн өткен соң ғана анықтайды. Перманганат ерітіндісін қоңыр түсті шыны ыдыста, қараңгы жерде сақтау қажет. Перманганаттың 0,02-0,05н. ерітіндісін титрлеуге қолданады.
KMnO4 ерітіндісінің титрін H2C2O4 2H2O, Na2C2O4 ерітінділері арқылы анықтайды.
2 MnO4- + 5C2 O42- + 16H+ → 2 Mn2+ +8H2O + 10CO2
C2O42- - 2e → 2CO2
MnO4- - 5e +8H+ → Mn2+ + 4H2O
m экв. Na2C2O4 = 134/2; m экв. H2C2O4 2H2O = 126.06/2.

Химиялық реакция типіне байланысты титриметриялық әдістің классификациясы
Броматометрия – титриметриялық әдістің түрі Ол броммен реакцияға түсетін органикалық қосылыстарды анықтау үшін қажет органических соединений. Титрант ретінде KBrO 3 ерітіндісін пайдалануға негізделген
Йодометрия – реакциға негізделген тотығу және қалпына келтіру үшін пайдаланылатын тетраметриялық әдіс
I 3 - + 2 е = 3 I -
Ион I 3 - йодтың құрамында KI бар суда еріткен кезде пайда болады . Қалпына келтіргіштерді тура титрлеу арқылы I 2 ерітіндісімен KI қатысымен анықталады , тотықтырғыштар – KI байланысу арқылы пайда болған йодтың саны бойынша жанама әдіс болып табылады . Йод Na 2 S 2 O 3 титрлеп шығарады .
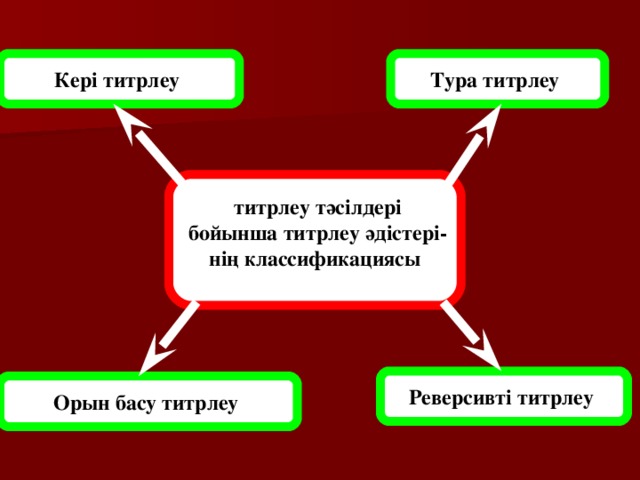
Тура титрлеу
Кері титрлеу
титрлеу тәсілдері
бойынша титрлеу әдістері-
нің классификациясы
Реверсивті титрлеу
Орын басу титрлеу

Тура титрлеу
- . Мысалы, сілтіні қышқылмен (не керісінше) титрлеу. Бұл жағдайда анықталатын зат бірден титрантпен титрленеді, яғни бір ғана стандарт ерітінді керек. Егер қышқыл-негізді титрлеуде (нейтралдау әдісі) қышқылдың мөлшерін анықтаса, онда ол әдіс алкалиметрия ( титрант – негіз) деп, негіз мөлшерін анықтаса –ацидиметрия ( титрант – қышқыл) деп аталады.
А + Т(титрант) = өнім

Кері титрлеу
- Тура реакцияның жылдамдығы аса жоғары емес;
- Қажетті индикатор жоқ;
- Зерттелетін заттың ауаға ұшып кетуіне байланысты .
А + Т 1 (артық) = өнім 1 + T(қалдық)
T(қалдық) + Т 2 = өнім 2

Кері титрлеу
Бұл жағдайда екі титрленген ерітінді керек: бірі негізгі, екіншісі қосымша. Мысалы, қышқыл ортадан хлорид-ионын кері титрлеу. Анализге түсетін хлорид-ионы бар ерітіндіге алдын ала титрленген күміс нитратының ерітіндісінің белгілі мөлшерін құяды ( V ж) (негізгі ерітінді): Бұл кезде мына реакция жүреді:
Ag + + Cl- = AgCl Реакцияға түспей қалған күміс нитратының артық мөлшерін ( V а) аммоний тиоцианат ерітіндісімен (қосымша ерітінді) титрлейді: Ag + +SCN- = AgSCN Хлоридтің мөлшерін ерітіндіге құйылған күміс нитратының жалпы көлемінен реакцияға түспей қалған күміс нитраты ерітіндісінің көлемін алып тастау арқылы анықтайды, яғни хлорид-ионымен реакцияға түскен күміс нитратының көлемін V деп белгілесек
V= V ж - V а а)Кері тирлеу әдісін көбінесе анықталатын затты титрлеуге қажет индикатор болмаса, не негізгі реакция баяу жүретін болса , қолданады.

Орын басу (заместитель) титрлеу
- Анықталатын зат берілген титрантпен байланысқа түспейді;
- Титрант пен зерттелетін заттың бір бірімен әсерлесуі кейбір өнімдедің түзілуіне әкеледі
- Қажетті индикатор жок;
- Анықталатын зат тұрақты емес .
А + В(реагент) = А 1 (жанама)
А 1 (жанама) + Т =өнім

Орын басу
- 2. Орын басу реакциясын қолданып титрлеуді көбінесе анықталатын зат стандартты затпен әрекеттеспесе, не стехиометриялық қатынаста әрекеттеспесе ғана қолданады. Бұл жағдайда анықталатын ионды стандартты ерітіндімен әрекеттесетін химиялық қосылысқа айналдырады. Мысалы, калий дихроматымен анықтағанда калий дихроматы мен натрий тиосульфатының арасында реакция стехиометриялық қатынаста жүрмейді. Сондықтан калий дихроматының ерітіндісіне калий иодиді ерітіндісін құяды, сонда дихроматқа эквивалент йод бөлінеді:
- Cr2O7 2- + 14 H+ + 6I- = 2Cr3+ + 3I2 + 7H2O
- Бөлінген йодты натрий тиосульфатымен титрлеп, тиосульфат мөлшері арқылы дихроматтың мөлшерін есептейді: 3 I2+6S2O3 2- =3S4O6 2- +6 I-

Орын басу (Заместительное) титрлеу
Мысалы үшін, калий дихроматы титрантпен Na 2 S 2 O 3 байланысы стехиометриялы емес. Сондықтанда зерттелетін заттың ерітіндісіне K 2 Cr 2 O 7 реагент KI қосады , нәтижесінде йодтың эквивалентті саны шығады , ол стандартты натрий тиосульфат ерітіндісімен титрленіп шығады.
K 2 Cr 2 O 7 + 6KI + 7H 2 SO 4 = 3I 2 + 4K 2 SO 4 + Cr 2 (SO 4 ) 3 + 7H 2 O
I 2 + 2Na 2 S 2 O 3 = Na 2 S 4 O 6 + 2NaI

Реверсивті титрлеу
При реверсивті титрлеу кезінде анықталатын заттың ерітіндісімен стандартты реагенттің ерітіндісімен титрлейді :
А(бюреткада) + Т ( колбада) = өнім

Титримериялық анализдеуде негізгі концентрация түрлері
Молярлы
Массалық
Нормаль
Молярлі
концентрация С М
(заттың саны n)
Еріген заттың
ерітіндінің көлеміне
Қатынасындай тең
Массалық
концентрация – еріген зат
массасының mS
ерітінді көлеміне
V қатынасы, массалық
концентрацияның
өлшем бірлігі
кг·дм-3 немесе кг·л-1,
сонымен бірге еселік
бөлшектік бірліктер.
Бір миллилитрдегі
заттың грамымен
өрнектелген массалық
концентрацияны титр
деп атайды.
Классикалық анализ әдісінің бірі
титриметрияның аталуы
осы терминмен байланысты.
Молярлы масса (М) – бұл
1 моль заттың массасы.
Егер массасы m зат
берілген болса, онда
М=m/n
. Молярлы
массаның өлшем бірлігі г·моль-1.
Саны жағынан молярлы
масса салыстырмалы
молекулалық
массаға тең, яғни бөлшектегі
барлық атомдардың
қосынды массасының
көміртегі атомының 1/12
массасына қатынасына тең.
n

Титрлі ерітінділер дайындау
1. Анықтайтын заттың өлшемі (біріншілік стандартты ерітінді);

Біріншілік стандартты ерітінділер тек стандартты заттардан ғана дайындалады , ал олар мына талаптарға жауап беру қажет:
- белгілі бір зат химиялық таза күйінде оңай алныу қажет , оның құрамы химиялық формулаға сай болуы және сақтау кезінде бұзылмауы қажет;
- Құрғақ куіндеде де ерітінді түріндеде сақталуға тұрақты болу қажет;
- Суда жақсы еру қасиеті болу қажет (немесе кез келген ерітіндіде);
- Мүмкіндігі болғанша, молярлы массасы үлкен болуы қажет, себебі ол қателіктің кетпеуіне ықпалын тигізеді.
Натижесінде таза химиялық заттармен титрленген ерітінділер дайындауға : K 2 Cr 2 O 7 , KBrO 3 , H 2 C 2 O 4 , Na 2 B 4 O 7 .

Титрленген ерітінділер дайындау
2. " фиксаналдың көмегімен (первичный стандартты ерітінді)
Фиксаналдар (стандарт-титры, біріншілік стандарты) – заттарды қатаң белгілі бір мөлшерде болуы қажет, әдетте 0,1 моль , шыны ампулаларда қамтылған. Ампуланы арнайы затпен воронка ішінде сындырады. Құрамындағыны өлшеуіш колбаға құйып белгілі бір көлемге деін сумен ерітеді. Нәтижесінде алынған ерітіндін титриметрияда титрант ретінде пайдаланады. Фиксанал ретінде көбінесе мыналар пайдаланылады, , KMnO 4 , K 2 Cr 2 O 7 , HCl, AgNO 3 и др.

Титрленген ерітінділер дайындау
3. Ерітіндіні кажетті концентрацияға шамалас етіп дайындайды, накты концентрацияны стандартты заттармен анықтайды немесе стандартты ерітінділермен (екіншілік стандартты ерітінді);
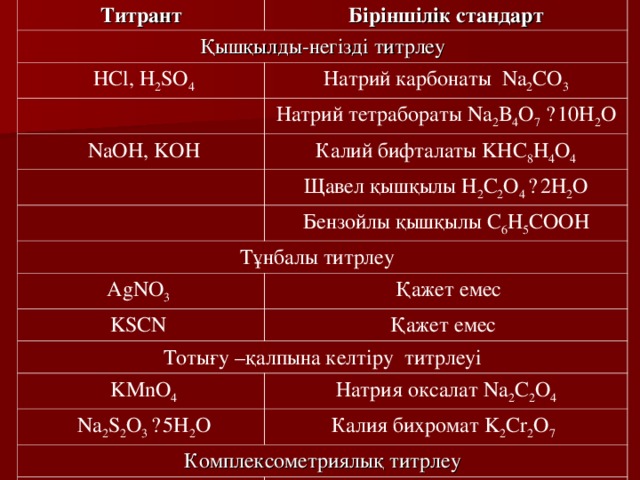
Титрант
Біріншілік стандарт
Қышқылды-негізді титрлеу
HCl, H 2 SO 4
Натрий карбонаты Na 2 CO 3
Натрий тетрабораты Na 2 B 4 O 7 · 10H 2 O
NaOH, KOH
Калий бифталаты KHC 8 H 4 O 4
Щавел қышқылы H 2 C 2 O 4 · 2H 2 O
Бензойлы қышқылы C 6 H 5 COOH
Тұнбалы титрлеу
AgNO 3
Қажет емес
KSCN
Қажет емес
Тотығу –қалпына келтіру титрлеуі
KMnO 4
Натрия оксалат Na 2 C 2 O 4
Na 2 S 2 O 3 · 5H 2 O
Калия бихромат K 2 Cr 2 O 7
Комплексометриялық титрлеу
Na 2 C 10 H 14 N 2 O 8
Не требуется
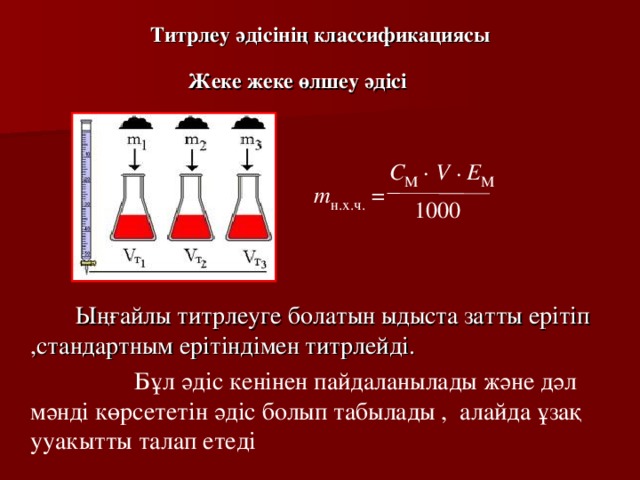
Титрлеу әдісінің классификациясы
Жеке жеке өлшеу әдісі
Ыңғайлы титрлеуге болатын ыдыста затты ерітіп ,стандартным ерітіндімен титрлейді.
Бұл әдіс кенінен пайдаланылады және дәл мәнді көрсететін әдіс болып табылады , алайда ұзақ ууакытты талап етеді

Пипетирлеу әдісі
Аналитических таразыда өлшенеді химиялық зат. Оны өлшеуіш колбаға ауыстырп , еріткішпен яғни ерітіндімен беогіге дейін ерітеді . Аликвотты бөлігін пипетканын көмегімен жасалганын коникалық колбаға ауыстырады және оны стандартты ерітіндімен титрлейді.
Аликвота – ерітіндінің көлемі, калибрлі
пипеткамен өлшенген нақты мән

Классикалық титрлеуге арналған құрылғы екі негізгі бөліктерден тұрады: ыдыс титрлеу үшін және бюреткалар.
Индикатором көмегімен титрлеу үшін Эрленмейердің колбасын пайдаланамыз(коническую колбу).
Коническалық колбы (Эрленмейера) аналитическалық жұмыстар үшін пайдаланылады (титрлеуде)
- әр түрлі көлемде қысыммен және қысымсыз Жіңішке ауызды және жуанауызды шлифпен және шлифсіз
- әр түрлі көлемде
- қысыммен және қысымсыз
- Жіңішке ауызды және жуанауызды
- шлифпен және шлифсіз

Бюретка градуирленген шыны түтік пен төменгі жағында жабылатын құрылғысымен – кранмен, Мора қысқышы бар немесе бусина, ол титранттын өздігінен ағуына мүмкіндік бермейді , оны колбаға титрлеу үшін шағын аз мөлшерде, тіпті тамшы түрінде тирлеуге мүмкіндік береді.

Титрлеу техникасы
1. Пайдалану алдында бюретка мұқиятдистилденген сумен жуулу тиіс
2. Бюретканы аз мөлшерде титрленген ерітіндімен 3 рет шаяды.
3. Бекітіп, оны штативе тігінен толтырады , титрантпен нөлдік белгі ге дейін келтіреді.Ішіндегі ауа көпіршіктерін шығарылып және толығымен ерітіндімен толтырылған. Ауаны шығару үшін резеңке клапанын, көтеру соңына, бюреткалар, төменнен ашады қысқыш – ерітіндісімен
Бюретканы шыны воронканын көмегімен толтырады да, воронканы бюреткадан алып тастайды .

Титрлеу Техникасы
4. титрлеу үшін бюретканын соңы астына 1-2 см түсіп тұру қажет.
5. Титрлеу қажетті натижеге жеткенге дейін жалғаса береді.

Пипеткалар белгілі бір заттың дәлме дәл көлемін анықтау үшін қажет
Пипеткалар:
- қарапайым (пипетки Мора) градуирленген
- қарапайым (пипетки Мора)
- градуирленген
Пипетканы толтыру үшін
Резеңкелі груша қолданылаады


Титрлеудін соңғы нүктесін анықтау
- Индикаторлық электродтар потенциометрлік, амперметрлік немесе кондуктометрлік тәсілдермен титрлеу кезінде соңғы нүктені айқындау үшін қызмет етеді. Кулонометрлік титрлеуді жүргізгенде алдын ала тексеруші титрлеу жүргізу ұсынылады. Ол үшін қондырғыны толық жинастырып алған соң титрленетін ерітіндінің шамалы бөлігін электролиті бар ұяшыққа енгізеді де, соңғы нүктеге дейін электролизді жүргізеді.
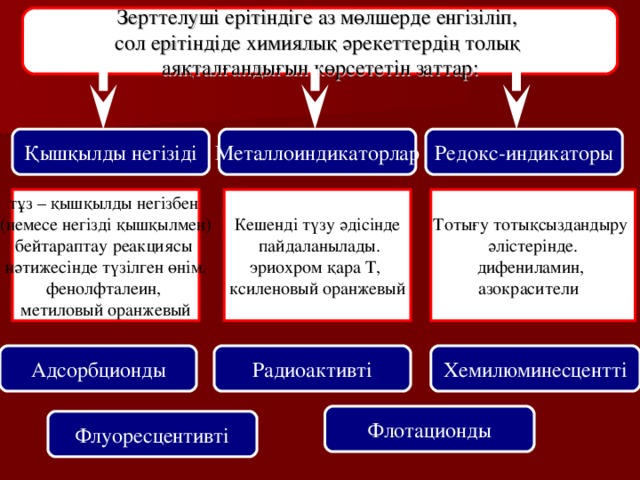
Зерттелуші ерітіндіге аз мөлшерде енгізіліп,
сол ерітіндіде химиялық әрекеттердің толық
аяқталғандығын көрсететін заттар:
Қышқылды негізіді
Металлоиндикаторлар
Редокс-индикаторы
тұз – қышқылды негізбен
(немесе негізді қышқылмен)
бейтараптау реакциясы
нәтижесінде түзілген өнім.
фенолфталеин,
метиловый оранжевый
Кешенді түзу әдісінде
пайдаланылады.
эриохром қара Т,
ксиленовый оранжевый
Тотығу тотықсыздандыру
әлістерінде.
дифениламин,
азокрасители
Адсорбционды
Радиоактивті
Хемилюминесцентті
Флотационды
Флуоресцентивті
Титрант ретінде қолданылатын ерітінділерді стандарттау
- Титранттардың өте дәл концентрацияларын дайындайды не анықтайды.
- 1. Титрантарды дайындағанда өте жоғарғы дәлдікпен титрантқа керек затты аналитикалық таразыда өте жоғары дәлдікпен өлшеп ( g, г), судың белгілі көлемінде ( V, мл) ерітеді, яғни сонда титрі белгі болады Т= g/V;
- 2. Бірақ көп заттардан былай титрант дайындау қиын, себебі мына айтылған талаптар сақталмайды, ол үшін титрант дайындалатын заттар мынандай талаптарға жауап берулері керек:
- а) заттар химиялық таза (х.т., техн.т., т.а.ү., ас.т.) болулары керек;
- б) заттың құрамы оның формуласына сәйкес келуі керек;
- в) заттарды ерітінді күйінде не қатты күйінде сақтағанда құрамы өзгермеуі керек;
- 3. Жоғарыда көрсетілген талаптар орындалмаса, титранттың концентрациясын жуықтап дайындап, басқа концентрациясы дәл анықталған затпен стандарттайды, яғни анықтайды. Ол үшін көбіне фиксаналдар қолданылады.
- 4. Фиксаналдар заттардың тура өлшенген көлемі не қатты күйіндегі мөлшері шыны ампулада сақталады, сосын ол мөлшерді 1 л көлемде ерітіп, стандартты ерітінді дайындайды.
- Титриметрлік әдісте эквивалент нүктені табу үшін индикаторлар қолданылады. Индикаторларға лакмус, фенолфталеин, метилоранж т.б. органикалық заттар жатады.

Қолданылатын химиялық реакциияға байланысты титриметриялық әдістің классификациясы
Екі индикаторлық электродпен амперметрлік титрлеу әдістері. Бұл әдісті алғаш Саломон (1897) ток тоқтап қалғанға дейін күміс электродын пайдаланып, титрлеу арқылы күміс және басқа да металдарды сандық тұрғыдан анықтау үшін қолданады.Бертін келе Нернст пен Мерриам (1905) ине сияқты палладий электродтарын пайдаланып, қышқылдық-негізді титрлеуді жүргізді, атап айтқанда, калий нитратының ерітіндісіндегі қышқылдың шамалы мөлшерін сілтімен титрледі. Ацидиметрия − стандартты қышқыл ерітіндісімен титрлеу арқылы затты анықтау. Алкалиметрия − стандартты күшті негізді ерітіндісімен титрлеу арқылы затты анықтау;

Тотығу − тотықсыздандыру титрлеу (редоксиметрия) пайдаланылады реакциялар тотығу –қалпына келтіру.

Титраторлар
Титраторлар – жартылай немесе толық автоматтандырылған жүйеде өлшеуге арналған аспап . Берілген титраторға бағдарламалық қамтамасыз ету жүйесі, автоматты түрде алынған мәліметтер бойынша қисық титрлеуді құруға және соңғы титрлеу нүктесін және зерттелетін ерітіндінің концентрациясын есептеуге мүмкіндік береді .
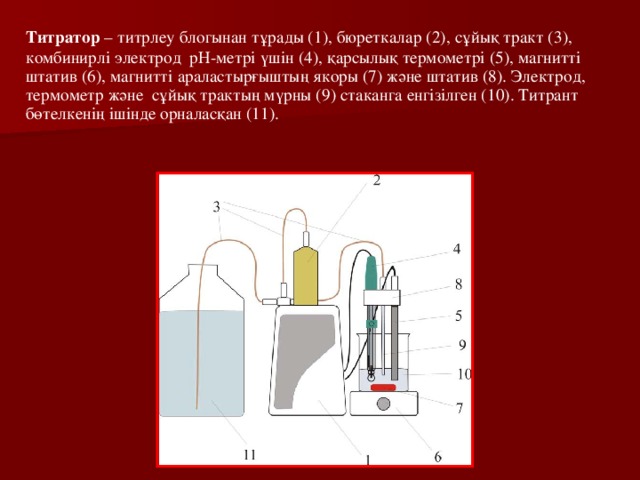
Титратор – титрлеу блогынан тұрады (1), бюреткалар (2), сұйық тракт (3), комбинирлі электрод рН-метрі үшін (4), қарсылық термометрі (5), магнитті штатив (6), магнитті араластырғыштың якоры (7) және штатив (8). Электрод, термометр және сұйық трактың мүрны (9) стаканга енгізілген (10). Титрант бөтелкенің ішінде орналасқан (11).
Стандартты заттар, олардың ерітінділерін дайындау
Гравиметриялық әдіс бойынша затты өте жоғарғы дәлдікпен анықтауға болады, бірақ бұл әдіс көп уақытты керек етеді.
Титриметрлік әдіс тез орындалады, яғни анализдің нәтижесін тез алады.
Титриметрлік анализ әдісі анықталатын затпен реакцияға түсуге кеткен реактивтің мөлшерін өлшеуге негізделген. Титр – ерітіндінің концентрациясын көрсетеді, яғни титр – 1 мл ерітіндідегі еріген заттың грамын көрсетеді – Т.
Егер ерітіндінің титрі дәл анықталған болса, ондай ерітінді титрленген (не стандартты ерітінді) деп аталады, оны титрант дейді.
Титрленген ерітіндіні анықталатын заттың ерітіндісінің эквивалент мөлшеріне дейін қосса, оны титрлеу дейді.
Титрант қосқанда оның мөлшері титрленетін заттың мөлшеріне дәл келсе, ол эквивалент нүктесі (э.н. ) деп аталады.
Кез келген химиялық реакция титриметрлік әдіске қолданылмайды.
Титриметрлік әдісте қолданылатын реакциялар мынандай талаптарды қанағаттандырулары керек:
1. Реакция аяғына дейін жүруі керек, яғни реакцияның тепе-теңдік константасы өте үлкен болуы керек;
2. Реакция өте үлкен жылдамдықпен жүруі керек;
3. Керек реакция жүрген кезде қосымша реакциялар жүрмеуі керек;
4. Реакция аяқталғанын анықтайтын әдіс болуы керек.
Бұл талаптардың біреуіне ғана жауап бере алмасада, ол реакция титриметрлік әдіске қолданылмайды.

Титриметрикалық анализде қолданылатын формулалар
- Жеке өлшеу әдісі
- Эквиваленттің молярлы массына байланысты
(тура және жанама титрлеу)
ω , %
(кері титрлеу)
ω , %
- по величине титра титранта по определяемому веществу
(тура және жанама титрлеу)
ω , %
ω , %
(кері титрлеу)

Титриметрикалық анализде қолданылатын формулалар
Пипеткалау тәсілі
Эквиваленттің молярлы массына байланысты
(тура және орынбасу титрлеу)
ω , %
ω , %
(1. Кері титрлеу, не қалдық бойынша титрлеу)
(тура және орынбасу титрлеу)
ω , %
(1. Кері титрлеу, не қалдық бойынша титрлеу)
ω , %
 7(неге?), әлсіз негізді күшті қышқылмен титрлегенде э.н. рНCH3COOH+NaOH CH3COONa +H2O әлсіз қышқыл CH3COO- + H2O↔ CH3COOH+ ОН- рН7 NH4OH + HCl NH4Cl + H2O әлсіз негіз NH4+ + H2O↔NH4OH + H+ рНHCl+NaOHNaCl + H2O рН7 . " width="640"
7(неге?), әлсіз негізді күшті қышқылмен титрлегенде э.н. рНCH3COOH+NaOH CH3COONa +H2O әлсіз қышқыл CH3COO- + H2O↔ CH3COOH+ ОН- рН7 NH4OH + HCl NH4Cl + H2O әлсіз негіз NH4+ + H2O↔NH4OH + H+ рНHCl+NaOHNaCl + H2O рН7 . " width="640"
Кері титрлеу әдісі арқылы кей тұздардың (М, кальций не аммоний тұздарының) мөлшерін анықтайды. Қышқыл-негіздік титрлеу арқылы заттың 0,10% массасын анықтайды, бұл әдіс 0,5% салыстырмалы қате жібереді.
Бұл әдісте қышқыл-негізді индикаторлар қолданылады:
1.Күшті қышқылды күшті негізбен титрлеу;
2. Әлсіз қышқылды күшті негізбен титрлеу;
3. Күшті негізді күшті қышқылмен титрлеу;
4. Әлсіз негізді күшті қышқылмен титрлеу;
5. Әлсіз қышқылды әлсіз негізбен(не керісінше)титрлеу.
Бұл әдісті қолданып, тамақтық қышқылдардың (сірке қышқылының, лимон қышқылының, сүт қышқылы және алма қышқылдарының) мөлшерін анықтауға болады
Заттың мөлшерін анықтау үшін бюреткадағы титранттан (қышқылдың, не негіздің стандартты ерітіндісі) анықталатын затқа индикатор түрі өзгергенше тамшылатылады. Күшті қышқыл мен күшті негіз әрекеттескенде эквивалент нүктеде рН7, әлсіз қышқылды күшті негізмен титрлегенде эквивалент нүкте рН7(неге?), әлсіз негізді күшті қышқылмен титрлегенде э.н. рН
CH3COOH+NaOH CH3COONa +H2O
әлсіз қышқыл
CH3COO- + H2O↔ CH3COOH+ ОН- рН7
NH4OH + HCl NH4Cl + H2O
әлсіз негіз
NH4+ + H2O↔NH4OH + H+ рН
HCl+NaOHNaCl + H2O рН7
.
![Қышқыл-негіздік индикаторлар Қышқыл-негіздік индикаторлар- әлсіз органикалық қышқылдар не негіздер. Олардың иондары мен молекулалары әр түрлі түсті болады(боялады). Егер қышқыл индикаторды HInd деп, негіз индикаторды IndOH деп белгілесек: HInd↔ H+ + Ind- - лакмус NaOH қосса → қызыл түс көкке; HCl қосса,көк түс қызылға ауысады, сондықтан лакмустің судағы ерітіндісі күлгін түсті (қызыл+көк). Егер индикатордың ионы да, молекуласы да боялатын болса, ондай индикаторларды екі түсті деп атайды, егер не молекуласы, не ионы ғана боялатын болса, ондай индикаторлар бір түсті деп аталады. Сонымен, индикаторлардың молекуласы мен иондарының әр түсті болғандығы, олардың түсінің ерітіндінің рН-на байланысты өзгеретіндігін түсіндіреді Сонымен, қышқылдық индикатор үшін HInd↔ H+ + Ind- , негіздік индикатор үшін IndOH Ind+ + OH- тепе-тендіктерін жазуға болады. Бұл тепе-теңдіктер үшін әрекеттесуші массалар заңын қолданса, Кдисс =[ H+][ Ind-]/[ HInd], Кдисс =[ Ind+][ OH- ]/ [ IndOH- ] V T 0 5 9 9,9 9,99 10 10,01 10,1 11 15](https://fsd.multiurok.ru/html/2017/02/10/s_589dd94926b7d/img50.jpg)
Қышқыл-негіздік индикаторлар
Қышқыл-негіздік индикаторлар- әлсіз органикалық қышқылдар не негіздер. Олардың иондары мен молекулалары әр түрлі түсті болады(боялады).
Егер қышқыл индикаторды HInd деп, негіз индикаторды IndOH деп белгілесек:
HInd↔ H+ + Ind- - лакмус
NaOH қосса → қызыл түс көкке; HCl қосса,көк түс қызылға ауысады, сондықтан лакмустің судағы ерітіндісі күлгін түсті (қызыл+көк).
Егер индикатордың ионы да, молекуласы да боялатын болса, ондай индикаторларды екі түсті деп атайды, егер не молекуласы, не ионы ғана боялатын болса, ондай индикаторлар бір түсті деп аталады.
Сонымен, индикаторлардың молекуласы мен иондарының әр түсті болғандығы, олардың түсінің ерітіндінің рН-на байланысты өзгеретіндігін түсіндіреді
Сонымен, қышқылдық индикатор үшін HInd↔ H+ + Ind- , негіздік индикатор үшін IndOH Ind+ + OH- тепе-тендіктерін жазуға болады. Бұл тепе-теңдіктер үшін әрекеттесуші массалар заңын қолданса,
Кдисс =[ H+][ Ind-]/[ HInd], Кдисс =[ Ind+][ OH- ]/ [ IndOH- ]
V T
0
5
9
9,9
9,99
10
10,01
10,1
11
15
. Тотығу-тотықсыздану реакциясын пайдаланып титрлеу әдісі
1. Редоксиметрияда тотығу-тотықсыздану реакциясы қолданылады, яғни жүйеде тотықтырғыш және тотықсыздандырғыш болады. Мысалы,
Fe3+ + e → Fe2+,
2CI- - 2e → CI2, сондықтан тотықтырғыш-тотықсыздандырғыш жұбы
( Ox/Red) болады, яғни Fe3+/Fe2+ , CI2/2CI- т.б.
Тотығу-тотықсыздану реакциясының бағытын анықтау үшін редоксиметрияда сандық сипаттама ретінде тотығу-тотықсыздану потенциалы ( Е Ox/Red) алынады.
Егер металл пластинкасын ( табақшасын) оның катионы бар
ерітіндіге батырса, металдың кристалдық торынан катиондар ерітіндінің жақын тұрған қабатына көшеді (тотығу процесі) не, керісінше, ерітіндіден катиондардың біраз бөлігі металл пластинкасы бетіне бөлініп, зарядсызданады ( тотықсыздану процесі). Осы 2 процестің қайсысы басымырақ болса, металл пластинкасында оң не теріс зарядтардың артық мөлшері пайда болады, ал металл бетіне жақын жердегі ерітінді қарама-қарсы зарядталады. Сондықтан металл-ерітінді шекарасында потенциалдар айырымы пайда болады, бірақ оның мәнін тікелей өлшеуге болмайды. Ол үшін гальваникалық элемент құру керек. Гальваникалық элемент (тотықтырғыш-тотықсыздандырғыш жұбынан тұратын) 2 жартылай элементтен құрылады. Тотықтырғыш-тотықсыздандырғыш жұбы потенциалының мәні тотықтырғыш пен тотықсыздандырғыш күшіне ғана байланысты емес, сонымен бірге олардың концентрациясына да байланысты. Егер концентрациялары бірдей және 1 моль/л болса, t = 25 С, р = 1атм болса, Е Ox/Red деп белгілейді.

Реакциядан кейін қалған қышқылдын қисық титрлеудің құрылымы
V T = 5 мл , pH = 1,48
V T = 9 мл , pH = 2,28
V T = 9,9 мл , pH = 3,30
V T = 9,99 мл , pH = 4,30
2.Эквивалентті нуктеде ерітіндіде NaCl кездеседі . Күшті негіз бен күшті қышқылдан тұз түзіледі , ол гидролизге ұшырамайды және рН мәні 7.

Қисық титрлеудің құрылуы
3. Эквивалентті Нүктеден кейін ерітіндіде партық NaOH мөлшері пайда болады және рН мәні реакцияны бейтараптандырудан кейін қалған сілтімен анықталады
рН = 14 – рОН
V T = 10,01 мл
Химиялық санын табамыз HCl и NaOH :
n(HCl) = C 0 · V 0 = 0,1 · 0,01 = 0,001 моль;
n(NaOH) = C T · V T = 0,1 · 0,0 101 = 0,0 0101 моль;
V = V 0 + V T = 0,01 + 0,0 101 = 0,0 201 л
Реакциядан кейін қалған сілтінің Концентрациясы :

Қисық титрлеу
рН = 9,69
V T = 10,1 мл , pH = 10,69
V T = 11 мл , pH = 11 , 68
V T = 15 мл , pH = 12,30
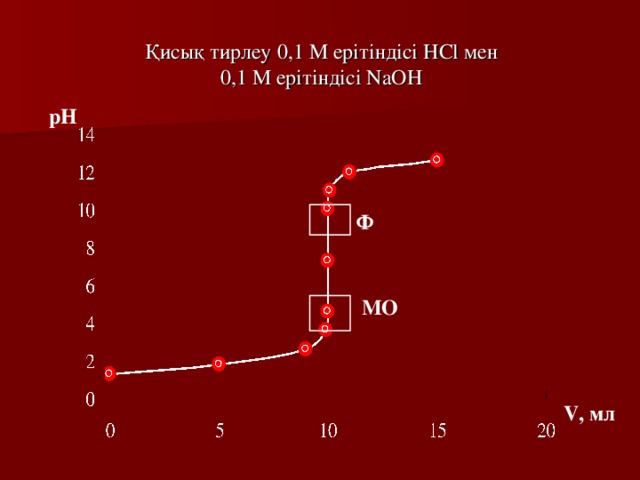
Қисық тирлеу 0,1 М ерітіндісі HCl мен 0,1 М ерітіндісі NaOH
pH
Ф
МО
V, мл

Электролит және концентрацияның әсері. Орташа концентрацияда концентрация кеміген сайын λ артады. Өте сұйытылған концентрация үшін ≤ 0,001 М λ = λ∞ - а√ с ; а – электролит табиғатына байланысты шама.
- λ= χ 1000/ C н
- Ерітіндіні сұйылту кезінде λ артады. Шексіз сұйылту кезінде максимальды шамасына жетеді λ∞. Кольрауш заңы немесе аддитивтілік заңы: Электролиттің шекті сұйылту кезіндегі эквиваленттік электрµткізгіштігі катион мен анионның қозғалғыштықтарының қосындысына тең болады.
- λ∞=λ к + λ а
- λ к cl = λ k ً + λ clˉ

Қорытынды
- Кгидр.= Снег. С қышқ. /Стұз . Осы 2 формуланы пайдаланып,
- рН = 7 + 1/2 pK қышқ.- 1/2 рКнег.. Егер титрлеу қисығын сызса, рН секіріс мәні жоқ деуге болады, яғни индикатор таңдау өте қиын, сондықтан қышқыл-негіз титрлеу әдісінде ең болмаса бір электролит күшті болуы керек.
- Титрлеу әдісінде ерітінділердің нормальды концентрациясы қолданылады.
- Сонымен, титрлеу қисығына қарап мынандай қорытындылар жасауға болады:
- 1. Түсін тек рН=7 де өзгертетін индикаторды ғана таңдамауға болады. ( HCl+NaOH – үшін э.н. рН=7 де болады).
- 2. Тым концентрациясы жоғары, не тым концентрациясы төмен ерітінділерді титрант ретінде алуға болмайды. Концентрациясы көп болса, титрлеу әдісінің қатесі көбейеді, концентрациясы аз болса, титрлеудің секірісі аз болады, сондықтан ерітінді концентрациясы 0,1н оптимальды деп есептеледі.














![Иодометрияда:Кристаллдық йод суда аз ериді. Сондықтан да стандарт ретінде ылғи да КІ ерітіндісін қолданады. І 2 -ні еріткен кезде КІ-тан [І 3 ] - иондары түзіледі:](https://fsd.multiurok.ru/html/2017/02/10/s_589dd94926b7d/img7.jpg)







































 7(неге?), әлсіз негізді күшті қышқылмен титрлегенде э.н. рНCH3COOH+NaOH CH3COONa +H2O әлсіз қышқыл CH3COO- + H2O↔ CH3COOH+ ОН- рН7 NH4OH + HCl NH4Cl + H2O әлсіз негіз NH4+ + H2O↔NH4OH + H+ рНHCl+NaOHNaCl + H2O рН7 . " width="640"
7(неге?), әлсіз негізді күшті қышқылмен титрлегенде э.н. рНCH3COOH+NaOH CH3COONa +H2O әлсіз қышқыл CH3COO- + H2O↔ CH3COOH+ ОН- рН7 NH4OH + HCl NH4Cl + H2O әлсіз негіз NH4+ + H2O↔NH4OH + H+ рНHCl+NaOHNaCl + H2O рН7 . " width="640"
![Қышқыл-негіздік индикаторлар Қышқыл-негіздік индикаторлар- әлсіз органикалық қышқылдар не негіздер. Олардың иондары мен молекулалары әр түрлі түсті болады(боялады). Егер қышқыл индикаторды HInd деп, негіз индикаторды IndOH деп белгілесек: HInd↔ H+ + Ind- - лакмус NaOH қосса → қызыл түс көкке; HCl қосса,көк түс қызылға ауысады, сондықтан лакмустің судағы ерітіндісі күлгін түсті (қызыл+көк). Егер индикатордың ионы да, молекуласы да боялатын болса, ондай индикаторларды екі түсті деп атайды, егер не молекуласы, не ионы ғана боялатын болса, ондай индикаторлар бір түсті деп аталады. Сонымен, индикаторлардың молекуласы мен иондарының әр түсті болғандығы, олардың түсінің ерітіндінің рН-на байланысты өзгеретіндігін түсіндіреді Сонымен, қышқылдық индикатор үшін HInd↔ H+ + Ind- , негіздік индикатор үшін IndOH Ind+ + OH- тепе-тендіктерін жазуға болады. Бұл тепе-теңдіктер үшін әрекеттесуші массалар заңын қолданса, Кдисс =[ H+][ Ind-]/[ HInd], Кдисс =[ Ind+][ OH- ]/ [ IndOH- ] V T 0 5 9 9,9 9,99 10 10,01 10,1 11 15](https://fsd.multiurok.ru/html/2017/02/10/s_589dd94926b7d/img50.jpg)























