Кислоты
1. Состав и классификация кислот
Кислоты – это электролиты, при диссоциации которых из положительных ионов образуются только катионы водорода:
HClO4 H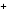 + ClO4
+ ClO4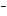 .
.
Состав кислот может быть выражен общей формулой Н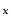 А, где А – кислотный остаток (анион), заряд которого определяется по числу замещенных атомов водорода и имеет отрицательное значение.
А, где А – кислотный остаток (анион), заряд которого определяется по числу замещенных атомов водорода и имеет отрицательное значение.
Кислоты могут находиться в различных агрегатных состояниях. При обычных условиях твердыми являются кислоты – H3BO3, HPO3, H3PO4, H4P2O7, жидкими – H2SO4, HNO3. Некоторые кислоты представляют собой раствор газообразного вещества в воде – любая галогеноводородная кислота (HCl, HBr), угольная (H2CO3), сернистая кислоты (H2SO3) и др.
По растворимости кислоты подразделяют на растворимые, малорастворимые и нерастворимые в воде. Хорошо растворимыми в воде являются кислоты H2SO4, HNO3, HPO3, H3PO4, мало растворима – кислота H3BO3, практически нерастворимой является H2SiO3. Следует также отметить, что многие кислоты не могут быть выделены в свободном виде, т.к. они существуют только в водном растворе: HNO2, H2CO3, H2SO3, HMnO4, H2CrO4.
Число атомов водорода в молекуле кислоты определяет основность кислоты и валентность кислотного остатка. По основности кислоты различают одноосновные: HCl (хлороводородная), HClO (хлорноватистая), HMnO4 (марганцевая) и др.; двухосновные: H2S (сероводородная), H2CO3 (угольная), H2SiO3 (метакремниевая), H2MnO4 (марганцовистая) и др.; трехосновные: H3BO3 (ортоборная), H3PO4 (ортофосфорная), H3AsO4 (ортомышьяковая) и др.
Существуют кислоты и с более высокой основностью: четырехосновные – H4P2O7 (пирофосфорная), H4SiO4 (ортокремниевая); пятиосновные – H5IO6 (иодная); шестиосновные – Н6ТеО6 (ортотеллуровая).
Многоосновные кислоты диссоциируют ступенчато:
H2SO4 H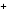 + HSO4
+ HSO4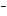 ; (I)
; (I)
HSO4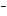 H
H + SO4
+ SO4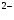 . (II)
. (II)
Суммарное уравнение диссоциации имеет вид:
H2SO4 2H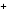 + SO4
+ SO4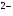 .
.
Причем степень диссоциации (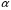 ) по первой ступени больше, чем по другим ступеням. В зависимости от степени диссоциации, кислоты, как и основания, делятся на сильные, средней силы и слабые.
) по первой ступени больше, чем по другим ступеням. В зависимости от степени диссоциации, кислоты, как и основания, делятся на сильные, средней силы и слабые.
В зависимости от состава кислотного остатка, кислоты подразделяют на бескислородные (HCl, HCN, H2S) и кислородосодержащие (H2CrO4, H2S2O3, HMnO4, H2C2O4, …).
Бескислородные кислоты не относятся к гидроксидам, но поскольку при диссоциации они образуют ионы водорода, то это позволяет объединить их в один класс.
2. Номенклатура кислот
Название бескислородных кислот образуется из корня русского названия неметалла с добавлением соединительной -о и слова «водородная». Например: HF – фтороводородная, H2S – сероводородная.
Название кислородосодержащих кислот происходит от названия кислотообразующего элемента. Если кислотообразующий элемент проявляет высшую степень окисления, соответствующую номеру группы Периодической таблицы Д.И. Менделеева, то к корню русского названия элемента добавляют суффиксы -н, -ев или -ов и окончание -ая. Например:
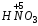 – азотная;
– азотная; 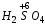 – серная;
– серная; 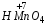 – марганцевая;
– марганцевая;
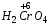 – хромовая.
– хромовая.
Если атом неметалла (или металла) находится не в высшей, но в единственно возможной, кроме высшей положительной степени окисления, то в названии кислоты используется суффикс -ист.
Например: 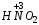 – азотистая;
– азотистая; 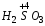 – сернистая.
– сернистая.
Если элемент образует ряд кислот, у которого степени окисления различны, то по мере убывания степени окисления элемента в названиях используют следующие суффиксы: -н, -оват, -ист, -оватист.
Например:
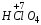 – хлорная;
– хлорная; 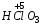 – хлорноватая;
– хлорноватая; 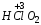 – хлористая;
– хлористая;
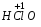 – хлорноватистая.
– хлорноватистая.
Состав любой кислородосодержащей кислоты может быть выражен общей формулой m Э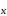 О
О · n H2O. При различных соотношениях m и n образуются разные кислоты, соответствующие одному и тому же кислотному оксиду. В этом случае суффиксы в названиях всех кислот остаются одинаковыми, меняются лишь приставки. При m = 1, n
· n H2O. При различных соотношениях m и n образуются разные кислоты, соответствующие одному и тому же кислотному оксиду. В этом случае суффиксы в названиях всех кислот остаются одинаковыми, меняются лишь приставки. При m = 1, n 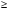 1, наименее гидратированная форма, обозначается приставкой мета-, наиболее гидратированная – орто-, а с промежуточным содержанием воды – приставкой пиро-.
1, наименее гидратированная форма, обозначается приставкой мета-, наиболее гидратированная – орто-, а с промежуточным содержанием воды – приставкой пиро-.
Например:
Р2О5 · Н2О → 2НРО3 – метафосфорная кислота;
Р2О5 · 3Н2О → 2Н3РО4 – ортофосфорная кислота;
Р2О5 · 2Н2О → Н4Р2О7 – пирофосфорная кислота.
Если в формуле m Э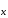 О
О · n H2O m n, то такие соединения называют поликислотами. В их названиях используют приставки ди-, три- и другие, указывающие число молекул кислотного оксида, приходящегося на одну молекулу воды.
· n H2O m n, то такие соединения называют поликислотами. В их названиях используют приставки ди-, три- и другие, указывающие число молекул кислотного оксида, приходящегося на одну молекулу воды.
Например:
 – трихромовая кислота;
– трихромовая кислота;
 – дисерная кислота.
– дисерная кислота.
В поликислотах атомы неметалла (или металла) соединены между собой через кислород следующим образом: – Э – О – Э –.
3. Химические свойства кислот
1) Кислоты взаимодействуют с малорастворимыми основаниями, щелочами и амфотерными гидроксидами:
H2SO4 + Сu(OH)2↓ → CuSO4 + 2H2O;
HCl + NaOH → NaCl + H2O;
2HNO3 + Zn(OH)2↓ → Zn(NO3)2 + 2H2O.
Следует иметь в виду, что практически нерастворимые в воде кислоты (H2SiO3, H3BO3) могут реагировать только с растворами щелочей, а с нерастворимыми основаниями и амфотерными гидроксидами они не взаимодействуют:
H2SiO3↓ + 2NaOH → Na2SiO3 + 2H2O.
2) Кислоты взаимодействуют с основными и амфотерными оксидами:
2HNO3 + CaO → Ca(NO3)2 + H2O;
6HCl + Al2O3 → 2AlCl3 + 3H2O.
3) Некоторые сильные концентрированные кислоты взаимодействуют с неметаллами:
2H2SO4 (конц.) + C → СO2↑+ 2SO2↑ + 2H2O;
5H2SO4 (конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O.
4) Кислоты взаимодействуют с металлами. Характер продуктов этих реакций зависит от активности металла, природы и концентрации кислот.
Активность металла определяется его положением в электрохимическом ряду напряжений. Все металлы, стоящие в ряду напряжения левее водорода, вытесняют (восстанавливают) водород из хлороводородной и других галогеноводородных кислот, а также из разбавленных растворов кислот (H2SO4, H3PO4). Продуктами таких реакций являются соль и газообразный водород:
Zn + 2HCl → ZnCl2 + H2↑;
2Na + H2SO4 (разб.) → Na2SO4 + H2↑.
При взаимодействии металлов с азотной HNO3 (разб., конц.) и серной H2SO4 (конц.) кислотами водород не выделяется. Поэтому в результате реакции образуются продукты восстановления аниона кислоты, соль и вода. Состав продуктов восстановления зависит от положения металла в электрохимическом ряду напряжений, концентрации кислоты и температуры.
3Ag + 4HNO3 (разб.) → 3AgNO3 + NO↑ + 2H2O;
Ag + 2HNO3 (конц.) → AgNO3 + NO2↑ + H2O;
4Zn + 10HNO3 (разб.) → 4Zn(NO3)2 + N2O↑ + 5H2O;
Cu + 2H2SO4 (конц.) → CuSO4 + SO2↑ + 2H2O;
3Zn + 4H2SO4 (конц.) → 3ZnSO4 + S↓ +4H2O.
5) Кислоты взаимодействуют с солями, с образованием новой соли и новой кислоты. Реакция протекает необратимо, т.е. «идет до конца», если одним из ее продуктов является нерастворимое или летучее вещество.
Например:
 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
H2CO3
2H+ + CO → H2O + CO2↑;
→ H2O + CO2↑;
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
SO + Ba
+ Ba → BaSO4↓;
→ BaSO4↓;
2HCl + Na2SiO3 → 2NaCl + H2SiO3↓
2H+ + SiO → H2SiO3↓.
→ H2SiO3↓.
6) Разложение кислот.
Некоторые слабые кислоты разлагаются при обычных условиях:
H2CO3 → H2O + CO2↑;
H2SO3 → H2O + SO2↑;
2H3BO3 3H2O + B2O3;
3HNO2 → H2O + 2NO↑ + HNO3.
Сильные кислоты являются более прочными в термическом отношении. Однако при нагревании некоторые из них могут разлагаться:
4HNO3  2H2O + 4NO2↑ + O2↑;
2H2O + 4NO2↑ + O2↑;
2HClO4  Cl2O7 + H2O;
Cl2O7 + H2O;
2H3PO4  H4P2O7 + H2O.
H4P2O7 + H2O.
4. Способы получения кислот
1) Большинство кислородосодержащих кислот может быть получено соединением кислотного оксида с водой:
SO2 +
H2O →
H2SO3;
N2O5 + H2O → 2HNO3.
Этим способом нельзя получить практически нерастворимые кислоты (H2SiO3, H3BO3). Данные кислоты могут быть получены косвенным путем:
Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓.
Бескислородные кислоты получают при непосредственном соединении неметаллов:
H2 + Cl2 → 2HCl;
H2 + S → H2S.
2) Кислоты можно получить реакцией обмена между солью и менее летучей кислотой, например, серной:
NaCl + H2SO4 = HCl↑ + NaHSO4;
NaNO3 + H2SO4 = HNO3↑ + NaHSO4.
5. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
Из приведенных ниже соединений выпишите формулы кислот: HNO2, H2MnO4, Mn(OH)2, H2Te, MnO, H2CrO4.
Приведите примеры одно-, двух-, трех-, четырех-, пяти- и шестиосновных кислот.
Выпишите отдельно формулы бескислородных и кислородосодержащих кислот: HCN, H2CO3, HNO3, H2C2O4, H2Se, H2S.
Составьте графические формулы хлороводородной, хлорноватистой, хлористой, хлорноватой и хлорной кислот.
Составьте формулы оксидов, соответствующих следующим кислотам: H3BO3, H2CrO4, H2SO3, HReO4, HIO4, H3PO4.
Назовите следующие кислоты: HNO3, HNO2, H2SeO4, H2SeO3, H2Se, HMnO4, H2MnO4.
Какие кислоты являются водными растворами газообразных веществ? Приведите примеры.
Составьте схему ступенчатой диссоциации ортофосфорной кислоты.
С какими из приведенных ниже веществ реагирует разбавленная серная кислота: Fe2O3, Mg, Ca(OH)2, Zn(OH)2, Cu, P2O5, Hg?
Как получить следующие кислоты: H2S, H3PO4, H2SiO3? Напишите уравнения соответствующих реакций.
Осуществите цепь превращений:
S → SO2 → SO3 → H2SO4 → Al2(SO4)3 → Al(OH)3 →Al2O3 →
→ KAlO2.
Приведите уравнения соответствующих реакций в молекулярной и ионной формах.
Составьте уравнения соответствующих реакций:
SO2 + H2O →;
Na2SiO3 + HCl →;
SiO2 + H2O →;
H2 + Br2 →;
K2S + HCl →;
Cu + H2SO4 →.







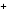 + ClO4
+ ClO4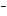 .
.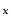 А, где А – кислотный остаток (анион), заряд которого определяется по числу замещенных атомов водорода и имеет отрицательное значение.
А, где А – кислотный остаток (анион), заряд которого определяется по числу замещенных атомов водорода и имеет отрицательное значение. + SO4
+ SO4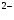 . (II)
. (II)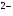 .
.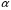 ) по первой ступени больше, чем по другим ступеням. В зависимости от степени диссоциации, кислоты, как и основания, делятся на сильные, средней силы и слабые.
) по первой ступени больше, чем по другим ступеням. В зависимости от степени диссоциации, кислоты, как и основания, делятся на сильные, средней силы и слабые.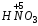 – азотная;
– азотная; 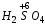 – серная;
– серная; 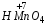 – марганцевая;
– марганцевая; 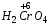 – хромовая.
– хромовая.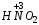 – азотистая;
– азотистая; 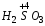 – сернистая.
– сернистая.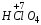 – хлорная;
– хлорная; 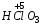 – хлорноватая;
– хлорноватая; 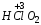 – хлористая;
– хлористая; 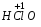 – хлорноватистая.
– хлорноватистая.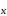 О
О · n H2O. При различных соотношениях m и n образуются разные кислоты, соответствующие одному и тому же кислотному оксиду. В этом случае суффиксы в названиях всех кислот остаются одинаковыми, меняются лишь приставки. При m = 1, n
· n H2O. При различных соотношениях m и n образуются разные кислоты, соответствующие одному и тому же кислотному оксиду. В этом случае суффиксы в названиях всех кислот остаются одинаковыми, меняются лишь приставки. При m = 1, n 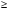 1, наименее гидратированная форма, обозначается приставкой мета-, наиболее гидратированная – орто-, а с промежуточным содержанием воды – приставкой пиро-.
1, наименее гидратированная форма, обозначается приставкой мета-, наиболее гидратированная – орто-, а с промежуточным содержанием воды – приставкой пиро-. 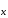 О
О


















