Амфотерные гидроксиды
Амфотерные гидроксиды – продукты косвенного соединения воды и амфотерного оксида, которые проявляют двойственные (кислотно-основные) свойства.
К амфотерным гидроксидам относят гидроксиды, образованные металлами в степени окисления +3, +4, кроме некоторых исключений: Zn(OH)2, Be(OH)2, Ge(OH)2, Pb(OH)2, Sn(OH)2. Все амфотерные гидроксиды плохо растворимы в воде и являются слабыми электролитами.
Как правило, амфотерные гидроксиды диссоциируют ступенчато:
Fe(OH)3 (Fe(OH)2)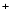 + ОН
+ ОН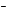 ; (I)
; (I)
(Fe(OH)2)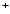 (FeOH)
(FeOH)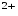 + ОН
+ ОН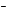 ; (II)
; (II)
(FeOH)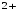 Fe
Fe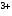 + ОН
+ ОН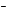 . (III)
. (III)
Причем степень диссоциации (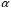 ) по первой ступени больше, чем по второй и тем более по третьей.
) по первой ступени больше, чем по второй и тем более по третьей.
Суммарное уравнение диссоциации основания имеет вид:
Fe(OH)3 Fe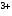 + 3 ОН
+ 3 ОН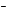 .
.
1. Номенклатура амфотерных гидроксидов
Называют амфотерные гидроксиды следующим образом: сначала называют слово «гидроксид», затем русское название металла в родительном падеже, а в скобках римскими цифрами указывают степень окисления (валентность) металла, если она переменная. Например, Cr(OH)3 – гидроксид хрома (III), Al(OH)3 – гидроксид алюминия.
2. Химические свойства амфотерных гидроксидов
1) Особое отличие амфотерных гидроксидов состоит в их способности проявлять как кислотные, так и основные свойства:
А) Взаимодействие амфотерных гидроксидов с кислотами:
Al(OH)3 + 3HCl → AlCl3 + 3H2O.
В таких реакциях амфотерный гидроксид проявляет основные свойства.
Б) Взаимодействие амфотерных гидроксидов со щелочами.
Амфотерные гидроксиды образуют при сплавлении со щелочами средние соли типа NaAlO2, Na2ZnO2:
Zn(OH)2 + 2NaOH → Na2ZnO2 + 2H2O.
В растворах реакции взаимодействия идут с образованием комплексных соединений. Для Cr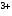 координационное число равно 6, для Zn
координационное число равно 6, для Zn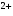 – 4. Лигандами служат ионы ОН
– 4. Лигандами служат ионы ОН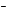 :
:
Zn(OH)2 + 2NaOH → Na2[Zn(OH)4];
Cr(OH)3 + 3NaOH → Na3[Cr(OH)6]
Al(OH)3 + NaOH → Na[Al(OH)4].
В этом случае Zn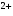 , Cr
, Cr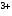 , Al
, Al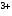 проявляют кислотные свойства и входят в состав аниона комплексной соли.
проявляют кислотные свойства и входят в состав аниона комплексной соли.
2) Все амфотерные гидроксиды термически неустойчивы и разлагаются на соответствующий гидроксид и воду уже при незначительном нагревании:
Be(OH)2 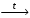 BeO + H2O;
BeO + H2O;
2Cr(OH)3 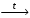 Cr2O3 + 3H2O.
Cr2O3 + 3H2O.
2. Получение амфотерных гидроксидов
Получают амфотерные гидроксиды косвенным путем: действием щелочей на водные растворы соответствующих солей:
ZnCl2 + 2KOH → Zn(OH)2↓ + 2KCl.
3. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
Какие из предложенных соединений относятся к амфотерным гидроксидам: HNO3, HCl, CsOH, Cr(OH)3, SiO2, ZnSO4, HClO, K2O, Zn(OH)2? Дайте названия веществам.
Составьте химические формулы соответствующих оснований: гидроксида бериллия, гидроксида железа (II), гидроксида хрома (III), гидроксида цинка. Приведите их графические формулы.
Из перечисленных ниже веществ выберите амфотерные гидроксиды: Ba(OH)2, Cu(OH)2, Bi(OH)3, Zn(OH)2, Cr(OH)2, KOH.
Приведите уравнения ступенчатой диссоциации оснований, формулы которых приведены ниже: Zn(OH)2, Al(OH)3.
Какими свойствами обладает гидроксид хрома (III)? Приведите уравнения соответствующих реакций.
С какими из перечисленных веществ взаимодействует гидроксид
бериллия: HNO3, KOH, CuSO4, FeO, H2O? Составьте уравнения соответствующих реакций.
Допишите уравнения возможных реакций. Составьте ионные уравнения реакций:
Al(OH)3 + CO2 →;
Al(OH)3 + HCl →;
Al(OH)3 + ZnSO4 →;
Al(OH)3 + NaOH →.
Приведите возможные уравнения реакций получения веществ:
Fe(OH)3, Be(OH)2.
Приведите уравнения реакций (в молекулярной и ионной формах), при помощи которых можно доказать амфотерный характер гидроксида олова (II).
С какими из веществ, формулы которых приведены ниже, взаимодействует гидроксид цинка: HCl, Cu(OH)2, H2O, CO2, KNO3, KOH? Составьте уравнения соответствующих реакций в молекулярном и ионном виде.
Осуществите цепь последовательных превращений:
Fe(OH)3 → Fe2O3 → Fe(NO3)3 → Fe → FeO → FeSO4 → Fe(OH)2.
Приведите молекулярные и ионные уравнения реакций.







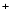 + ОН
+ ОН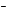 ; (I)
; (I)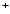 (FeOH)
(FeOH)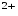 + ОН
+ ОН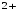 Fe
Fe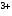 + ОН
+ ОН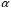 ) по первой ступени больше, чем по второй и тем более по третьей.
) по первой ступени больше, чем по второй и тем более по третьей. 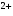 – 4. Лигандами служат ионы ОН
– 4. Лигандами служат ионы ОН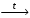 BeO + H2O;
BeO + H2O;

















