Химия, 8 класс
УМК: Кузнецова Н.Е., Титова И.М., Жегин И.М.
(учебник: Н.Е.Кузнецова, И.М.Титова, Н.Н.Гара Химия 8 класс, Москва, Издательский центр «Вентана-Граф», 2012)
Учитель Салыкина Г.Ю.
Тема. Валентность химических элементов. Определение валентности в бинарных соединениях.
Тип урока: ОНЗ
Основные цели:
сформировать понятие валентности
сформировать умение строить алгоритм способов действий на определение валентности в бинарных соединениях
Мыслительные операции, необходимые на этапе проектирования: анализ, сравнение, обобщение, аналогия.
Демонстрационный и раздаточный материал:
Эталон для повторения: «Химическая формула»
ЭТАЛОН «Химическая формула»
Химическая формула – это условная запись, выражающая качественный и количественный состав вещества с помощью химических знаков.
Эталон для повторения: «Бинарные соединения»
ЭТАЛОН «Бинарные соединения»
Бинарные (двухэлементные) соединения – вещества, состоящие из атомов двух химических элементов.
Эталон для повторения:
«Простые и сложные вещества»
ЭТАЛОН «Простые и сложные вещества»
ВЕЩЕСТВА
Простые Сложные
Один химический элемент Разные химические элементы
Эталон №1 «Валентность»
ЭТАЛОН №1 «Валентность»
1.Валентность – свойство атомов присоединять определенное число других атомов
2.Валентность – это количество химических связей, которые образует атом с другими атомами.
Эталон №2 «Алгоритм определения валентности элемента по формуле его соединения»
Учебник стр. 59
ЭТАЛОН №2 «Алгоритм определения валентности элемента по формуле его соединения»
1.Записать химические формулы веществ, указав известные значения валентности
2. Найти общее число валентностей известного элемента (для этого надо перемножить значение валентности на индекс элемента)
3. Общее число валентностей известного элемента разделить на индекс второго элемента, полученное число и есть значение валентности последнего. связей, которые образует атом с другими атомами.
Эталон №3
«Способы определения валентности атомов в молекулах»
ЭТАЛОН №3 «Способы определения валентности атомов в молекулах
Для определения валентности элемента по химической формуле используется алгоритм.
Чтобы правильно выполнить шаги алгоритма, нужно знать правила определения постоянной и переменной валентностей.
Чтобы правильно выполнить шаги алгоритма, нужно знать положение элемента в периодической системе.
Инструкция «Правила определения валентности»

карточки-задания для пробного действия
| Распределите по группам формулы представленных веществ |
| Н2О, Н2SО4, О2, Na2SО4, Н2, СО2, КОН |
| Простые вещества | Бинарные соединения |
|
|
|
эталон для самопроверки
| Подробный образец | Эталон |
| II II HgO | эталон №2 1.Записать химические формулы веществ, указав известные значения валентности 2. Найти общее число валентностей известного элемента (для этого надо перемножить значение валентности на индекс элемента) 3. Общее число валентностей известного элемента разделить на индекс второго элемента, полученное число и есть значение валентности последнего |
| I I HBr |
| II II ZnS |
| II I MgF2 |
| II II CuO |
| III I AlCl3 |
Оборудование: интерактивная доска, нетбуки (15 шт), проектор, коллекции шаростержневых моделей атомов и молекул
Средства ИКТ: электронное издание «Химия. 8-11 класс. Виртуальная лаборатория»,
Презентация «Валентность»
Ход урока
1. Мотивация к учебной деятельности.
− Добрый день, ребята! Вы уже несколько уроков изучаете язык химии (символы, знаки, формулы), который используется для обозначения окружающих нас веществ. Состав каждого вещества строго индивидуален, также как и индивидуальны объекты макромира. Сколько рук у человека? Сколько лап у собаки? Как выглядит дерево? Оказывается у молекул веществ тоже есть своя форма, а у атомов – свои «конечности», с помощью которых они взаимодействуют с другими атомами. В микромире тоже есть свои порядки. Сегодня вы продолжите учиться работать с формулами химических веществ, но это будет новая информация, с помощью которой вы узнаете, какие законы микромира влияют на внешний вид молекул.
− Как вы открываете новые знания? (Мы выясняем, какие знания у нас отсутствуют, и самостоятельно открываем эти знания.)
− С чего надо начать работу, чтобы успешно открыть новые знания? (Надо повторить то, что будет необходимо для открытия.)
2. Актуализация знаний и фиксирование индивидуального затруднения в пробном действии.
Какую информацию содержит формула химического соединения?
Как по формуле определить принадлежность вещества к бинарному соединению?
Что нужно знать, чтобы составить формулы веществ?
Распределите по группам формулы представленных веществ
| Н2О, Н2SО4, О2, Na2SО4, Н2, СО2, КОН |
| Простые вещества |
| Бинарные соединения |
|
|
|
|
Образец (в презентации)
| Н2О, Н2SО4, О2, Na2SО4, Н2, СО2, КОН |
| Простые вещества |
| Бинарные соединения |
| О2, Н2 |
| Н2О, СО2 |
Выполняем пробное задание (чтобы мы поняли, что мы не знаем и могли определить цель деятельности)
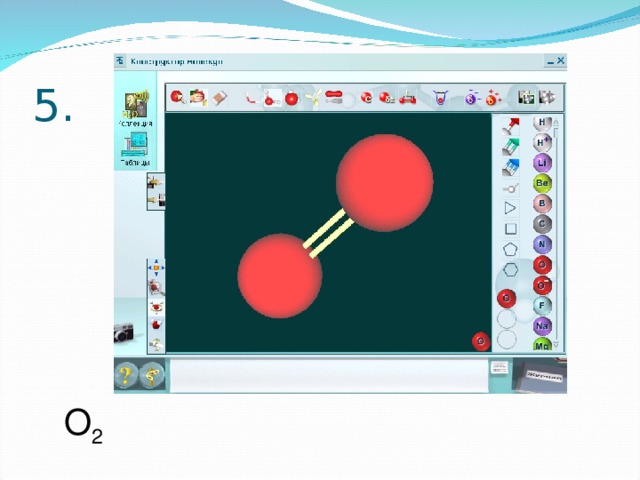
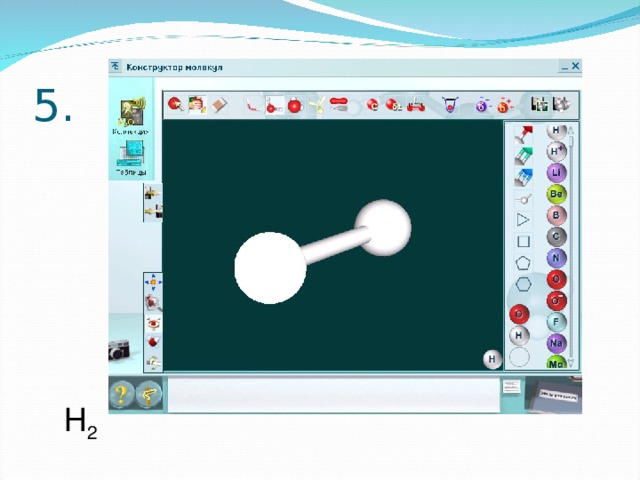
 В электронном издании «Виртуальная лаборатория» откройте раздел «Конструктор молекул». Используя в панели инструментов виды атомов и количество
В электронном издании «Виртуальная лаборатория» откройте раздел «Конструктор молекул». Используя в панели инструментов виды атомов и количество


связей , постройте шаростержневые модели молекул выбранных веществ из предыдущего задания.
Создайте новый документ Word. Копируйте изображение экрана с помощью клавиши «РrtSk» и переносите в документ. Сравните полученные модели. Какое у вас возникло затруднение?
-Я не могу определить точное количество связей между атомами в молекуле…
-Я не могу понять, почему атомы образуют разное количество связей с другими атомами…
3. Выявление места и причины затруднения.
- Где возникло затруднение?
- В определении количества связей между атомами
- В чем причина затруднения?
- Мы не знаем способа определения количества связей в молекуле
4. Построение проекта выхода из затруднения
- Сформулируйте цель вашей деятельности
- Узнать способы определения химических связей в молекулах
- Сформулируйте тему урока
- Химические связи в молекулах
Тема в презентации: «Валентность»
-Ребята, оказывается, ваша формулировка темы подвела нас к новому понятию, которое и является основой нашего урока.
Вывешивается эталон №1
- Как вы думаете, какие средства нам помогут открыть новое знание? (шаростержневые модели, учебник, учитель)
По какому плану вы будете действовать?
Работа в группах (предлагаются шаги, на основе которых учащиеся проектируют план своих действий)
Шаги плана в презентации
План открытия нового знания (в презентации):
Выписать символы химических элементов, используемых в пробном задании.
Над символами химических элементов выписать значения возможных валентностей согласно инструкции «Правила определения валентности»
Выписать формулы веществ, используемых в пробном задании.
Над символами химических элементов выписать значения валентностей, согласно эталону №2 «Алгоритм определения валентности элемента по формуле его соединения»
Собрать шаростержневые модели молекул.
Сравнить шаростержневые модели молекул с образцом
5. Реализация построенного проекта
Работа в парах (В соответствии с планом учащиеся реализуют построенный проект)
Обучающиеся фиксируют новые способы действия в речи
Образец ответов (в презентации):
О, Н, С;
II I II,IV
О, Н, С
О2, Н2, Н2О, СО2
II I I II IV II
О2, Н2, Н2О, СО2
| Простые вещества | Бинарные соединения |
| О2, 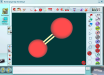 | Н2О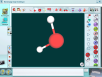 |
| Н2 | СО2 |
6. Первичное закрепление во внешней речи (парно и фронтально)
Образец речи:
валентность кислорода всегда постоянна – равна II;
валентность водорода всегда постоянна – равна I;
валентность углерода переменная – равна II и IV, элемент стоит в IVА группе, группа четная, выполняется правило четности-нечетности
Подведем итог. Сформулируем способы определения валентности атомов в молекулах (эталон №3)
Для определения валентности элемента по химической формуле используется алгоритм.
Чтобы правильно выполнить шаги алгоритма, нужно знать правила определения постоянной и переменной валентностей.
Чтобы правильно выполнить шаги алгоритма, нужно знать положение элемента в периодической системе.
способы определения валентности атомов в молекулах
7. Самостоятельная работа с самопроверкой по эталону
Учебник стр.60 №3
Определите валентность химических элементов в соединениях: HgO, HBr, ZnS, MgF2, CuO, AlCl3
Эталон для самопроверки
| Подробный образец | Эталон |
| II II HgO | эталон №2 1.Записать химические формулы веществ, указав известные значения валентности 2. Найти общее число валентностей известного элемента (для этого надо перемножить значение валентности на индекс элемента) 3. Общее число валентностей известного элемента разделить на индекс второго элемента, полученное число и есть значение валентности последнего |
| I I HBr |
| II II ZnS |
| II I MgF2 |
| II II CuO |
| III I AlCl3 |
Проговаривание во внешней речи
| II II HgO | Известная валентность у кислорода – II (постоянная). Валентность ртути рассчитываем: 2*1/1=2 |
| I I HBr | Известная валентность у водорода – I(постоянная). Валентность брома рассчитываем: 1*1/1=1 или выполняется правило: бром в соединении с водородом одновалентен. |
| II II ZnS | Известная валентность у цинка – II(постоянная). Валентность серы рассчитываем: 2*1/1=2 или выполняется правило: сера в соединении с металлами двухвалентна. |
| II I MgF2 | Известная валентность у магния – II (металл IIА группы) , у фтора - I(постоянная). |
| II II CuO | Известная валентность у кислорода – II(постоянная). Валентность меди рассчитываем: 2*1/1=2 |
| III I AlCl3 | Известная валентность у алюминия– III(металл IIIА группы). Валентность хлора рассчитываем: 1*3/1=3 или выполняется правило: хлор в соединении с металлами одновалентен. |
На этом этапе учащиеся должны понять, могут ли они применять алгоритм и правильно ли они это делают.
− Найдите место, где у вас возникло затруднение?
− Почему оно возникло?
− Кто выполнил задание правильно? Молодцы.
8. Включение в систему знаний и повторение.
Фронтальная беседа
Ребята, таким образом, определяя валентность, необходимо учитывать положение элементов в периодической системе.
Проанализируем таблицу «Определение валентности химических элементов по положению элементов в периодической системе» (учебник стр 58, табл.7,)
как вы думаете, почему элементы представлены в таблице разным цветом? (оранжевый – металлы главных подгрупп с постоянной валентностью, желтый – неметаллы – с постоянной и переменной валентностью, зеленый – металлы побочных подгрупп с постоянной и переменной валентностью)
В таблице представлены формулы высших оксидов в общем виде, где R – химический элемент. Проанализируйте эту графу. Как вы думаете, что общего между всеми представленными формулами ? (в формулах есть кислород)
Как вы думаете, почему оксиды называются высшими? (элемент проявляет высшую валентность)
Выпишите формулы оксидов и расставьте валентность над знаками химических элементов.
Учащиеся выходят по одному к доске и выполняют задание с проговариванием во внешней речи
Образец выполнения
| I II II II III II IV II V II VI II VII II VIII II R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4 |
9. Рефлексия учебной деятельности на уроке.
− Что нового вы узнали? (Познакомились с новым понятием «Валентность».)
− Какую цель вы ставили на уроке? (Узнать способы определения химических связей в молекулах).
− Достигли вы цели? Обоснуйте. (Да, потому что узнали правила определения валентности и алгоритм определения валентности по химической формуле.)
− Какие трудности еще остались? Над чем надо еще поработать? (…..)
− Проанализируйте свою работу. Подчеркните последнее задание цветным карандашом. При наличие разных ошибок – подчеркните несколько раз.
На уроке не было ошибок – красная черта
Были ошибки в определении валентности неметаллов – желтая черта
Были ошибки в определении валентности металлов главных подгрупп – оранжевая черта
Были ошибки в определении валентности металлов побочных подгрупп – зеленая черта
Были ошибки в выполнении алгоритма определения валентности – голубая черта
При выполнении домашнего задания обратите внимание на те сигналы, которые вы сейчас ввели.
Домашнее задание:
Учебник: §13 стр. 55 – 59, стр.60 №4,5
№4. Определите валентность химических элементов в соединениях: Cl2O, NO, NO2, N2O3, SO2, SO3, Cl2O5.
№5. Начертите графические формулы для молекул: аммиака NH3 , воды H2O, сернистого газа SO2.








 В электронном издании «Виртуальная лаборатория» откройте раздел «Конструктор молекул». Используя в панели инструментов виды атомов и количество
В электронном издании «Виртуальная лаборатория» откройте раздел «Конструктор молекул». Используя в панели инструментов виды атомов и количество