Теоретический материал
к алгоритму решения заданий ОГЭ по химии.
ЗАДАНИЕ №1. Cтроение атома и электронные оболочки
Все атомы состоят из ядра и электронной оболочки. Ядро поэтому так и называется, так как оно расположено в самом центре и очень-очень маленькое. Ядро заряжено положительно. Положительный заряд ядру придают протоны - положительно заряженные элементарные частицы. Один протон несет в себе заряд +1. Таким образом, сколько в ядре протонов, таков и заряд ядра. Заряд ядра, а следовательно и количество протонов показывает нам порядковый номер элемента в таблице Менделеева. Если порядковый номер 2, то заряд ядра равен двум - это ядро гелия - второго элемента в периодической таблице.
Порядковый номер элемента показывает также и количество электронов в электронной оболочке. Электронная оболочка окружает ядро и компенсирует положительный заряд ядра отрицательными зарядами электронов. Более того, электронная оболочка обуславливает протекания всех химических реакций - именно изменение состава электронной оболочки и её конфигураций объясняет природу химических реакций. Как и ядро, оболочка состоит из элементарных частиц - электронов. Электроны, в отличии от протонов, несут заряд -1 - электронная оболочка заряжена отрицательно. Но кроме этого, есть еще одно важное отличие электрона от протона - протон имеет вес 1, а электрон не имеет веса (на самом деле это не так, но для решения задач нам не понадобятся знания о массах элементарных частиц).
Кроме протонов, в ядре содержатся нейтроны - незаряженные элементарные частицы с массой 1. Они придают только вес атому и ядру, но не заряд. Количество нейтронов можно найти, зная массу элемента и его порядковый номер, так как порядковый номер показывает количество протонов и их суммарную массу, а молекулярная масса - общую массу. Таким образом, вычитая из общей массы массу протонов, мы получаем количество нейтронов.
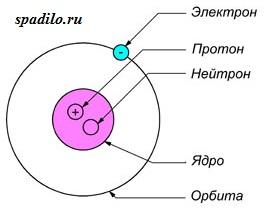
Суммарный заряд атома нейтрален, отсюда следует, что количество протонов равно количеству электронов.
Электроны в оболочке расположены упорядочено - слоями. Количество слое определяет номер периода в периодической таблице.
Число слоев определяется номер периода, в котором стоит элемент.
В первом периоде может быть максимально два электрона, во втором - восемь, в третьем - восемь. Заполнение электронных оболочек первых трех периодов идет постепенно - сначала полностью заполняется первый, потом полностью второй и третий.
Число свободных неспаренных электронов определяется по формуле 8-n, где n – номер группы, в которой стоит химический элемент.
ЗАДАНИЕ №2. Закономерности в таблице Д.И. Менделеева

Физический смысл порядкового номера:
Физический смысл номера периода:
Физический смысл номера группы:
В периоде слева направо ⇒
Увеличивается:
Заряд ядра атома
Электротрицательность
Неметаллические свойства
Число валентных электронов
Высшая степень окисления
Кислотные свойства гидроксидов, образованные элементами
Не меняется число электронных слоев
Уменьшается:
Основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, кислотные свойства (оксидов, кислородных кислот) увеличиваются.
В группе сверху вниз ⇓
Увеличивается:
Основные свойства соединений (оксидов, гидроксидов) увеличиваются, кислотные свойства соединений (оксидов, кислородных кислот) уменьшаются;
Кислотные свойства бескислородных кислот увеличиваются.
Уменьшается:
Не меняется число валентных электронов и степень окисления химических элементов в одной группе.
ЗАДАНИЕ №3. Химическая связь и строение молекул
Вспоминаем классификацию простых веществ. Вещества делятся на металлы и неметаллы. Если провести диагональную линию от бора до астата в таблице Менделеева, то слева остаются металлы, справа - неметаллы. Деление довольно условное, но в школьном курсе мы руководствуемся именно этим.
Металлы
Итак, металлы образуют между атомами металлическую связь и формируют металлическую кристаллическую решетку, в узлах которой лежат ионны металлов, между узлами - ионами металлов распределен электронный газ - электроны. В данной системе нельзя сказать, какому конкретно иону принадлежит электрон - они распределены равномерно между всеми ионами. Именно этим и объясняется электропроводность металлов - электроны подвижны и распределение и движение зарядов происходит легко.
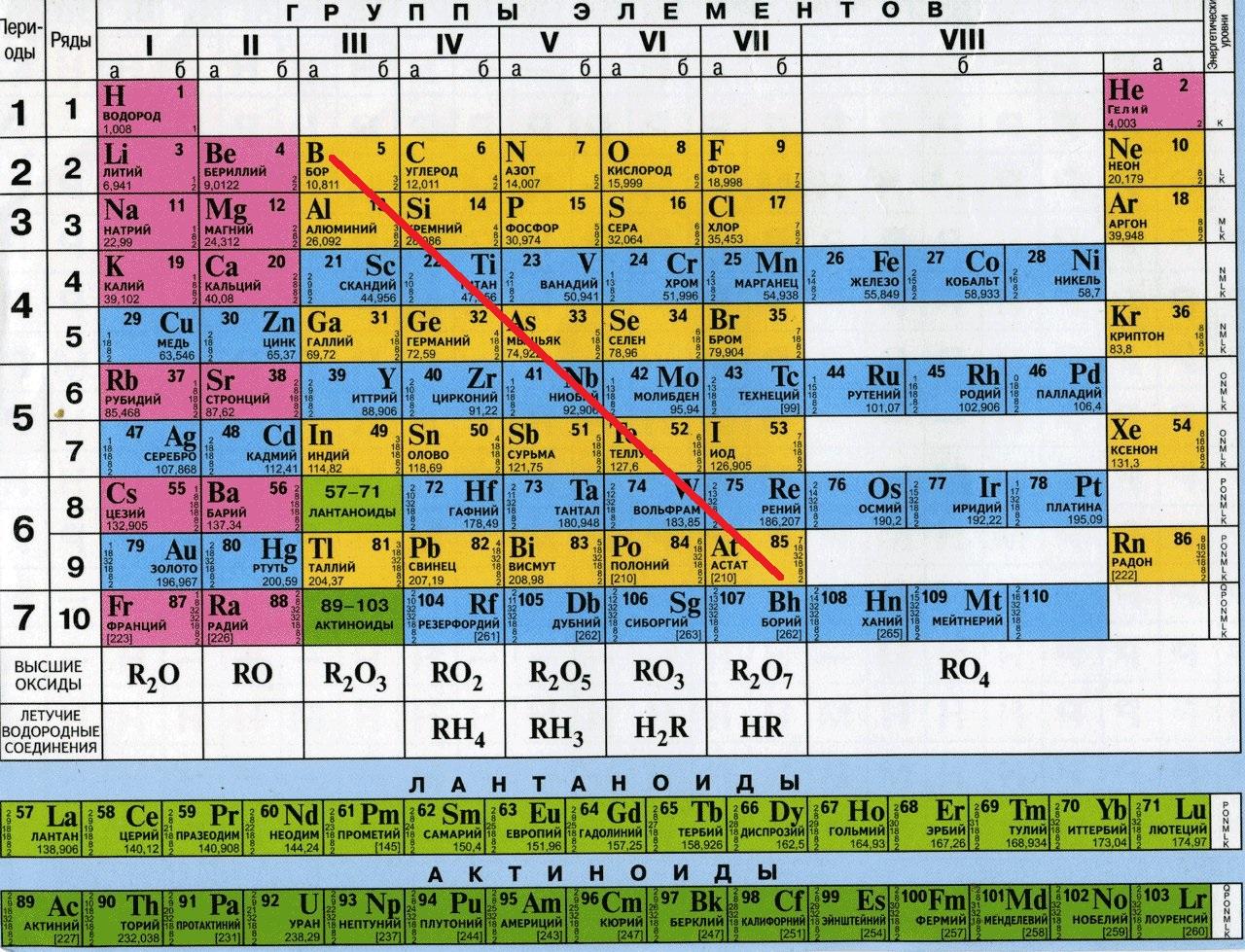
Неметаллы
Неметаллы располагаются справа от проведенной линии (кроме синих клеток на этой таблице - синие клетки это металлы). Неметаллы образуют друг с другом ковалентную связь. Если два атома неметалла представлены одним элементом, например атом хлора и еще один атом хлора образуют молекулу Cl2 - то это неполярная ковалентная связь. Если же атомы разные - то это ковалентная полярная связь - так как электронная плотность не может распределиться равномерным образом между двумя разными элементами (HCl, H2O, CO, P2O5, SO3). Молекулярная решетка в большинстве случаев молекулярная - H2, Cl2, O2, O3, S8, P4. В особых случаях - атомная - C, Si.
Аллотропия
Аллотропия - явление, образования одним элементом нескольких простых веществ:
углерод – алмаз, графит, карбин, фуллерен
кислород – кислород O2 и озон O3
фосфор- белый, красный, черный
олово – серое и белое
сера – пластическая и кристаллическая
То есть атомы одного элемента могут объединяться по-разному - из-за этого возникают новые или другие свойства.
ЗАДАНИЕ №4. Степень окисления и валентность Сравнение степени окисления валентности
| | Степень окисления | Валентность |
| Определение | Условный заряд атома в молекуле, вычисленный исходя из предположения, что все связи в молекуле – ионные. | Число химических связей, которые образует атом в химическом соединении. |
| Знак | Имеет знак – она может быть отрицательной, нулевой или положительной. | Валентность не имеет знака. |
| Обозначение | Арабские цифры со знаком | Римские цифры |
| Примеры | Cl (-1), Fe (+3) | N (V), C (IV) |
Правила подсчета степени окисления
Степень окисления элемента в составе простого вещества принимается равной нулю; если вещество в атомарном состоянии, то степень окисления его атомов также равна нулю.
Ряд элементов проявляют в соединениях постоянную степень (пример фтор (-1), щелочные металлы (+1), щелочноземельные металлы, бериллий, магний и цинк (+2), алюминий (+3)).
Кислород, как правило, проявляет степень окисления -2 (исключения: пероксид Н2О2(-1) и фторид кислорода OF2 (+2)).
Водород в соединениях с металлами (в гидридах) проявляет степень окисления -1, как правило, +1(кроме SiH4, B2H6).
Алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю, а в сложном ионе – заряду этого иона.
Высшая степень окисления равна номеру группы элемента в Периодической системе - пример: сера – элемент VI группы главной подгруппы высшая степень окисления +6.
Правило не распространяется на элементы I группы побочной подгруппы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы.
Не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор.
Правила подсчета валентности
Валентные возможности атома определяются числом:
Примеры: Н –водород IА группа, имеет 1 валентный электрон, образует 1 ковалентную связь с каким-либо другим атомом. Валентность I.
ЗАДАНИЕ №5. Классификация веществ
вещества бывают простые и сложные. Простые состоят из атомов одного элемента - сложные из атомов различных элементов. Простые вещества в свою очередь делятся на металлы и неметаллы. У сложных веществ больше классов - оксиды, кислоты, основания, щелочи.

Классификация оксидов
Рассмотрим классификацию оксидов. Оксиды - это соединения кислорода с другими элементами. В зависимости от того, с каким элементом кислород образует соединение, оксиды делятся на основные, кислотные и амфотерные.
Основные оксиды образуют металлы в степенях окисления +1 и +2 (K2O, MgO)
Кислотные оксиды образуют преимущественно неметаллы (SO3, N2O5)
Металлы Zn и Al образуют амфотерные оксиды (ZnO, Al2O3)
Из всех правил есть исключения, но о них в другой раз. К тому же в ОГЭ и ЕГЭ данные исключения не фигурируют.

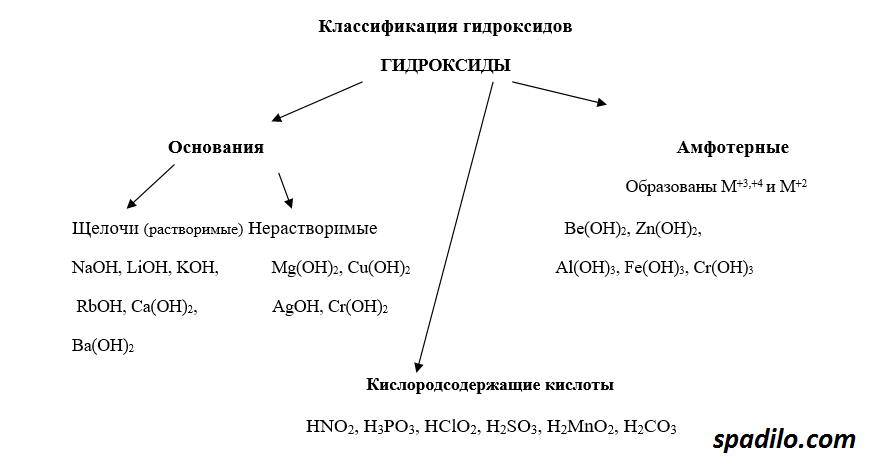
Классификация гидроксидов
Гидроксиды - продукты соединения оксидов с водой. В зависимости от того, какой был оксид, гидроксиды делятся на основания, кислоты и амфотерные основания. Основные оксиды образуют основания, кислотные, соответственно, кислоты, амфотерные оксиды образуют амфотерные основания - вещества, проявляющие свойства и кислот и оснований. В свою очередь основания делятся на растворимые - щелочи, и нерастворимые.
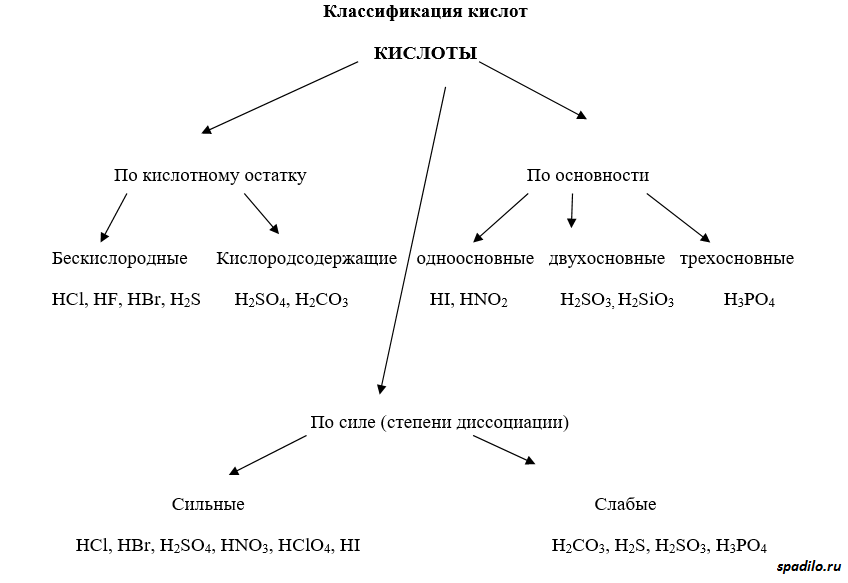
Классификация кислот
Кислоты имеют различные классификации. Существуют кислородсодержащие и бескислородные кислоты. Отличие первых от вторых состоит в том, что первые содержат в своей молекуле кислород, а вторые состоят только из элемента и водорода (HCl, например). Бескислородные кислоты образуются непосредственно при взаимодействии элемента (Cl2) и водорода (H2), в то время как кислородсодержащие кислоты образуются взаимодействием оксидов с водой.
Классификация по основности подразумевает количество протонов, отдаваемое молекулой кислоты при полной диссоциации. Одноосновные кислоты диссоциируют с образованием одного протона, двухосновные - двух, и так далее.
Классификация по степени диссоциации показывает, насколько легко проходит диссоциация (отрыв протона от молекулы кислоты). В зависимости от этого различают сильные и слабые кислоты.

Классификация солей
Соли делятся на средние, кислые и основные. В кислых солях присутствует протон, в основных - гидрокси-группа. Кислые соли представляют собой продукт взаимодействия избытка кислоты с основанием, основные соли - наоборот - продукт взаимодействия избытка основания с кислотой.

Подведем небольшой итог по пройденной теме.
Оксиды – сложные вещества, состоящие из двух химических элементов, один из которых - кислород.
Основания – это сложные вещества, состоящие из ионов металла и гидроксид-ионов.
Кислоты – это сложные вещества, состоящие из ионов водорода и кислотных остатков.
Соли – это сложные вещества, состоящие из ионов металла и кислотных остатков.
ЗАДАНИЕ №6 — классификация химических реакций Химическая реакция
Химическая реакция — превращение одного или нескольких исходных веществ в другие вещества, при которых ядра атомов не меняются и образуются новые химические вещества.
Практически любая химическая реакция выражается химическим уравнением - оно показывает сколько молекул исходных веществ необходимо затратить, чтобы получить продукт. Таким образом, химическое уравнение - это условная запись химической реакции с помощью химических формул и знаков.
Правила записи химических уравнений
Сформулируем основные правила записи химических уравнений:
Основные правила для записи уравнения:
химическое уравнение составляют на основании закона сохранения массы веществ, поэтому число атомов каждого элемента в левой и правой частях уравнения должно быть равно друг другу
составление схемы реакции - для этого необходимо правильно записать формулы всех исходных веществ и соединить их знаком плюс, правильно записать формулы продуктов реакции
вычислить число атомов одного из элементов в левой части уравнения и сравнить с числом атомов этого элемента в правой, если эти числа не равны, то изменить уравнивающие коэффициенты перед формулами веществ и повторить этот шаг для каждого элемента в уравнении реакции
обязательно выполнить проверку правильности уравнивания, повторно сравнив количество атомов элементов
Классификация химических реакций
Перейдем к рассмотрению классификации химических реакций.
Классификация по типу превращений
Реакция соединения - химическая реакция, в результате которой из двух или большего числа исходных веществ образуется только одно новое.
Пример - получение сульфида меди из серы и меди:
Cu+S = CuS
Реакция разложения - химическая реакция, в результате которой из одного вещества образуется несколько новых веществ. В реакции данного типа вступают только сложные соединения, а их продуктами могут быть как сложные, так и простые вещества.
Пример - разложение карбоната кальция:
CaCO3 = CaO + CO2
Реакция замещения - химическая реакция,в результате которой атомы одного элемента, входящие в состав простого вещества, замещают атомы другого элемента в его сложном соединении. Как следует из определения, в таких реакциях одно из исходных веществ должно быть простым, а другое сложным.
Типичный пример - вытеснение более активным металлом менее активного из раствора его соли:
Zn + FeSO4 = ZnSO4 + Fe
Реакции обмена - реакция, в результате которой два сложных вещества обмениваются своими составными частями.
Типовые примеры - реакции осаждения либо нейтрализации:
HCl + KOH = KCl + H2O
Классификация по изменению степени окисления
Реакция может проходить как с изменением степени окисления атомов элементов, так и без. В первом случае реакции называются окислительно-восстановительными (ОВР). Хочу сразу отметить, что не бывает отдельно окислительных или восстановительных реакций. В реакции всегда присутствует и окислитель, и восстановитель.
Пример ОВР - окисление меди серой, приведен чуть выше.
Пример не ОВР - нейтрализация соляной кислотой гидроксида калия - также чуть выше.
Классификация по тепловому эффекту
Реакции могут либо отдавать тепло, либо забирать его.
Если реакция идет с выделением тепла - то её называют экзотермической (экзо - наружу).
Если наоборот, реакция идет с поглощением тепла - то её называют эндотермической (эндо - внутрь).
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом. Его обозначают буквой Q («ку») и выражают в кДж.
ЗАДАНИЕ №7 — электролитическая диссоциация Электролиты
Итак, электролиты - вещества, расплавы или растворы которых проводят электрический ток из-за диссоциации на ионы. Типичными электролитами являются кислоты, основания, соли.
Сильные электролиты
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора (сильные кислоты, такие как HCl, HBr, HI, HNO3,H2SO4).
От себя добавлю, что на самом деле степень диссоциации зависит от концентрации в любом случае, даже в растворах сильных кислот степень диссоциации не равна единице в сильно концентрированных растворах. Ну и если быть очень придирчивым, то единице степень диссоциация не может быть равна никогда, так как всегда найдется хотя бы одна молекула, которая не продиссоциировала. Но для ОГЭ мы считаем, что сильные электролиты всегда диссоциируют полностью со степенью равной единице.
Слабые электролиты
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. Примеры - вода, плавиковая кислота...
Сила электролита зависит во многом от растворителя.
Неэлектролиты
Неэлектролиты — вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
ЗАДАНИЕ №8 — реакции ионного обмена Реакция ионного обмена - одна из видов химических реакций, продуктами которой являются вода, газ или осадок.
Иначе говоря, вещества обмениваются ионами только тогда, когда образуется либо газ, покидающий реакционную смесь, либо малорастворимое вещество - осадок или вода. Более профессиональным языком можно сказать, что движущей силой реакции ионного обмена является образование продукта иного агрегатного или фазового состояния в сравнении с реагентами.
На практике чаще всего мы сталкиваемся с реакциями в растворах, в результате которых образуется осадок, либо газ, либо вода. Чаще всего это реакции обмена.
Пример - реакция карбоната натрия и серной кислоты с выделением углекислого газа:
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ +H2O
В ионом виде:
2Na+ + CO32- + 2H+ + SO42- → 2Na+ + SO42- + CO2↑ + H2O
В сокращенном ионном виде:
CO32- + 2H+ → CO2↑ + H2O
Для успешного решения задач нам необходимо запомнить следующие правила:
используем таблицу растворимости: если видим, что продукт (то, что слева в уравнении) нерастворим, то реакция идет.
если видим в левой части газ (CO2, H2S, SO2 - типичные для ионного обмена), реакция идет.
если видим воду (H2O), реакция идет.

ЗАДАНИЕ №9 — свойства металлов и неметаллов
Химические свойства металлов
Для ОГЭ нам достаточно следующих знаний:
металлы реагируют с неметаллами всегда
металлы реагируют с кислотами
металлы реагируют с кислородом
Химические свойства неметаллов
неметаллы реагируют с металлами
неметаллы реагируют с водородом
неметаллы реагируют с кислородом
ЗАДАНИЕ №10 — химические свойства оксидов Химические свойства оксидов
оксиды реагируют с водой
основные оксиды реагируют с кислотами
кислотные оксиды реагируют с основаниями
амфотерные металлы и их оксиды - цинк и алюминий - реагируют и с кислотами, и с основаниями
основания реагируют как с кислотами, так и с амфотерными основаниями (цинк и алюминий)
кислоты реагируют как с основаниями, так и с амфотерными основаниями (цинк и алюминий)
Многие варианты построены на свойстве амфотерности, поэтому про алюминий и цинк необходимо помнить всегда.
ЗАДАНИЕ №11 — свойства кислот и оснований Кислоты
Напомню, что кислоты - это химические соединения, диссоциирующие на протоны (H+). Примеры простейших кислот - соляная (HCl), серная (H2SO4), азотная (HNO3).
Основания
Основания же - вещества, диссоциирующие на гидроксид ионы (OH-).
Простейшими примерами являются едкий калий и натрий (KOH и NaOH). Едкими их называют, кстати, неспроста. Они действительно разъедают и щиплют при попадании на кожу. Поэтому опасность их не стоит недооценивать.

Итак, перейдем к рассмотрению химических свойств данных классов.
Химические свойства кислот
Классификацию кислот мы рассматривали в разборе 5 задания ОГЭ по химии. Я рекомендую перед дальнейшем изучением химических свойств вспомнить классификацию кислот для общего понимания.
Итак, перейдем к рассмотрению свойств кислот:
реакция с основными оксидами: в качестве примера приведена реакция оксида кальция с соляной кислотой. В данной реакции продуктами являются соль - хлорид кальция, которым посыпают дороги в гололёд, и вода, которую мы пьем каждый день.

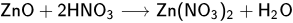

обменные реакции с солями, если в результате реакции образуется нерастворимое вещество либо газ. В качестве примера приведена реакция хлорида бария с серной кислотой, в результате которой образуется осадок сульфата бария и летучий хлороводород.

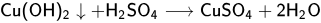
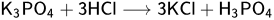
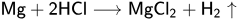
Химические свойства оснований
Перед изучением химических свойств оснований, полезно вспомнить классификацию оснований из 5 задания ОГЭ по химии.
Итак, перейдем к разбору химических свойств оснований:
вышеприведенная реакция с кислотами - реакция нейтрализации
реакция с амфотерными основаниями, например, гидроксидом цинка и алюминия:

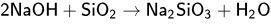
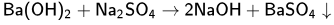
ЗАДАНИЕ №12 — химические свойства солей Соли - вещества образованные ионом металла и кислотным остатком:

Основная масса заданий основана на обменных реакциях, о которые упомянуты в химических свойствах кислот и оснований. Если в результате реакции образуется осадок, либо газ, либо вода - то реакция идет. Также соли реагируют с металлами, стоящими левее металла, входящего в состав соли - то есть более активного.
ЗАДАНИЕ №13 — чистые вещества и смеси Чистые вещества
Чистые вещества (или индивидуальные вещества) - вещества, которые состоят из молекул или атомов одного вида.
Смеси
Смеси - системы, состоящие из двух и более веществ.
На многих сайтах и общеобразовательных порталах, даже на википедии до моей правки, смеси определяют как вещество, состоящее из нескольких веществ. Это в корне не верно. Вещество само по себе чистое вещество. А система из нескольких веществ называется смесью. Мои слова подтверждаются в англоязычной литературе и интернете, а на российских ресурсах возникает путаница.

Правила работы в школьной лаборатории Общие правила:
Работать в лаборатории необходимо в халате, а при проведении опытов с особо опасными веществами использовать респиратор, защитные очки и перчатки. Волосы должны быть убраны. (последний пункт особенно актуален для девушек)
Учащиеся могут находиться в химическом кабинете только в присутствии учителя.
Пребывание учащихся в помещении лаборантской запрещается.
Присутствие посторонних лиц в кабинете химии во время эксперимента допускается только с разрешения учителя.
Не допускается нахождение учащихся в кабинете химии во время его проветривания. (так как его проветривают от вредных газов!)
Учащимся запрещается бегать по кабинету, шуметь и устраивать игры.
Перед работой необходимо внимательно выслушать инструктаж учителя.
В кабинете химии запрещается принимать пищу и напитки.
Учащимся запрещается бегать самостоятельно проводить опыты, не предусмотренные в работе.
Запрещается самостоятельно устранять неполадки в оборудовании.
По окончании практической работы учащиеся должны помыть руки с мылом.
Требования при работе с веществами:
Щелочь и кислота моментально прожгут одежду и кожу.
Наливать и насыпать вещества нужно только над столом.
Наливать и насыпать вещества можно через воронку, кончик воронки должен касаться стенки пробирки.
Твердые сыпучие реактивы запрещено брать руками. Их измельчение производится с помощью пестика в ступке.
Химические вещества нельзя пробовать на вкус.
При определении запаха запрещается наклоняться над пробиркой. Нужно легкими движениями руки направить пар или газ к носу и осторожно вдыхать.
При разбавлении концентрированных кислот и щелочей небольшими порциями приливать кислоту (или концентрированный раствор щелочи) в воду, а не наоборот.
При встряхивании пробирки ее отверстие нельзя закрывать пальцем.
Перед нагреванием заполнять пробирку жидкостью более чем на 1/3 часть. Необходимо начинать со слабого нагревания сосуда. Пробирку нагревайте сначала всю, а только затем ту часть, где находится вещество.
Отверстие пробирки при нагревании направлять от себя и других.
В ходе нагревания запрещается заглядывать в сосуд и наклоняться над ним.
Запрещается вносить в кабинет и выносить из кабинета вещества и оборудование.
Запрещается излишек реактива ссыпать (выливать) обратно в банку (склянку).
Запрещается выливать в канализацию отработанные растворы. Остатки собираются в специально предназначенную посуду.
Требования при работе с нагревательными элементами:
Гасить спиртовку необходимо только накрывая пламя колпачком или крышкой.
Запрещается зажигать одну спиртовку от другой.
Запрещается передавать зажженную спиртовку.
Запрещается оставлять без присмотра нагревательные приборы.
Лабораторная посуда
пробирки (проведение опытов)
конические колбы (проведение опытов и хранение растворов веществ)
круглодонные колбы (перегонка жидкостей)
воронки (фильтрование неоднородных растворов)
аппарат Киппа (собирание газов)
колба Вюрца (отделение жидкостей с различной температурой кипения)
кристаллизатор (охлаждение веществ)
эксикатор (хранение токсичных или «влаголюбивых» веществ)
Мерная посуда
мензурка
мерная пробирка
мерный цилиндр
мерный стакан
Оборудование для взвешивания
технические весы
электронные весы
Оборудование для нагрева
штатив для пробирок
лабораторный штатив ( для закрепления химического оборудования)
ложечка для сжигания сухих веществ
тигельные щипцы (для удерживания химической посуды)
ручной держатель для пробирок
фарфоровая ступка (для размельчения сухих веществ)
тигли и фарфоровые чашки (для нагревания веществ до высокой температуры)
спиртовка
ЗАДАНИЕ №14 — степени окисления элементов Степень окисления - условная величина, показывающая заряд атома в молекуле.
Степень окисления никогда не показывает реальный заряд атома - это условная величина, принимаемая нами для удобства рассчетов химических реакций.
Чтобы определить степень окисления атома в молекуле, следует пользоваться следующими правилами:
степень окисления водорода всегда +1 (исключение - гидриды металлов)
степень окисления кислорода всегда -2 (исключения - пероксиды и фториды)
степень окисления металлов первой группы +1, второй +2, алюминия +3
Окислитель - это атом или ион в молекуле, который забирает электроны.
Восстановитель - это атом или ион в молекуле, который отдает электроны.
Окислитель в ходе реакции восстанавливается, а восстановитель наоборот - окисляется!

Наиболее часто встречающимися окислителями являются кислоты, соли и оксиды с максимально положительной степенью окисления входящего в них элемента.
кислоты: HNO3, H2SO4, HClO4, H2Cr2O7
соли: KСlO4, KClO3, KNO3, KMnO4, K2Cr2O7
оксиды: PbO2, Mn2O7, CrO3, N2O5
активные неметаллы – фтор, хлор, кислород, озон
Наиболее часто встречающиеся восстановители:
металлы
вещества с минимально возможной (отрицательной) степенью окисления неметалла
- водородные соединения: NН3, HI, HBr, H2S
- соли: KI, NaBr, K2S
Составление окислительно-восстановительной реакции (ОВР)
Основное правило, которым мы должны руководствоваться при составлении ОВР:
Количество электронов, отданное восстановителем, равно количеству электронов, принятых окислителем.
Именно этот факт позволяет уравнять химическую реакцию.
ЗАДАНИЕ №15 — вычисление массовой доли Молекулярная масса — масса молекулы, выраженная в атомных единицах массы.
Массовая доля (ω) химического элемента — отношение относительной атомной массы данного элемента с учетом всех его атомов в молекуле к относительной молекулярной массе вещества.
В формульном выражении это выглядит следующим образом:

ω(э) – массовая доля элемента
Ar(э) – относительная атомная масса элемента
n – число атомов элемента э в молекуле вещества
Mr – относительная молекулярная масса вещества
ЗАДАНИЕ №16 — периодический закон Менделеева Для решения 16 задания ОГЭ по химии нам потребуются ровно те же знания, что и для решения второго задания, поэтому, чтобы не повторяться, нужно вспомнить теорию ко 2 заданию
ЗАДАНИЕ №17 — органические вещества Органическая химия - химия соединений углерода.
Благодаря удивительному свойству атома углерода, возможно существование миллионов различных соединений, именующихся органическими.
Почему же углерод такой особенный?
Строение атома углерода
Оказывается, электронное строение атома углерода позволяет образовывать ему прочную связь с его же соседним атомом.
К слову, поэтому алмаз такой и прочный. В алмазе все вакантные позиции заняты его же атомами, а в органических соединениях это могут быть атомы водорода, кислорода, азота и прочих атомов.
Строение атома углерода делает возможным образование четырех связей.
В зависимости от того, сколько у углерода соседних атомов, он может образовывать с ними одинарную, двойную или тройную связь, меняя при этом гибридизацию атома.
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
sp3 гибридизация
Если у атома углерода 4 соседа, то гибридизация его орбиталей sp3 и форма молекулы - тетраэдр.
Примеры соединений с sp3 гибридизацией - предельные соединения с одинарными связями - алканы, предельные спирты.
sp2 гибридизация
Если у атома углерода 3 соседа, то гибридизация его орбиталей sp2.
Примеры с sp2 гибридизацией - соединения с двойными связями - алкены, карбоновые кислоты, альдегиды и кетоны.
sp гибридизация
Если у атома углерода 2 соседа, то гибридизация его орбиталей sp и молекула линейна в данном месте.
Примеры с sp гибридизацией - соединения с тройной связью - алкины.
Выдержка из теории строения органических соединений:
атомы в молекулах соединены друг с другом в определённом порядке в соответствии с их валентностями
свойства веществ определяются не только их составом, но и химическим строением
Изомеры - вещества, имеющие одинаковый состав, но разное строение и разные свойства.
Свойство образовывать изомеры называется изомерией.
Гомологи - органические соединения одного класса, имеющие сходное строение и свойства, но разный количественный состав.
Химические свойства органических соединений
В 9 классе нам достаточно знать:
органические соединения сгорают до углекислого газа и воды
спирты являются жидкостями и реагируют со щелочными металлами
карбоновые кислоты реагируют с металлами и щелочами
ЗАДАНИЕ №18 — pH и качественные реакции Индикаторы
Индикатор - химическое вещество, меняющее окраску в зависимости от pH среды.
Самые известные индикаторы - фенолфталеин, метилоранж, лакмус и универсальный индикатор. Их цвета в зависимости от среды на картинке ниже:
А вот ещё цвета индикаторов более подробно с жизненными примерами:
С индикаторами мы разобрались, перейдем к качественным реакциям на ионы.
Качественные реакции на ионы
Качественные реакции на катионы и анионы представлены в таблице ниже.
Как правильно справиться с ЗАДАНИЕМ 8 в тесте ОГЭ по химии?
Для этого необходимо выбрать качественную реакцию на один из предоставленных вариантов и убедится, что данный реактив не вступает в реакцию со вторым веществом.
ЗАДАНИЕ №19 — химические свойства веществ В 19 задании ОГЭ по химии нам необходимо вспомнить все химические свойства - как простых веществ, так и сложных.
Для этого нам необходимо вспомнить теорию следующих заданий:
химические свойства металлов и неметаллов
химические свойства оксидов
химические свойства кислот и оснований
химические свойства солей
качественные реакции
ЗАДАНИЕ №20 — метод электронного баланса Метод электронного баланса
Метод электронного баланса - метод уравнивания химических реакций, основанный на изменении степеней окисления атомов в химических соединениях.
Алгоритм наших действий выглядит следующим образом:
Вычисляем изменение степени окисления каждого элемента в уравнении химической реакции
Выбираем только те элементы, которые поменяли степень окисления
Для найденных элементов составляем электронный баланс, заключающийся в подсчете количества приобретенных или отданных электронов
Находим наименьшее общее кратное для переданных электронов
Полученные значения и есть коэффициенты в уравнении (за редким исключением)
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
HI + H2SO4 → I2 + H2S + H2O
Определите окислитель и восстановитель.
Итак, составляем электронный баланс. В данной реакции у нас меняют степени окисления сера и йод.
Сера находилась в степени окисления +6, а в продуктах - -2. Йод имел степень окисления -1, а стал 0.
Если у Вас возникли трудности с расчетом, то вспомните, как рассчитывать степень окисления.
1 | S+6 + 8ē → S–2
4 | 2I–1 – 2ē → I2
Сера забирает 8 электронов, а йод отдает только два - общее кратное 8, и дополнительные множители 1 и 4!
Расставляем коэффициенты в уравнении реакции согласно полученным данным:
8HI + H2SO4 = 4I2 + H2S + 4H2O
Не забываем указать, что сера в степени окисления +6 является окислителем, а иод в степени окисления –1 – восстановителем.







































