Просмотр содержимого документа
«Теория электролитической диссоциации»

Теория электролитической диссоциации
МБОУ «СОШ № 12 имени В.Г.Распутина»
г.Братск
Холод О.Б.

Фарадей Майкл
22. IX. 1791 – 25. VIII. 1867
Английский физик и химик.
В первой половине 19 в. ввел понятие
об электролитах и неэлектролитах.
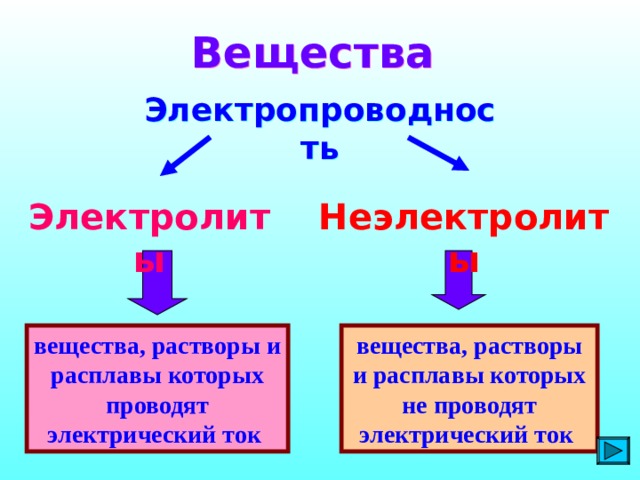
Вещества
Электропроводность
Электролиты
Неэлектролиты
вещества, растворы и расплавы которых проводят электрический ток
вещества, растворы и расплавы которых не проводят электрический ток

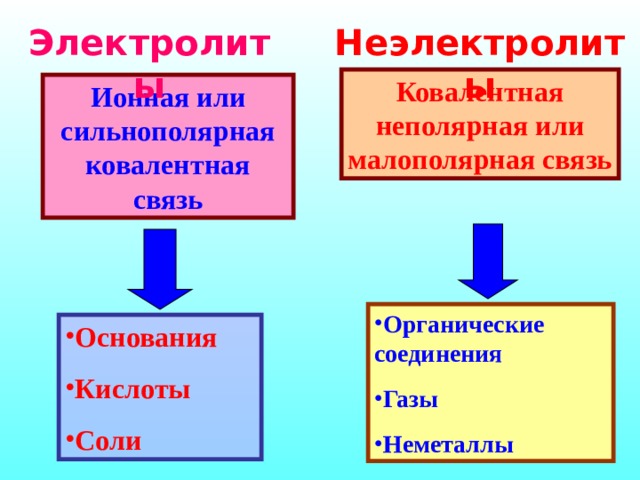
Неэлектролиты
Электролиты
Ковалентная неполярная или малополярная связь
Ионная или сильнополярная ковалентная связь
- Органические соединения
- Газы
- Неметаллы

Причины распада вещества на ионы в расплавах
Нагревание усиливает колебания ионов в узлах кристаллической решётки - кристаллическая решётка разрушается .
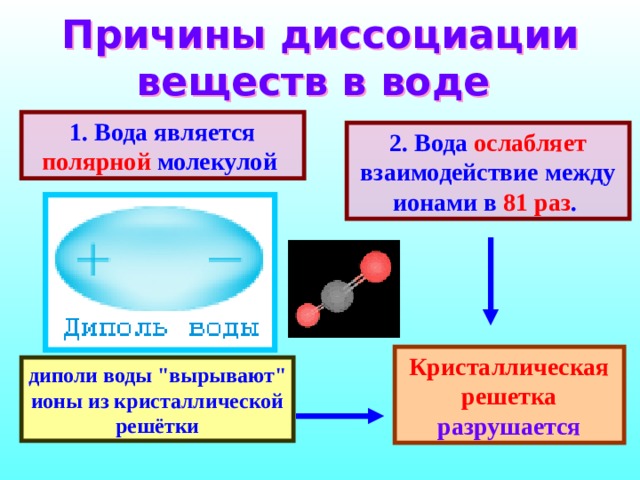
Причины диссоциации веществ в воде
1. Вода является полярной молекулой
2. Вода ослабляет взаимодействие между ионами в 81 раз .
Кристаллическая решетка разрушается
диполи воды "вырывают" ионы из кристаллической решётки
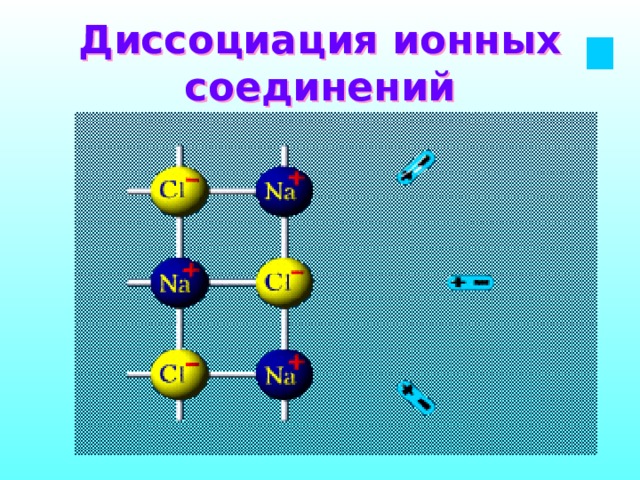
Диссоциация ионных соединений
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
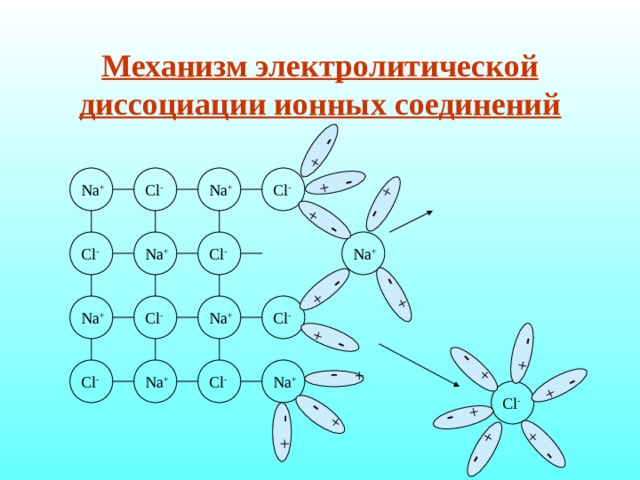
Механизм электролитической диссоциации ионных соединений
Na +
Cl -
Cl -
Na +
Cl -
Na +
Na +
Cl -
Na +
Na +
Cl -
Cl -
Na +
Cl -
Cl -
Na +
Cl -
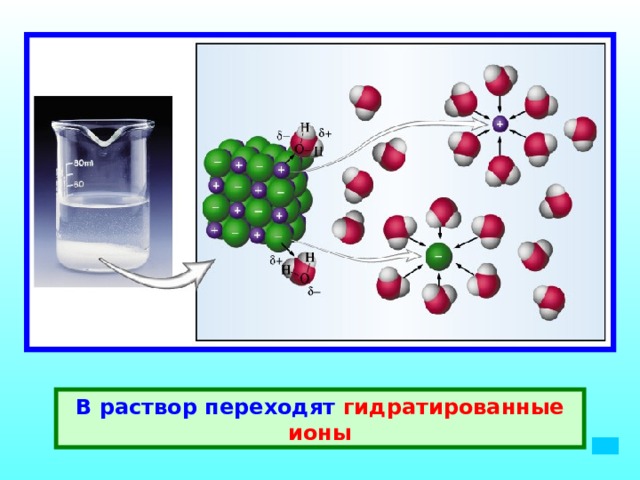
В раствор переходят гидратированные ионы
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
+ -
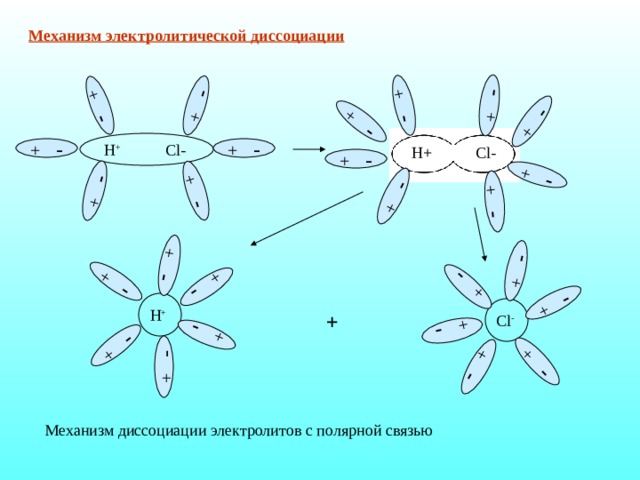
Механизм электролитической диссоциации
Н + Cl-
Cl-
Н+
+ -
+ -
+ -
Н +
+
Cl -
Механизм диссоциации электролитов с полярной связью

Образование в результате распада электролитов гидратированных ионов отражается при написании уравнений диссоциации, однако, чаще эти уравнения записывают в более короткой форме
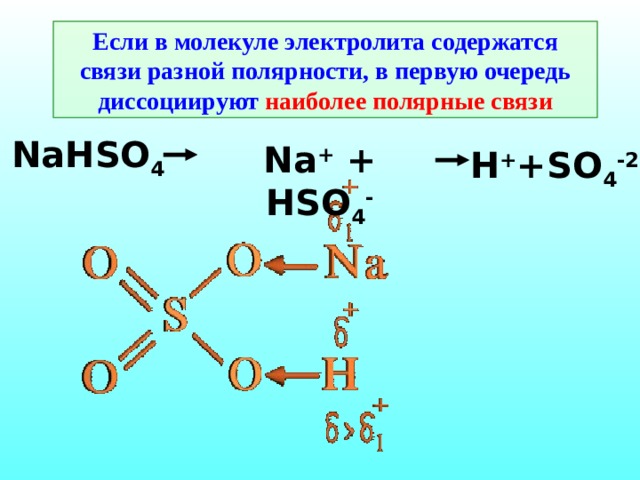
Если в молекуле электролита содержатся связи разной полярности, в первую очередь диссоциируют наиболее полярные связи
NaHSO 4
Na + + HSO 4 -
H + +SO 4 -2

Теория электролитической диссоциации
Процесс растворения или плавления электролитов сопровождается образованием заряженных частиц , способных проводить электрический ток
процесс растворения электролитов сопровождается образованием заряженных частиц, способных проводить электрический ток
С. А. Аррениус (1859-1927)

1. Электролиты при растворении в воде распадаются на положительные и отрицательно заряженные ионы – электролитическая диссоциация .
2. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу – катоду ( катионы ), отрицательно заряженные ионы к положительному полюсу - аноду ( анионы ).
3. Диссоциация - обратимый процесс. Наряду с распадом молекул на ионы может протекать процесс соединения ионов в молекулы ( ассоциация )

И.А. Каблуков – русский химик.
Ввел представление
о гидратации ионов.
В.А. Кистяковский -русский
химик. Объединил ТЭД
с теорией растворов
Д.И. Менделеева.

Успехов в познании !









































