ВсОШ по химии, III региональный этап
2013-2014 учебный год
Задания теоретического тура Девятый класс
Задача 9-1
Для проведения опыта юный химик приготовил бесцветные растворы двух веществ. К 100 мл 8.40 %-ного раствора вещества 1 плотностью 1.026 г/мл он прилил 100 мл 6.31 %-ного раствора вещества 2 с плотностью 1.06 г/мл. При нагревании из полученного раствора выделился газ объемом 3,057 л (25 °C, давление 1 атм), не поддерживающий горения и не изменяющий окраски растворов индикаторов. При выпаривании полученного раствора из него выделились кубические бесцветные кристаллы соли массой 7.31 г.
Определите неизвестные вещества, запишите уравнение реакции (1). Определите массовую долю соли в растворе после окончания выделения газа (реакция 2).
Предложите другой метод получения выделившегося газа.
Задача 9-2
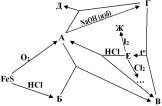 При обжиге сульфида железа (II) образуется газ А (реакция 1), а если обработать сульфид железа (II) соляной кислотой, образуется газ Б (реакция 2). При пропускании А и Б в воду наблюдается помутнение в результате образования В (реакция 3). Если пропускать газ А через раствор NaOH, сначала образуется Г (реакция 4), а при избытке А образуется Д (реакция 5). Вещество В растворяется при кипячении в растворе Г с образованием Е (реакция 6), которое под действием соляной кислоты распадается на В и А (реакция 7). Раствор Е обесцвечивает раствор йода, при этом образуется Ж (реакция 8). Вещество E используют для удаления следов хлора (реакция 9). Все перечисленные вещества А–Ж содержат серу. Ниже приведена схема превращений:
При обжиге сульфида железа (II) образуется газ А (реакция 1), а если обработать сульфид железа (II) соляной кислотой, образуется газ Б (реакция 2). При пропускании А и Б в воду наблюдается помутнение в результате образования В (реакция 3). Если пропускать газ А через раствор NaOH, сначала образуется Г (реакция 4), а при избытке А образуется Д (реакция 5). Вещество В растворяется при кипячении в растворе Г с образованием Е (реакция 6), которое под действием соляной кислоты распадается на В и А (реакция 7). Раствор Е обесцвечивает раствор йода, при этом образуется Ж (реакция 8). Вещество E используют для удаления следов хлора (реакция 9). Все перечисленные вещества А–Ж содержат серу. Ниже приведена схема превращений:
Вопросы:
1) Определите вещества А–Ж. Напишите уравнения реакций всех описанных превращений. В схемах указаны исходные вещества, а среди продуктов указаны только вещества, содержащие серу (кроме 1.9):
FeS + O2 → A FeS + HCl → Б A + Б → В | A + NaOHизб. →Г Г + A → Д Г + В →Е | Е + HСl → А + В Е + I2 → Ж Е + Cl2 + H2O→ …. |
2) Из водного раствора соль Е выделяется в виде кристаллогидрата, содержащего 36.29 % воды. Определите его состав.
3) Массовые доли элементов в кристаллогидрате Ж: Na – 15.03 %, S – 41.83 %, O –41.83 %, причем из 2 моль E образуется 1 моль Ж. Определите состав и предложите структурную формулу аниона Ж.
Задача 9–3
При сливании при комнатной температуре 1 М растворов гидрокарбоната натрия (раствор 1) и хлорида магния (раствор 2) в широком интервале объемных соотношений (от 2 : 1 до 1 : 10) сразу видимых признаков протекания реакции замечено не было. При продолжительном (неделя) стоянии раствора, получившегося при сливании растворов 1 и 2, образуются белые пластинчатые кристаллы вещества Х. При нагревании до 50–60 °C раствора, получившегося при сливании растворов 1 и 2, выпадает мелкокристаллический осадок вещества Х. Выделенный и высушенный Х при прокаливании до 600 °C теряет 70.8 % массы. При растворении 10.0 г Х в 100 г 10 % раствора соляной кислоты образуется 106.82 г раствора.
Определите вещество Х (состав). Ответ подтвердите расчетами. Напишите уравнения реакции растворения Х в кислоте и реакцию его термического разложения (реакции 1, 2)
Напишите уравнение реакции получения Х (реакция 3)
Какие процессы происходят при нагревании раствора гидрокарбоната натрия (уравнение реакции 4)?
Предложите путь проведения синтеза вещества Х из тех же реагентов, приводящий к более быстрому выделению осадка (помимо нагревания)
Задача 9-4
Основным компонентом минерала является оксид A металла Y, содержащий 88,15 % металла. В качестве примесей в этом минерале также присутствуют вещества B и C, имеющие тот же качественный состав, что и A, и содержащие 84,80 % и 83,22 % металла соответственно. Известно, что этот металл может разлагаться с выделением газа X, причем в разных количествах.
Вопросы:
Установите формулы соединений A, B, C.
Установите формулу вещества Х. Напишите уравнение реакции, приводящие к образованию X. К какому типу реакций они относится?
В промышленности используют установки, в которых вещество A находится в атмосфере газа X. Как называются эти установки?
Напишите уравнения реакций металла, содержащегося в А, В и С с избытком фтора и избытком брома, исходя из степеней окисления, которые проявляет металл в соединениях А и С. Ответ обоснуйте. При ответе примите во внимание силу окислителей и размеры их атомов.
Предложите реакцию превращения металла Y с  , в результате которой получается
, в результате которой получается  .
.
Задача 9-5
Максимальная теплота
Дана таблица тепловых эффектов химических реакций при температуре 298 К:
| Уравнение реакции | Теплота реакции Q, кДж/моль |
| C(графит) + O2(г) = CO2(г) | + 394 |
| 2C(графит) + O2(г) = 2CO(г) | + 221 |
| CH4(г) + 2O2(г) = CO2(г) + 2H2O(ж) | + 890 |
| 2C2H2(г) + 5O2(г) = 4CO2(г) + 2H2O(ж) | + 2600 |
| C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж) | + 1411 |
| 2H2(г) + O2(г) = 2H2O(ж) | + 572 |
| N2(г) + 3H2(г) = 2NH3(г) | + 92 |
| N2(г) + O2(г) = 2NO(г) | – 182 |
| N2(г) + 2O2(г) = 2NO2(г) | – 68 |
| S(тв) + H2(г) = H2S(г) | + 21 |
| S(тв) + O2(г) = SO2(г) | + 297 |
| 2S(тв) + 3O2(г) = 2SO3(г) | + 792 |
В вашем распоряжении имеется по 1 кг каждого из указанных в этих уравнениях веществ.
1) Предложите одну реакцию между двумя из этих веществ, которая позволит получить максимальную теплоту. Обоснуйте ваш выбор (с помощью расчетов и/или качественных рассуждений).
2) Чему равна эта теплота?
Десятый класс
Задача 10-1 .
Одним из методов получения кремния является нагревание смеси порошков металлического магния и песка в электрической печи без доступа воздуха.
Вопросы:
Напишите формулу песка, считая (теоретически), что он состоит из одного вещества.
Магний и песок смешали в мольном соотношении 1,7 : 0,8. При этом было получено 105 г кремния. Какова масса исходной смеси?
Какие примеси содержатся в полученном кремнии?
Для отделения примесей охлажденную после сплавления массу помещают в избыток соляной кислоты. При этом наблюдаются яркие вспышки. Напишите уравнения реакций. Какая из них сопровождается вспышками и почему?
Какой минимальный объем 10 % -ной соляной кислоты (плотностью 1,05 г/мл) потребуется для отделения кремния от примесей?
Задача 10–2
Соли натрия A–F, которые содержат также кислород и элемент Х, взаимодействуют с разбавленной серной кислотой с выделением газа Z, имеющего плотность 2.857 г/л (н. у.). В некоторых случаях образуется также и простое вещество, соответствующее элементу Х. Дополнительная информация о солях A–F представлена в таблице.
| Соль | % Na по массе | Продукты реакции с H2SO4 | Уравнение реакции |
| A | 36.5 | Z | 1 |
| B | 29.1 | Z + X | 2 |
| C | 26.4 | 3Z + X | 3 |
| D | 24.2 | 2Z | 4 |
| E | 22.1 | 2Z | 5 |
| F | 17.0 | Z + 2X | 6 |
Кроме того, известно, что четыре соли связаны между собой посредством одностадийных превращений по схеме:  .
.
1) Определите элемент Х и газ Z. Ответ подтвердите расчетами.
2) Установите формулы солей A-F и изобразите их структурные формулы.
3) Напишите уравнения реакций (1–6) взаимодействия A–F с разбавленной серной кислотой.
4) Расшифруйте цепочку одностадийных превращений, напишите уравнения реакций (7–9) и укажите условия их проведения.
Задача 10-3
Элементы X, Y, Z и L образуют соединения состава: XYZ2L24O20 (соединение 1), XYL4O4 (соединение 2), X2Y2O7(соединение 3) и XZLO4(соединение 4), массовые доли кислорода в которых соответственно равны (%): 64.13; 40.25; 38.095 и 47.06.
Определите формулы этих соединений.
К какому классу и подклассу они относятся?
Назовите эти соединения. Ответы представьте в виде таблицы:
| № | Соединение | Брутто-формула | Формула | Класс | Подкласс | Название |
| 1 | XYZ2L24O20 |
|
|
|
|
|
| 2 | XYL4O4 |
|
|
|
|
|
| 3 | X2Y2O7 |
|
|
|
|
|
| 4 | XZLO4 |
|
|
|
|
|
Напишите реакцию взаимодействия растворов
a) соли 3 с гидроксидом бария.
b) солей 2 и 4
c) солей 2 и 3.
Напишите уравнения реакций получения веществ 1–4
Задача 10-4
Молекулы промышленно важного углеводорода А (DH2 = 13) в присутствии катализаторов образуют различные олигомеры:

1. Напишите структурные формулы А–E, учитывая, что MA : MB : MC : MD : ME = 1 : 2 : 3 : 3 : 4.
Из углеводородов А и В были получены изомерные углеводороды I–VI согласно приведенной ниже схеме превращений:

2. Напишите структурные формулы I–V, F–О. Учтите, что превращения F в G и K в L – изомеризации. Помните, что разные буквы не могут обозначать одно и то же вещество.
Задача 10-5
Отравление миоглобина
Монооксид углерода – сильный яд. В организме он способен присоединяться к некоторым белкам, предназначенным для связывания кислорода, например к миоглобину Mb:
Mb(р-р) + CO(г)  MbCO(р-р)
MbCO(р-р)
Давление CO, при котором доля связанного миоглобина составляет 50 %, равно: p1/2 = 0.018 мм рт. ст. (750 мм рт. ст. = 1 бар = 105 Па).
1. а) Запишите выражение для константы равновесия и рассчитайте ее значение. б) Сколько процентов миоглобина будет связано с CO при давлении pCO = 2p1/2?
2. Определите зависимость доли связанного миоглобина 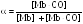 от давления CO и постройте (качественно) график этой зависимости.
от давления CO и постройте (качественно) график этой зависимости.
3. Константа связывания O2 миоглобином – в 220 раз меньше, чем константа связывания CO. Пусть в отравленном воздухе содержится 2 об. % CO. Во сколько раз в этом случае число молекул миоглобина, связанных с O2, будет меньше, чем число молекул, связанных с CO?
Примечание. Температура принимается одной и той же во всех случаях.
Одиннадцатый класс
Задача 11-1
При добавлении аммиака к голубому раствору А его окраска становится ярко-сине-фиолетовой (B) (реакция 1). При добавлении к A раствора желтой кровяной соли выпадает красно-бурый осадок (C) (реакция 2).
При нагревании порошка бинарного вещества D в токе аммиака цвет вещества становится розово-красным (вещество E) (реакция 3). При растворении вещества D в концентрированной соляной кислоте образуется раствор вещества F желто-оранжевого цвета (реакция 4). При небольшом разбавлении этого раствора водой окраска его становится зеленой (реакция 5), а при большем разбавлении голубой вследствие образования A (реакция 6).
Все перечисленные вещества содержат элемент Х, массовая доля Х в цезиевой соли кислоты F составляет 13,49%.
Вопросы:
1) Определите элемент X, ответ обоснуйте.
2) Определите вещества А–F, обоснуйте свой выбор, состав F подтвердите расчетом.
3) Напишите уравнения реакций всех описанных превращений.
4) Объясните изменение окраски при разбавлении раствора F.
5) Укажите цвет исходного соединения D.
Задача 11-2
Газ Х, хотя был открыт в 1868 г, был впервые выделен в 1895 г из минерала, основным компонентом которого является бинарное соединение A, содержащее 88.15 % металла Y. В качестве примесей в этом минерале также присутствуют вещества B и C, имеющие тот же качественный состав, что и A, и содержащие 84.80 % и 83.22 % металла Y соответственно.
Установите формулы соединений A, B, C и металла Y. Ответ подтвердите расчетами.
Установите, о каком газе X идет речь в задаче. Напишите уравнение реакции образования газа X из металла Y и его соединений. (уравнение 1).
В энергетике используют установки, в которых вещество A находится в атмосфере газа X.
Как называются эти установки?
Для получения вещества A, используемого в этих установках, бинарное соединение D, содержащее 67.62 % металла, обрабатывают водой, а затем раствором аммиака. Выпавшую при этом в осадок безводную соль E (76.28 % металла) прокаливают на воздухе (реакция 2). В результате прокаливания образуется вещество C, которое затем восстанавливают водородом до A. (реакция 3).
Установите формулы веществ D и E. Напишите уравнение прокаливания соли Е (реакция 2) и восстановления C до A (реакция 3).
Для получения металла Y металлическим кальцием восстанавливают вещество J (содержание металла Y 75.89 %), имеющее тот же элементный состав, что и D.
Установите формулу вещества J и напишите уравнение реакции получения металла Y (реакция 4).
Расшифруйте цепочку превращений

Задача 11-3
Молекулы промышленно важного углеводорода А (DH2 = 13) в присутствии катализаторов образуют различные олигомеры:

1. Напишите структурные формулы А–E, учитывая, что
MA : MB : MC : MD : ME = 1 : 2 : 3 : 3 : 4.
Из углеводородов А и В были получены изомерные углеводороды I–VI согласно приведенной ниже схеме превращений:

2. Напишите структурные формулы I–V, F–О. Учтите, что превращения F в G и K в L – изомеризации. Помните, что разные буквы не могут обозначать одно и то же вещество.
Задача 11-4
При сжигании 2.12 г смеси соединений А-С выделилось 1.344 л СО2 (в пересчете на н.у.) и образовалось 1.080 г воды. Когда такое же количество указанной смеси обработали сильным восстановителем LiAlH4 (реакция требует большой осторожности!), после нейтрализации получили 1.92 г соединения D в качестве единственного органического продукта реакции. Наконец, при обработке 2.12 г той же смеси избытком аммиачного раствора гидроксида серебра образовалось 11.88 г серебра.
Определите структурные формулы А-D.
Напишите уравнения реакций окисления А-С (реакции 1–3) и реакции их взаимодействия с аммиачным раствором гидроксида серебра (реакции 4–6).
Рассчитайте количественный состав смеси А-С (содержание каждого вещества в молях). Расчеты проверьте, используя массу вещества D, получившегося в результате реакций восстановления.
Задача 11-5
Кинетика реакции в газовой фазе
Неизвестное вещество X массой 16.80 г внесли в вакуумированный реакционный сосуд объемом 10.0 л, добавили катализатор разложения (металлическую медь) и нагрели сосуд до 230 °C. За ходом реакции, протекающей при постоянной температуре, следили по зависимости общего давления в сосуде и количества поглощенной теплоты от времени. Экспериментальные данные представлены в таблице.
| t, мин | 0 | 10 | 20 |
| pобщ, кПа | 117.1 | 160.4 | 187.7 |
| Q, кДж | 0 | –4.14 | –6.76 |
Через 30 мин сосуд охладили до 0 °C, давление в нем составило 47.7 кПа, а масса жидкости на дне сосуда – 16.38 г. Эта жидкость способна обесцвечивать бромную воду.
1. Установите формулу вещества X и напишите уравнение реакции, происходящей в сосуде. Ответ подтвердите расчётами.
2. Найдите состав полученной жидкости (в мольных %).
3. Определите кинетический порядок реакции разложения X и найдите период полураспада.
4. Рассчитайте теплоту реакции разложения (в кДж/моль).
Подсказка: в газовых реакциях целого порядка количество исходного вещества зависит от времени следующим образом:
0-й порядок: (t) = 0 – kt
1-й порядок: ln(t) = ln0 – kt
2-й порядок: 1/(t) = 1/0 + kt
Девятый класс
Задание: В девяти пронумерованных пробирках находятся твердые вещества: NH4Cl, (NH4)2CO3, MgSO4, Ca3(PO4)2, MnCl2, Pb(NO3)2, Na2S2O3, ZnSO4 и Zn3(PO4)2. Используя имеющиеся на столе реактивы и оборудование, определите каждое из веществ, находящихся в пробирках. Решение представьте в виде таблицы, в которой знаками ↓ и ↑ укажите образование осадка или газа, словом «раств.» - растворение твердой фазы, ставьте знак t˚ там, где реакция протекает при нагревании, и знак «–» там, где реакции нет, укажите в таблице Ваши наблюдения относительно цветов осадков; пронумеруйте реакции в таблице:
|
| NH4Cl | (NH4)2CO3 | MgSO4 | Ca3(PO4)2 | MnCl2 | Pb(NO3)2 | Na2S2O3 | ZnSO4 | Zn3(PO4)2 |
| H2O |
|
|
|
|
|
|
|
|
|
| HCl |
|
|
|
|
|
|
|
|
|
| NaOH |
|
|
|
|
|
|
|
|
|
Напишите уравнения реакций всех вышеперечисленных солей с приведенными реактивами, пронумеровав их так же, как и в таблице.
Ответьте на следующие вопросы:
Какие из приведенных веществ в водном растворе обладают окислительными, а какие – восстановительными свойствами? Ответ подтвердите уравнениями реакций.
Какие вещества называются окислителями и восстановителями (дайте определения)?
Какие из оксидов, соответствующих приведенным веществам, обладают амфотерными свойствами? Приведите уравнения реакций, подтверждающие Ваш ответ.
Какое из веществ, находящихся в пробирках, входит в состав апатита? Напишите реакцию растворения этого вещества в уксусной кислоте.
Для выполнения задания у Вас имеются:
Реактивы: HCl, NaOH, H2O (дист.) , фенолфталеиновая бумага
Оборудование: штатив с пробирками, шпатели, глазные пипетки, водяная баня.
Десятый класс
Уважаемый участник, Вам, конечно, хорошо известны задачи качественного анализа, целью которых является обнаружение присутствия того или иного вещества в смеси. А сегодня Вам предлагается попытать силы в решении противоположной задачи, а именно, доказательстве отсутствия в смеси какого-либо вещества.
Перед Вами пять пронумерованных пробирок, каждая с раствором смеси пяти веществ из следующего набора сульфатов: H2SO4, (NH4)2SO4, Na2SO4, MgSO4, ZnSO4, Al2(SO4)3. Таким образом, в каждой смеси отсутствует одно из веществ.
1. Предложите (в виде текста, блок-схемы или таблицы) схему анализа, позволяющую определить, какое вещество отсутствует в той или иной пробирке. Опишите последовательность действий при проведении эксперимента.
2. Напишите в сокращенном ионном виде уравнения реакций между веществами в пробирках и реактивами, сопровождающие аналитически-значимые эффекты (которые позволяют Вам сделать вывод о присутствии или отсутствии в системе того или иного вещества).
3. Используя предложенные Вам реактивы и оборудование, определите, какое вещество из указанного набора отсутствует в каждой из пробирок (учтите, что разные пробирки могут содержать одинаковые растворы). Ответ представьте в виде таблицы:
| № пробирки | 1 | 2 | 3 | 4 | 5 |
| Отсутствующее вещество |
|
|
|
|
|
Для выполнения задания у Вас имеются:
Реактивы: растворы H2SO4, NaOH и NH3, универсальная индикаторная бумага.
Оборудование: штатив с 10 пробирками, емкости с реактивами, оборудованные пипетками, держатель для пробирок, водяная баня или горелка.
Одиннадцатый класс
Лист 1
Код: _________, рабочее место _______, лаборатория _________
 Каждый год с наступлением холодов многие люди чувствуют симптомы "простудных заболеваний". Конечно, никому из нас не хочется сразу начинать интенсивное лечение таблетками и микстурами… Мы прибегаем к методам народной медицины – начинаем полоскать раздраженное горло разными отварами, настойками и другими средствами, угнетающими размножение болезнетворных микроорганизмов. Одним из таких "доступных" для каждого из нас способов лечения (который, кстати, не рекомендует современная отоларингология) является полоскании горла теплым раствором, содержащим на стакан воды по чайной ложке поваренной соли и питьевой соды, к которому добавлено 5−7 капель иодной настойки. Данный раствор действительно дезинфицирует и заживляет горло, основным действующим его компонентом является иодоформ (трииодметан). Иодоформ находит применение в качестве антисептического средства в стоматологии, наружного обеззараживающего средства ран и ожогов.
Каждый год с наступлением холодов многие люди чувствуют симптомы "простудных заболеваний". Конечно, никому из нас не хочется сразу начинать интенсивное лечение таблетками и микстурами… Мы прибегаем к методам народной медицины – начинаем полоскать раздраженное горло разными отварами, настойками и другими средствами, угнетающими размножение болезнетворных микроорганизмов. Одним из таких "доступных" для каждого из нас способов лечения (который, кстати, не рекомендует современная отоларингология) является полоскании горла теплым раствором, содержащим на стакан воды по чайной ложке поваренной соли и питьевой соды, к которому добавлено 5−7 капель иодной настойки. Данный раствор действительно дезинфицирует и заживляет горло, основным действующим его компонентом является иодоформ (трииодметан). Иодоформ находит применение в качестве антисептического средства в стоматологии, наружного обеззараживающего средства ран и ожогов.
| 1. Приведите структурную формулу иодоформа. |
|
| 2. Напишите уравнение реакции образования иодоформа в результате взаимодействия спиртового раствора иода с водным раствором питьевой соды (гидрокарбоната натрия). |
|
|
Сегодня Вам предстоит получить иодоформ в чистом виде в результате так называемой "иодоформной реакции" (реакции некоторых органических веществ с иодом в щелочной среде).
3. Среди перечисленных ниже веществ выберите те, которые вступают в иодоформную реакцию (отметьте правильный ответ в виде ).
метанол пентанон-3 пентанон-2 ацетофенон
бензальдегид ацетальдегид бутанол-2 толуол
Если у Вас осталось время, проверьте еще раз все и сдайте лист 1 с ответами члену Жюри.
Приступать к выполнению экспериментальной работы можно только после получения листа 2! Лист 2
Код: _________, рабочее место _______, лаборатория _________
Для выполнения задания у Вас имеются:
Реактивы: KIкр., I2,кр., растворы ацетона и NaOH, H2O (дистиллированная).
Оборудование: мерный цилиндр или пробирка, стакан, стеклянная палочка, шпатель, весы, маркер по стеклу, водоструйный насос, воронка Бюхнера с бумажным фильтром, колба Бунзена, чашка Петри, сушильный шкаф.
Методика получения иодоформа
В стакан объемом 50 мл поместите подготовленную заранее навеску 2,0 г мелкорастертого иода. Отмерьте с помощью мерного цилиндра 8 мл дистиллированной воды и перелейте ее в стакан с иодом. Перемешайте содержимое стакана стеклянной палочкой.
Взвесьте 3 г иодида калия и перенесите навеску в стакан с иодом. Перемешайте содержимое стакана стеклянной палочкой и отметьте заметное увеличение интенсивности окраски раствора. С помощью мерного цилиндра (используйте тот же мерный цилиндр, которым ранее отмеряли дистиллированную воду) отмерьте 10 мл водного раствора ацетона (раствор 1 мл ацетона в 9 мл воды). Перелейте отмеренный объем раствора ацетона к темно‑коричневому раствору в стакане и перемешайте с помощью стеклянной палочки.
Отмерьте с помощью мерного цилиндра 5 мл 10 %‑ного водного раствора гидроксида натрия (используйте тот же мерный цилиндр, которым ранее Вы отмеряли воду и раствор ацетона). Медленно, при постоянном перемешивании стеклянной палочкой, небольшими порциями (по ~1 мл) добавляйте отмеренный объем щелочи к реакционному раствору в стакане. Если после прибавления всего раствора щелочи первоначальная красновато‑коричневая окраска раствора не исчезла, добавьте еще немного (~0,5 мл) раствора гидроксида натрия. При этом важно не допускать большого избытка NaOH, т.к. иодоформ в щелочной среде быстро гидролизуется! После окончания добавления гидроксида натрия продолжайте перемешивание реакционного раствора еще в течение ~5 мин.
Подготовьте воронку Бюхнера и установку для фильтрования. Образовавшийся желтый осадок иодоформа отфильтруйте на воронке Бюхнера, стараясь при этом максимально перенести осадок из стакана на фильтр (от этой процедуры существенно зависит значение выхода Вашего продукта). Для этого аккуратно по палочке перенесите взмученный осадок и маточный раствор из стакана на подготовленную воронку Бюхнера. Включите водоструйный насос и присоедините его к колбе Бунзена (колба Бунзена при этом должна быть чистой и ополоснутой дистиллированной водой). Если весь маточный раствор с осадком перенести на фильтр полностью за один раз не удалось, содержимое стакана постепенно доливают по палочке на фильтр по мере уменьшения содержимого в воронке Бюхнера. После того, как весь маточный раствор отделен от осадка и в колбу Бунзена перестали поступать капли фильтрата, отсоедините насос от колбы Бунзена (ни в коем случае не закрывая кран водоструйного насоса!). Налейте на фильтр с осадком ~ 1 мл дистиллированной воды и вновь подключите насос к колбе Бунзена. После того, как в колбу Бунзена перестанут поступать капли воды, осадок на фильтре оставьте посушить в токе воздуха в течение 1‑2 мин. (не отключая при этом насос от колбы Бунзена). Затем отсоедините насос от колбы Бунзена и выключите кран водоструйного насоса.
Аккуратно извлеките бумажный фильтр из воронки Бюхнера и поместите его в чашку Петри (при этом обязательно подпишите чашку Петри). Оставьте сушиться полученный продукт в течение 25‑30 мин. в сушильном шкафу (при температуре не выше 60 С).
Пока полученный продукт сушится, вымойте посуду, которой Вы пользовались, и ответьте на предложенные теоретические вопросы.
Теоретические вопросы
| 4. С какой целью при приготовлении водного раствора иода в самом начале синтеза добавляли иодид калия? Подтвердите свой ответ соответствующим уравнением реакции. |
|
|
| 5. Напишите уравнение реакции получения иодоформа по описанной методике (в результате взаимодействия ацетона с иодом в присутствии гидроксида натрия). |
|
|
|
6. Попробуйте написать основные стадии механизма реакции иодирования ацетона в щелочной среде, приводящей к иодоформу. Почему иодирование ацетона идет с заметной скоростью лишь в щелочной среде? |
|
|
Высушенный продукт аккуратно перенесите (с помощью выданного Вам шпателя) на предварительно взвешенную кальку и определите массу полученного иодоформа. Все данные о массах запишите ниже.
| m кальки = | г | m кальки+продукта = | г | m продукта = | г |
| 7. Рассчитайте выход иодоформа в проведенном синтезе по отношению к навеске иода (2,0 г). Приведите все промежуточные формулы и расчеты. |
|
|
9
© ЦПМК ВсОШ по химии







 При обжиге сульфида железа (II) образуется газ А (реакция 1), а если обработать сульфид железа (II) соляной кислотой, образуется газ Б (реакция 2). При пропускании А и Б в воду наблюдается помутнение в результате образования В (реакция 3). Если пропускать газ А через раствор NaOH, сначала образуется Г (реакция 4), а при избытке А образуется Д (реакция 5). Вещество В растворяется при кипячении в растворе Г с образованием Е (реакция 6), которое под действием соляной кислоты распадается на В и А (реакция 7). Раствор Е обесцвечивает раствор йода, при этом образуется Ж (реакция 8). Вещество E используют для удаления следов хлора (реакция 9). Все перечисленные вещества А–Ж содержат серу. Ниже приведена схема превращений:
При обжиге сульфида железа (II) образуется газ А (реакция 1), а если обработать сульфид железа (II) соляной кислотой, образуется газ Б (реакция 2). При пропускании А и Б в воду наблюдается помутнение в результате образования В (реакция 3). Если пропускать газ А через раствор NaOH, сначала образуется Г (реакция 4), а при избытке А образуется Д (реакция 5). Вещество В растворяется при кипячении в растворе Г с образованием Е (реакция 6), которое под действием соляной кислоты распадается на В и А (реакция 7). Раствор Е обесцвечивает раствор йода, при этом образуется Ж (реакция 8). Вещество E используют для удаления следов хлора (реакция 9). Все перечисленные вещества А–Ж содержат серу. Ниже приведена схема превращений: , в результате которой получается
, в результате которой получается  .
. .
.

 MbCO(р-р)
MbCO(р-р)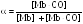 от давления CO и постройте (качественно) график этой зависимости.
от давления CO и постройте (качественно) график этой зависимости.

 Каждый год с наступлением холодов многие люди чувствуют симптомы "простудных заболеваний". Конечно, никому из нас не хочется сразу начинать интенсивное лечение таблетками и микстурами… Мы прибегаем к методам народной медицины – начинаем полоскать раздраженное горло разными отварами, настойками и другими средствами, угнетающими размножение болезнетворных микроорганизмов. Одним из таких "доступных" для каждого из нас способов лечения (который, кстати, не рекомендует современная отоларингология) является полоскании горла теплым раствором, содержащим на стакан воды по чайной ложке поваренной соли и питьевой соды, к которому добавлено 5−7 капель иодной настойки. Данный раствор действительно дезинфицирует и заживляет горло, основным действующим его компонентом является иодоформ (трииодметан). Иодоформ находит применение в качестве антисептического средства в стоматологии, наружного обеззараживающего средства ран и ожогов.
Каждый год с наступлением холодов многие люди чувствуют симптомы "простудных заболеваний". Конечно, никому из нас не хочется сразу начинать интенсивное лечение таблетками и микстурами… Мы прибегаем к методам народной медицины – начинаем полоскать раздраженное горло разными отварами, настойками и другими средствами, угнетающими размножение болезнетворных микроорганизмов. Одним из таких "доступных" для каждого из нас способов лечения (который, кстати, не рекомендует современная отоларингология) является полоскании горла теплым раствором, содержащим на стакан воды по чайной ложке поваренной соли и питьевой соды, к которому добавлено 5−7 капель иодной настойки. Данный раствор действительно дезинфицирует и заживляет горло, основным действующим его компонентом является иодоформ (трииодметан). Иодоформ находит применение в качестве антисептического средства в стоматологии, наружного обеззараживающего средства ран и ожогов.
















