| 2 | Актуализация знаний и фиксация затруднений в деятельности | - Прежде чем переходить к новой теме, давайте вспомним некоторые ранее изученные понятия, которые помогут нам на нашем сегодняшнем уроке. Параллельно с ответами на вопросы, даю карточки, 3-м ученикам. Карточка 1. 1. Что такое атом? 2.Из каких элементарных частиц состоит ядро атома? 3. Как определить заряд ядра атома? Карточка 2. 1. Что такое химическая связь? 2. Перечислить основные типы химических связей. 3. Что такое ковалентная неполярная связь? Карточка 3. 1. Степень окисления – это? 2. Валентность – это? 3.Какими цифрами обозначается валентность? - Ребята, которые получили карточки, на их решение у вас есть 3 минуты. На все вопросы отвечать письменно. Можете приступать. Задаю вопросы остальным детям. - Что такое химический элемент? - Верно ребята. Теперь вспомните и ответьте. Какими свойствами обладает химический элемент? - Всё правильно. Теперь давайте вспомним, что такое химическое вещество? - Молодцы. А какими свойствами обладает химическое вещество? - Правильно ребята. Сейчас мы проверим работы ваших товарищей, которые работали по карточкам. Забираю карточки у детей. Называю 3-х человек, которые устно, вслух, проанализируют и проверят карточки одноклассников. - В конце урока я озвучу оценки за карточки и за их проверку. - Теперь, когда мы с вами вспомнили некоторые основные понятия, мы можем переходить к новой теме.
| Дети, получившие карточки отвечают на вопросы письменно. Остальные дети отвечают на устные вопросы. Ребята поднимают руку и отвечают на вопрос о химическом элементе. - Химический элемент – это совокупность атомов с одинаковым зарядом атомных ядер. Дети отвечают о свойствах химического элемента. - К свойствам химического элемента относят: распространённость в природе, положение в ПСХЭ, возможные валентности и степени окисления, заряд ядра, относительная атомная масса, химический знак и некоторые другие свойства. Учащиеся отвечают понятие «химическое вещество». - Химическое вещество – это совокупность атомов, молекул или ионов, находящихся в определённом агрегатном состоянии и обладающие конкретными физическими и химическими свойствами. Ребята отвечают на вопрос о свойствах химического вещества. - Химическое вещество обладает химическими и физическими свойствами. К физическим свойствам химического вещества относят: агрегатное состояние, температуры плавления и кипения, растворимость в воде и других полярных растворителях, цвет, запах, электрическая проводимость и другие. К химическим свойствам химического элемента относят: способность взаимодействовать с простыми и сложными веществами, проявление окислительно-восстановительных свойств. Названные дети по очереди анализируют работы одноклассников. Карточка 1. 1.Атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. 2. Протоны и нейтроны. 3.Заряд ядра атома равен порядковому номеру соответствующего элемента. Карточка 2. 1. Химическая связь – это электростатическое взаимодействие, которое связывает отдельные атомы в молекулы. 2. Ионная, ковалентная, металлическая. 3. Ковалентная неполярная связь – это связь между атомами с одинаковой электроотрицательностью. Каточка 3. 1.Степень окисления - это характеристика способности атомов химического элемента отдавать и принимать электроны. 2.Валентность - это способность атома данного химического элемента образовывать определенное число химических связей с атомами других элементов. 3. Римскими. | Познавательные: умение подведить под понятие, выводить следствия; выбор оснований и критериев для сравнения. Коммуникативные: контроль действий партнёра, умение с достаточной полнотой и правильностью оценивать работу другого человека. Регулятивные: прогнозирование результата усвоения предстоящей темы на основе имеющихся знаний. Личностные: мотивация учения |
| 4 | Первичное усвоение новых знаний | Ребята, давайте все посмотрим на ПСХЭ. - Скажите, в каком периоде, и какой группе находится водород? - Правильно. Сейчас мы разберемся, почему же водород находится в 2-х группах сразу. - Всё дело в том, что атом водорода имеет на своём одном энергетическом уровне 1 электрон. Ребята, как я это определила? Вызываю к доске ученика, чтобы он расписал строение атома водорода. - Всё верно. Таким образом, если исходить из числа валентных электронов его атома, то водород должен находиться в ⅠА группе. - Запишите строение атома водорода к себе в тетрадь. - Но мы с вами знаем, что состояние устойчивости атома соответствует скольки электронам на внешнем энергетическом уровне? - Правильно. Если же исходить из того, что для завершения внешнего энергетического слоя атому водорода не хватает одного электрона, его следует поместить в седьмую группу. Ведь именно в ⅦА группе находятся элементы, которым не хватает 1-го электрона до устойчивого состояния атома. - Таким образом, мы с вами ответили на вопрос, почему водород в ПСХЭ находится в 2-х группах одновременно. - А сейчас ответьте мне, какова валентность водорода? - Как вы определили валентность водорода? - Всё верно. Запишите себе в тетрадь, что валентность водорода равна Ⅰ. - Каковы могут быть степени окисления водорода? -Правильно. Но кроме того, в таких соединениях как гидриды, у водорода степень окисления равна -1. Запишите это себе в тетради и пометьте как важное. А также ниже запишите, что такое гидриды. Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами. Вызываю к доске ребёнка. -Напишите молекулярную формулу гидрида кальция, гидрида калия, гидрид бария, гидрид кремния, гидрид углерода (метан), гидрид азота (аммиак). Вызываю другого ребёнка проверить, правильно ли написал формулы гидридов его одноклассник. Ставлю им оценки. - Теперь давайте сравним водород с соседними по группе и периоду элементами. Давайте вместе составим и запишем таблицу, в которой отразим сходство водорода с щелочными металлами и с галогенами. Вызываю двух ребят к доске для составления таблицы. - Один из вас будет описывать сходство с металлами, а другой с галогенами. -Спасибо, присаживайтесь. - Далее мы с вами рассмотрим кристаллическую решётку водорода. Кто помнит, что такое кристаллическая решётка? Какие виды кристаллических решёток вы знаете? - Правильно. Если рассматривать водород как простое вещество, то мы знаем, что это молекула, состоящая из 2-х атомов. Следовательно, у водорода молекулярная кристаллическая решётка. Запишите это к себе в тетради. - Мы с вами в начале урока вспомнили, что такое химическая связь и её виды. Скажите, какая связь связывает атомы в молекуле водорода и почему? - Правильно, молодцы. Давайте запишем механизм образования связи в молекуле водорода. Вызываю одного ребёнка к доске для записи механизма образования связи. Параллельно задаю вопросы классу. - Какие 2 механизма образования ковалентной связи выделяют? - Верно. (вопрос ребёнку у доски) Какой же механизм действует в данном случае? - Правильно. Присаживайтесь. Пишу на доске. - Сейчас сделайте в своих тетрадях подзаголовок «физические свойства водорода». Теперь по пунктам пишем. Агрегатное состояние: газ. Цвет: бесцветный. Запах: без запаха. Вкус: без вкуса. Растворимость в воде: практически не растворим. Температура плавления: -259,10 Температура кипения: - 2530. В 14,5 раз легче воздуха. - Сейчас, мы переходим к химическим свойствам водорода. Нам известно, что водород проявляет двойственную природу, т.е. может вести себя как окислитель и как восстановитель. Давайте запишем следующую схему. 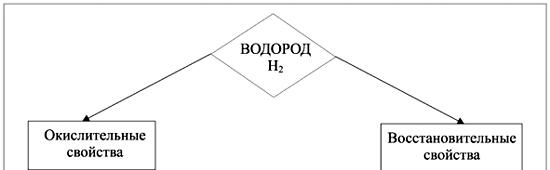
Вызываю к доске 2-х детей, написать примеры реакций, где водород восстановитель, и где окислитель. - Разберём взаимодействие водорода с простыми веществами. Вызываю по одному ребёнку на каждую реакцию. - С галогенами водород образует галогеноводороды. Пример, мы уже записали, когда писали реакцию, где водород проявлял восстановительные свойства. - Примером реакции с кислородом служит реакция образования воды. Запишите её, пожалуйста. Смесь 2 объемов Н2 и 1 объема О2 называется гремучим газом. Он очень взрывоопасен! Отметьте это у себя в тетради. - Кроме того, водород реагирует с серой, азотом, углеродом. Запишем эти реакции. - При взаимодействии с щелочными и щелочноземельными металлами образует гидриды. Запишем реакцию взаимодействия водорода и лития.
- Отметьте себе в тетрадях, что водород не реагирует с фосфором, кремнием, благородными газами! - Теперь, сделайте себе подзаголовок «Взаимодействие водорода со сложными веществами». Будем записывать по пунктам. Вызываю на каждый пример учащегося к доске для записи. - Водород не реагирует с оксидами металлов, находящихся в ряду активности металлов до алюминия (включительно), но способен восстанавливать многие оксиды металлов правее алюминия, при нагревании. Как пример, запишите реакцию взаимодействия оксида меди (Ⅱ) с водородом. А также запишите реакцию взаимодействия оксида магния с водородом и перечеркните стрелку, так как Mg находится в ряду активности левее алюминия и его оксид не реагирует с водородом. - Далее запишем, что из оксидов неметаллов водород реагирует при нагревании с оксидами азота, галогенов и углерода. Реакцию с углеродом записываю сама. CO + 2H2 CH3OH – метанол (метиловый спирт). - Запишите, что с неорганическими кислотами водород не реагирует! - Теперь запишите, что при пропускании водорода над твёрдыми солями некоторых металлов средней и низкой активности, возможно, их частичное или полное восстановление. Запишем пример взаимодействия хлорида меди с водородом. - Молодцы, присаживайтесь. - Сейчас возьмите все схемы, которые лежат у вас на столах. В них вы видите способы получения водорода. Прошу одного ученика прочитать способы получения. - Эту схему вам нужно будет дома вклеить в свои тетради ниже сегодняшних записей. 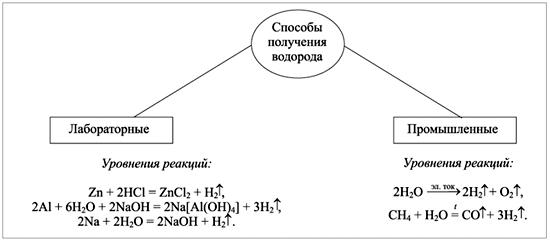
- Также у вас на столах есть схема применения водорода. Её, вы также вклеите в свои тетради. На следующем уроке я проверю, чтоб у всех были вклеены в тетрадях обе схемы. 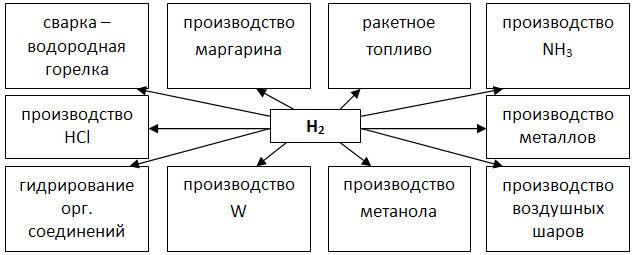
| Дети отвечают на вопрос о положении водорода в ПСХЭ. - Водород находится в 1 периоде ⅠА группе. Кроме того водород находится 1 периоде ⅦА группе. Дети отвечают на вопрос о строении атома водорода. - Количество энергетических уровней атома элемента определяет номер периода, в котором он находится, а число электронов на внешнем энергетическом уровне определяется по номеру группы. Так как водород находится в 1 периоде, значит, он имеет 1 энергетический уровень. Водород находится в ⅠА группе, значит на последнем и единственном энергетическом уровне находится 1 электрон. Ребёнок у доски расписывает строение атома водорода. Дети отвечают на вопрос. - Для устойчивого состояния атома, на внешнем энергетическом уровне должно быть или 2 или 8 электронов. Дети отвечают на вопрос о валентности. - У водорода валентность равна Ⅰ. - Валентность равна числу неспаренных электронов на внешнем уровне атома. У водорода 1 неспаренный электрон на внешнем энергетическом уровне. Дети отвечают на вопрос о степени окисления. - У водорода постоянная степень окисления +1.Кроме того, у водорода может быть степень окисления 0, когда водород в виде простого вещества. Дети записывают в тетради понятие «гидриды» и помечают, что степень окисления водорода в них равна -1. Ребёнок у доски пишет формулы гидридов и поясняет степени окисления элементов в них и расстановку индексов. - Ca+2H-12 - , K+1H-1, Ba+2H-12 , Si+4H-14, C+4H-14, N+3H-13. Следующий ребёнок проверяет формулы гидридов. Дети сравнивают водород с щелочными металлами и галогенами. Записывают таблицу в тетради. | Сходство водорода со щелочными металлами | Сходство водорода с галогенами | | Водород, подобно щелочным металлам, имеет на внешнем и единственном энергетическом уровне один электрон. Он может его легко отдавать, проявляя восстановительные свойства и приобретая степень окисления +1, характерную для всех щелочных металлов. Водород, как и щелочные металлы, имеет валентность Ⅰ. | Водороду для заполнения внешнего энергетического уровня, как и галогенам, не хватает лишь одного электрона, который он может принять и получить характерную для галогенов степень окисления –1. Более того, водород с галогенами сближают и физические характеристики – это газ, молекула которого образована ковалентной неполярной химической связью, а не металлической | Дети отвечают понятие кристаллической решётки. - Кристаллическая решётка – это пространственное периодическое расположение атомов или ионов в кристалле. Кристаллические решётки бывают: молекулярные, атомные, ионные и металлические. Записывают в тетради вид кристаллической решётки водорода. - В молекуле водорода ковалентная неполярная связь. Потому что молекула образована двумя одинаковыми атомами с одинаковой электроотрицательностью. Ребёнок записывает: 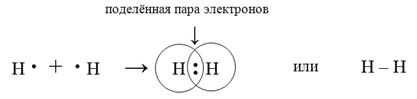
- Выделяют донорно-акцепторный и обменный механизмы образования ковалентной связи. Ребёнок у доски отвечает - В данном случае действует обменный механизм, так как оба атома дают по одному электрону на образование общей электронной пары. Дети записывают в тетради физические свойства водорода. Дети записывают в тетради схему. 2-е ребят записывают примеры реакций. Водород – окислитель. K0 + H02 = K+1H-1 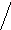 K0 – 1 e- K+1 2 - восстановитель K0 – 1 e- K+1 2 - восстановитель
H02 + 2 e- 2H- 1 - окислитель Водород – восстановитель. 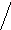 H02 + 2Cl0 2H+1Cl-1 H02 + 2Cl0 2H+1Cl-1
H02 – 2 e- 2H+1 1 - восстановитель Cl0 + 1 e- Cl-1 2 - окислитель Дети записывают в тетрадях химические свойства по пунктам. У доски дети пишут примеры реакций. 2Н2 + О2 → 2Н2О Н2 + S → H2S ЗН2 + N2 → 2NН3 2Н2 + С → СН4 Н2 + 2Li → 2LiH Дети записывают химические свойства водорода при взаимодействии со сложными веществами. Ребята у доски пишут примеры реакций. CuO + H2 Cu + H2O  MgO + H2 MgO + H2
H2 +3N2O3 2HNO3 + 4NO H2 + 2Cl 2HCl CuCl2 + H2 Cu + 2HCl Дети просматривают схему получения и применения водорода. Слушают читающего одноклассника и читают про себя. Вкладывают схемы в тетради. | Коммуникативные: определение способов взаимодействия людей вокруг. Регулятивные: определение последовательности промежуточных целей с учётом конечного результата; выделение и осознание учащимися того, что уже освоено и, что ещё подлежит усвоению, осознание качества и уровня усвоения. Познавательные: установление причинно-следственных связей; переработка и применение получаемой информации; формирование умения извлекать информацию из схем, таблиц |
| 6 | Самостоятельная работа | Делю класс на 2 варианта. Раздаю карточки по вариантам. - Эту работу вы выполняете на отдельных листочках, которые сдадите мне на проверку и получите оценки. На эту работу у вас есть 5 минут. Карточка 1-го варианта. 1. Укажите состав молекулы водорода:
а) Н2
б) Н2О
в) Н3 2. Водород в промышленности получают:
а) действием раствора щелочи на алюминий
б) действием соляной кислоты на цинк
в) конверсией природного газа + 3. Окислительные свойства водорода проявляются при взаимодействии с:
а) кислородом
б) азотом
в) натрием 4. Укажите валентность водорода в соединениях:
а) 2
б) 1
в) 3 5. Восстановительные свойства водород проявляет при:
а) растворении в воде
б) взаимодействии с металлами
в) взаимодействии с кислородом 6. Самый распространенный химический элемент во Вселенной:
а) водород
б) кислород
в) натрий 7. В лаборатории водород проще получить при взаимодействии некоторых металлов с:
а) водой
б) кислотами
в) кислородом 8. Водород выделяется при взаимодействии активных металлов с:
а) водой
б) гелием
в) кислородом 9. Водород в 14,5 раз легче, чем:
а) гелий
б) воздух
в) кислород 10. Взрывчатая смесь, состоящая из 2-ух объёмов водорода и 1-го объёма кислорода:
а) восстановление металлов
б) сероводород
в) гремучий газ Карточка 2-го варианта 1. Водород реагирует с металлами с образованием:
а) метанола
б) аммиака
в) гидридов + 2. Какой звук характеризует наличие чистого водорода в пробирке:
а) свист
б) хлопок +
в) стук 3. 1-й химический элемент периодической системы:
а) магний
б) водород +
в) кислород 4.В химических реакциях водород может: а) только окисляться; б) только восстанавливаться; в) окисляться или восстанавливаться; г) не окисляется и не восстанавливается. 5. В химических реакциях с типичными металлами водород проявляет свойства: а) окислителя; б) восстановителя; в) и окислителя, и восстановителя; г) ни окислителя, ни восстановителя. 6. С какими из веществ водород не реагирует? а) кремний б) алюминий в) гелий 7. Агрегатное состояние водорода: а) твердое веществ б) газ в) жидкость 8. С каким из веществ водород не взаимодействует? а)Na б)SiH4 в)S 9. Степень окисления –1 водород проявляет в соединении а) H2О б) NH4Cl в) MgН2 г) NH3 10. Степень окисления + 1 водород проявляет в соединении а) CaH2 б) H2 в) NaH г) Н2S -Итак, 5 минут прошло, сдаём работы. Собираю листочки. | Дети получают карточки. Записывают на отдельных листах фамилию, класс, вариант и решают тест. Вариант 1 (ответы) 1. а 2. в 3. в 4. б 5. в 6. а 7. б 8. а 9. б 10. в Вариант 2 (ответы) 1. в 2. б 3. в 4. в 5. а 6. а, в 7. б 8. б 9. в 10. г По истечению времени, дети сдают работы.
| Познавательные: выбор наиболее эффективных способов решения задач в зависимости от конкретных условий; контроль и оценка процесса и результатов деятельности. |











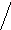 K0 – 1 e- K+1 2 - восстановитель
K0 – 1 e- K+1 2 - восстановитель MgO + H2
MgO + H2 
















