
Физические и химические свойства оксидов

Цель урока
В вести понятие об оксидах; познакомить с важнейшими неорганическими классами; рассмотреть состав, названия, классификацию и физические свойства оксидов.

Определение
Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Названия оксидов, в состав которых входят химические элементы с постоянной валентностью, даются без упоминания о валентности. Например: MgO – оксид магния.
Если же они образованы химическими элементами с переменной валентностью, то рядом с названием оксида ставится в скобках валентность. Например: SO 2 – оксид серы (IV), SO 3 – оксид серы (VI).
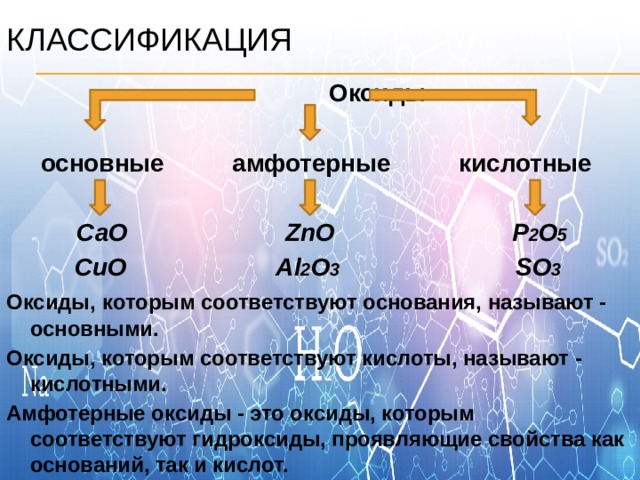
Классификация
Оксиды
основные амфотерные кислотные
СаО ZnO P 2 O 5
CuO Al 2 O 3 SO 3
Оксиды, которым соответствуют основания, называют - основными.
Оксиды, которым соответствуют кислоты, называют - кислотными.
Амфотерные оксиды - это оксиды, которым соответствуют гидроксиды, проявляющие свойства как оснований, так и кислот.
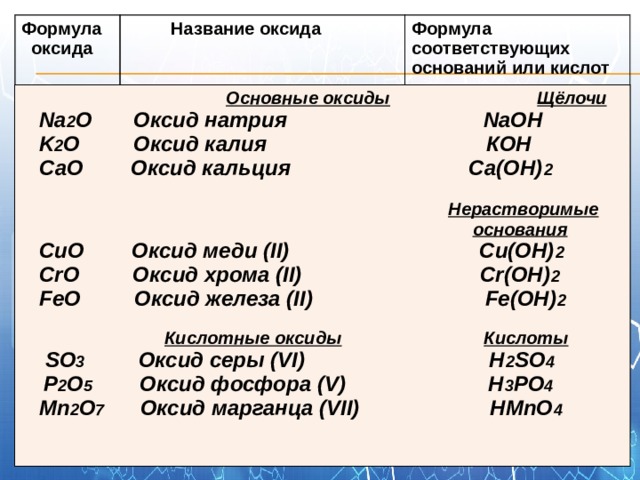
Формула
оксида
Название оксида
Формула соответствующих оснований или кислот
Основные оксиды Щёлочи
Na 2 O Оксид натрия NaOH
K 2 O Оксид калия КОН
СаО Оксид кальция Са(ОН) 2
Нерастворимые
основания
СuO Оксид меди (II) Cu(OH) 2
CrO Оксид хрома (II) Cr(OH) 2
FeO Оксид железа (II) Fe(OH) 2
Кислотные оксиды Кислоты
SO 3 Оксид серы (VI) H 2 SO 4
P 2 O 5 Оксид фосфора (V) H 3 PO 4
Mn 2 O 7 Оксид марганца (VII) HMnO 4
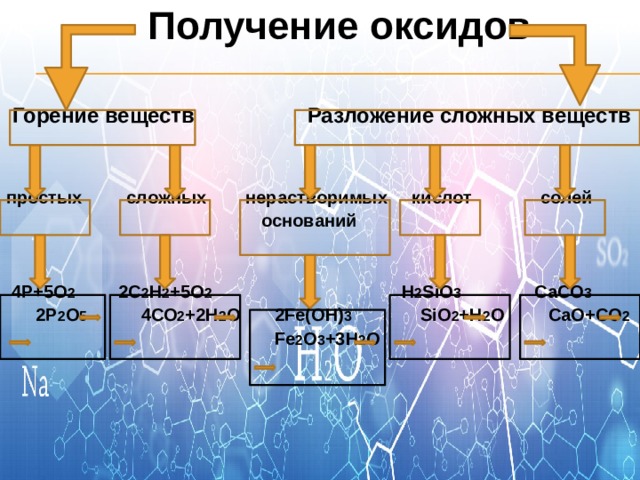
Получение оксидов
Горение веществ Разложение сложных веществ
простых сложных нерастворимых кислот солей
оснований
4Р+5О 2 2С 2 Н 2 +5О 2 H 2 SiO 3 CaCO 3
2Р 2 О 5 4СО 2 +2Н 2 О 2Fe(OH) 3 SiO 2 +H 2 O CaO+CO 2
Fe 2 O 3 +3H 2 O
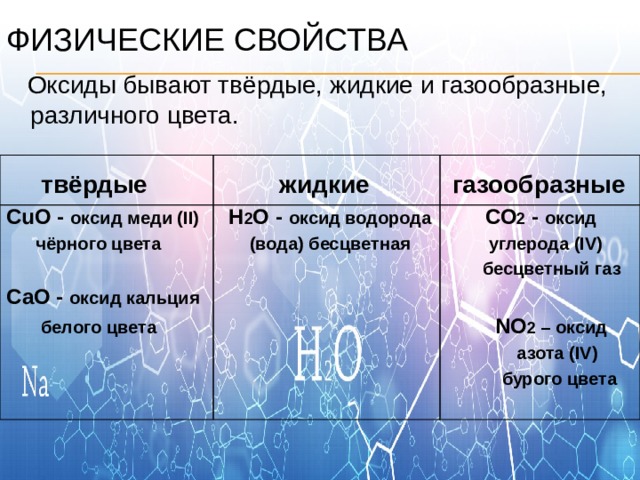
Физические свойства
Оксиды бывают твёрдые, жидкие и газообразные, различного цвета.
твёрдые жидкие газообразные
СuO - оксид меди (II) Н 2 О - оксид водорода СО 2 - оксид
чёрного цвета (вода) бесцветная углерода (IV)
бесцветный газ
СаО - оксид кальция
белого цвета NO 2 – оксид
азота (IV)
бурого цвета

Химические свойства оксидов
основных
кислотных
1). Основные оксиды взаимодействуют с кислотами, получаются соль и вода:
t
1). Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода:
CuO + H 2 SO 4 CuSO 4 + H 2 O
СO 2 + Ca(OH) 2 CaCO 3 + H 2 O
2). Оксиды активных металлов взаимодействуют с водой с образованием щёлочи:
2). Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты:
Li 2 O + H 2 O 2 LiOH
Р 2 О 5 + 3 Н 2 О 2 Н 3 РО 4
3). Основные и кислотные оксиды взаимодействуют между собой с
образованием соли:
СаО + СО 2 СаСО 3
4). Менее летучие кислотные оксиды вытесняют более летучие из их солей:
СaCO 3 + SiO 2 CaSiO 3 + CO 2

Применение
- Н 2 О – оксид водорода (вода) – в промышленности и в быту.
- SiO 2 – оксид кремния (IV) – в производстве строительных материалов.
- СаО – оксид кальция – для получения гашёной извести Са(ОН) 2
- Из руд, состоящих из оксидов железа Fe 2 O 3 и Fe 3 O 4 получают чугун и сталь.
- ZnO – оксид цинка – основная часть белой краски – цинковых белил.

Закрепление материала
FeCl 3,Na 2 O,NaOH,ZnO,CaO,MgCl 2,BaO,NO,HCl, Ca(OH) 2,Fe 2 O 3,SO 3
- Составьте формулы оксидов элементов
Магния, Калия, Алюминия, Фосфора ( V ),
Хлора ( VII ),Железа ( III ),Углерода ( IV ),Серы ( VI )

Домашнее задание
- Прочитать параграф 40
- Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
NaOH, AlCl 3 , K 2 O, H 2 SO 4 , SO 3 , P 2 O 5 , HNO 3 , CaO, CO.
2. Даны вещества: CaO, NaOH, CO 2 , H 2 SO 3 , CaCl 2 , FeCl 3 , Zn(OH) 2 , N 2 O 5 , Al 2 O 3 , Ca(OH) 2 , CO 2 , N 2 O, FeO,SO 3 , Na 2 SO 4 , ZnO, CaCO 3 , Mn 2 O 7 , CuO, KOH, CO, Fe(OH) 3
Выпишите оксиды и классифицируйте их.

Спасибо за внимание!






































