
Тема урока: «Свойства концентрированной азотной кислоты »

Блиц-опрос.
- 1.Степень окисления атома азота в азотной кислоте -
- 2.Валентность атома азота в азотной кислоте –
- 3.В молекуле азотной кислоты связь –
- 4. 3 – 10% - раствор аммиака называется –
- 5. Аммиак при нормальных условиях – это …
- 6. Ион аммония образуется по … механизму.
- 7. Оксид азота (II) является – … оксидом.
- 8. При окислении оксида азота (II) образуется …
- 9. Оксид азота (IV) – это …
- 10. Оксид азота (IV) является – … оксидом.

Помощник №1
- Шкала оценивания: каждый правильный ответ оценивается в – 0.5 балла.
- 1.Степень окисления атома азота в азотной кислоте - + 5.
- 2.Валентность атома азота в азотной кислоте – IV.
- 3.В молекуле азотной кислоты связь – ковалентная полярная.
- 4. 3 – 10% - раствор аммиака называется – нашатырным спиртом.
- 5. Аммиак при нормальных условиях – это бесцветный газ с характерным запахом.
- 6. Ион аммония образуется по донорно - акцепторному механизму .
- 7. Оксид азота (II) является – несолеобразующим оксидом.
- 8. При окислении оксида азота (II) образуется оксид азота(IV ).
- 9. Оксид азота (IV) – это бурый ядовитый газ с характерным удушливым запахом.
- 10. Оксид азота (IV) является – кислотным оксидом .

Цель урока:
- продолжить изучение азотной кислоты, рассмотреть химические свойства концентрированной азотной кислоты.

Задачи урока:
Образовательные :
1) расширить представления учащихся об азотной кислоте;
2) продолжить формирование умений записывать уравнения реакций, характеризующих свойства азотной кислоты.
Развивающие :
1) способствовать продолжению развития устойчивого интереса к химической науке;
2) применять полученные знания на практике и оценивать результаты выполненных действий;
3) совершенствовать умения обобщать и делать выводы.
Воспитательные :
1)воспитывать положительное отношение к знаниям, инициативность, способность преодолевать трудности для достижения цели;
2)формировать у каждого учащегося умения работать в группах, навыки взаимопроверки и взаимоконтроля.
 t и чем c (HNO 3 ), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т.к. в ней растворен оксид азота(IV). " width="640"
t и чем c (HNO 3 ), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т.к. в ней растворен оксид азота(IV). " width="640"
Свойства концентрированной азотной кислоты
1. Разложение при нагревании и под действием света
4HNO 3 (конц.)= 4NO 2 + O 2 + 2H 2 O
Чем t и чем c (HNO 3 ), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т.к. в ней растворен оксид азота(IV).
 c (HNO 3 ) – NO 2 . S + 2HNO3 (40%) = H2SO4 + 2NO↑ S + 6HNO3 (60%) = H2SO4 + 6NO2↑ + 2H2O 3P + 5HNO3(30%) + 2H2O = 3H3PO4 +5NO↑ P + 5HNO3(60%) = H3PO4 + 5NO2↑ + H2O Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO 2. C +4HNO 3 (конц.) = CO 2 + 2H 2 O + 4NO 2 " width="640"
c (HNO 3 ) – NO 2 . S + 2HNO3 (40%) = H2SO4 + 2NO↑ S + 6HNO3 (60%) = H2SO4 + 6NO2↑ + 2H2O 3P + 5HNO3(30%) + 2H2O = 3H3PO4 +5NO↑ P + 5HNO3(60%) = H3PO4 + 5NO2↑ + H2O Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO 2. C +4HNO 3 (конц.) = CO 2 + 2H 2 O + 4NO 2 " width="640"
2 . Окислительные свойства концентрированной азотной кислоты:
а) окисление неметаллов
При 3 ) – NO , при c (HNO 3 ) – NO 2 .
S + 2HNO3 (40%) = H2SO4 + 2NO↑
S + 6HNO3 (60%) = H2SO4 + 6NO2↑ + 2H2O
3P + 5HNO3(30%) + 2H2O = 3H3PO4 +5NO↑
P + 5HNO3(60%) = H3PO4 + 5NO2↑ + H2O
Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO 2.
C +4HNO 3 (конц.) = CO 2 + 2H 2 O + 4NO 2

б) окисление сложных веществ
Иногда при окислении выделяется так много тепла, что окисляющееся вещество загорается само собой, без предварительного подогревания.
Например: скипидар, бумага, солома, древесные опилки в концентрированной азотной кислоте самовоспламеняются.
3.Взаимодействие с белками.
При взаимодействии концентрированной азотной кислоты с белками образуются вещества ярко – желтого цвета.
При работе с концентрированной азотной кислотой необходимо соблюдать крайнюю осторожность: не допускать ее попадания на кожу и одежду! В случае попадания кислоты на кожу смыть большим количеством проточной воды и обработать 2 % раствором соды

4. Взаимодействие с металлами
а) с щелочными и щелочно – земельными металлами образуется
Me(NO 3 )n + N 2 O + H 2 O ,например:
4Ca + 10HNO 3 (конц.) = 4Ca(NO 3 ) 2 + N 2 O +5 H 2 O;
б) с Fe,Cr,Al,Au,Pt,Ta, Rh,Ir не взаимодействует;
в) с другими тяжелыми металлами образуется
Me(NO 3 )n + NO 2 + H 2 O, например:
Cu + 4HNO 3 (конц.) = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O.

Физкультминутка
Чтобы голова не болела,
Ей вращаем вправо-влево. (Вращение головой)
А теперь руками крутим –
И для них разминка будет. ( Вращение прямых рук вперед и назад)
Тянем наши ручки к небу,
В стороны разводим. (Потягивания – руки вверх и в стороны)
Повороты вправо-влево
Плавно производим. (Повороты туловища влево и вправо)
Наклоняемся легко,
Достаем руками пол. ( Наклоны вперед)
Потянули плечи, спинки,
А теперь конец разминке. (Дети садятся)

Обобщающее закрепление
Общая закономерность при взаимодействии азотной кислоты с металлами: чем больше разбавлена кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение увеличение
концентрации активности
кислоты металла
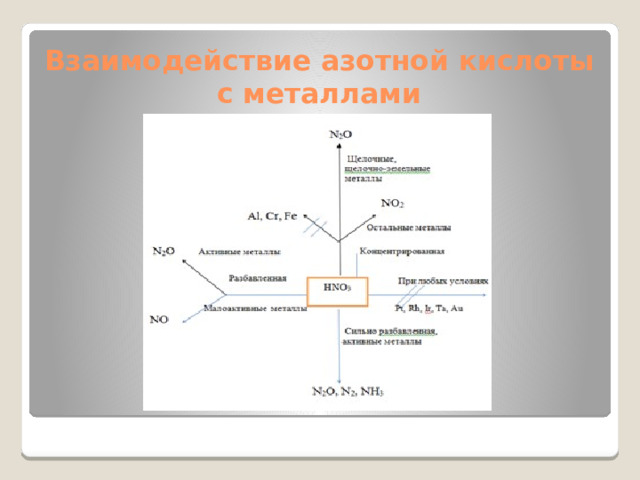
Взаимодействие азотной кислоты с металлами

Помощник №2
а)3Ag 0 +4HN +5 O 3 (разб.) =3Ag + NO 3 + N +2 O + 2H 2 O
Ag 0 -1e –Ag + , 3 , окисляется, восстановитель
N +5 +3e – N +2 , 1 , восстанавливается, окислитель
б)Ag 0 +2HN +5 O 3 (конц.) =Ag + NO 3 + N +4 O 2 +H 2 O
Ag 0 -1e – Ag + ,1 , окисляется, восстановитель
N +5 +1e – N +4 , 1 , восстанавливается, окислитель

Домашнее задание
- Изучите материал § 27 учебника, выполните тестовые задания в конце параграфа. Используя электронное приложение, ознакомьтесь с видеофрагментами к параграфу

Рефлексия
1.На уроке вы узнали что-то новое?
2.Вы поняли новую тему?
3.На все возникшие у вас вопросы вы получили ответы?
4.По новой теме вам нужна дополнительная консультация?
5.На уроке вы поработали добросовестно?












 t и чем c (HNO 3 ), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т.к. в ней растворен оксид азота(IV). " width="640"
t и чем c (HNO 3 ), тем быстрее идет разложение. Концентрированная азотная кислота всегда окрашена в желтоватый цвет, т.к. в ней растворен оксид азота(IV). " width="640"
 c (HNO 3 ) – NO 2 . S + 2HNO3 (40%) = H2SO4 + 2NO↑ S + 6HNO3 (60%) = H2SO4 + 6NO2↑ + 2H2O 3P + 5HNO3(30%) + 2H2O = 3H3PO4 +5NO↑ P + 5HNO3(60%) = H3PO4 + 5NO2↑ + H2O Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO 2. C +4HNO 3 (конц.) = CO 2 + 2H 2 O + 4NO 2 " width="640"
c (HNO 3 ) – NO 2 . S + 2HNO3 (40%) = H2SO4 + 2NO↑ S + 6HNO3 (60%) = H2SO4 + 6NO2↑ + 2H2O 3P + 5HNO3(30%) + 2H2O = 3H3PO4 +5NO↑ P + 5HNO3(60%) = H3PO4 + 5NO2↑ + H2O Тлеющий уголек, погруженный в концентрированную азотную кислоту, не только не гаснет, а ярко разгорается, разлагая кислоту с образованием NO 2. C +4HNO 3 (конц.) = CO 2 + 2H 2 O + 4NO 2 " width="640"


























