«Строение электронных оболочек атомов.»
__________________________________
Цель урока:
| 1. Обучающая: | Обобщение знаний о строении атома Ввести понятия «электронное облако», « электронная орбиталь», «движение без траектории». Рассмотреть модель энергетических состояний атома Научить школьников записывать электронные конфигурации атомов элементов I-IV периодов. |
| 2. Развивающие: | -продолжить развивать внимание , речь, логическое мышление -сформировать у учащихся личностную мотивацию, познавательный интерес к данной теме;
- развить интеллектуальные и творческие способности учащихся, диалектическое мышление;
-углубить знания о взаимосвязи строения атома и структурой ПСХЭ;
|
| 3.Воспитательная: | -привить интерес к химии, используя дифференцированное обучение, а также формировать умение общаться, развивать навыки взаимопомощи, самоутверждения, самооценки, развить познавательный интерес к устройству окружающего мира.
|
Задачи урока:
Научиться составлять электронные формулы атомов,
определять элементы по их электронным формулам,
определять состав атома.
Оборудование:
Карточки с дифференцированными заданиями,
Мини тест,
Карточка- строение атома
Презентация урока.
Портреты Э.Резерфорда, Дж.Дж. Томсона, Дж.Чедвика
Периодическая таблица Менделеева
Мультимедийный проектор, ноутбук, экран.
Тип урока.
Объяснение нового материала.
Ход урока.
Организационный момент.
Проверка домашнего задания.
Фронтальный опрос, проверка домашнего задания.
1.Вспомните определение атома.
2.Назовите элементарные частицы, образующие атом,
3.Охарактеризуйте их заряд и массу.
4. Напишите обозначения частиц.
5. Какие элементарные частицы образуют ядро атома?
6. Как определить число протонов и нейтронов, электронов.
. 7. Докажите, что атом — электронейтральная система
8. Дайте определение понятия «изотопы
1. Предложил название «электрон»
1) Стони 2) Томпсон
3) Беккерель 4) Резерфорд
2. Предложил планетарную модель атома
1) Стони 2) Томпсон
3)Беккерель 4) Резёрфорд
3. Число электронов в атоме натрия равно
1)23 2)12 3)34 4)11
4. Число нейтронов в атоме 39К равно
1)39 2)58 3)26 4)20
5. Атомы какого химического элемента имеют в своем составе
5 протонов, 6 нейтронов, 5 электронов
а) углерода, б) натрия, в) бора, г) неона/
6.Число протонов в атоме кислорода равно:
1)8 2) 9 3)10 4)11
7. Атомы какого химического элемента имеют в своем составе 7 протонов, 7 нейтронов, 7 электронов
электронов
а) углерода, б) натрия, в)азот, г) фтор.
8..Число нейтронов, протонов электронов в атоме 39 Ar равно
1)22 18 18 2)21 18 18 3)26 18 17 4)20 19 18
Выберите правильный ответ. ( карточка 1)
III. Объяснение нового материала
Учитель:
В начале ХХв. была принята планетарная модель строения атома, согласно которой вокруг ядра движутся электроны, как планеты вокруг солнца. Следовательно, в атоме есть траектории, по которым движется электрон. Однако дальнейшие исследования показали, что в атоме не существует траекторий движения электронов. Движение без траектории означает, что мы не знаем, как электрон движется в атоме, но можем установить область, где чаще всего встречается электрон. Это уже не орбита, а орбиталь.
Давайте выясним, как движутся электроны вокруг ядра? Беспорядочно или в определенном порядке?
Исследования Нильса Бора — основоположника современной атомной физики, а также ряда других ученых позволили сделать вывод: электроны в атомах располагаются определенными слоями — оболочками и в определенном порядке.
Электроны в атоме различаются определенной энергией, и, как показывают опыты, одни притягиваются к ядру сильнее, другие слабее. Объясняется это удаленностью электронов от ядра. Чем ближе электроны к ядру, тем больше связь их с ядром, но меньше запас энергии. По мере удаления от ядра атома сила притяжения электрона к ядру уменьшается, а запас энергии увеличивается. Так образуются электронные слои в электронной оболочке атома.
Каждый слой состоит из электронов с близкими значениями энергии, поэтому слои электронов называют энергетическими уровнями. Энергия электронов в атоме и энергетический уровень определяется главным квантовым числом n и принимает целочисленные значения 1, 2, 3, 4…Чем больше значение n, тем больше энергия электрона в атоме.
(Карточка 2)
4.Число энергетических уровней определяется номером периода ХЭ в ПСХЭ.
7. Максимальное число электронов, которое может находиться на том или ином энергетическом уровне, определяется по формуле:
N = 2n2
Где N- максимальное число электронов на уровне;
n – номер энергетического уровня.
| Энергетический уровень | 1 | 2 | 3 | 4 |
| Максимальное число электронов | 2 | 8 | 18 | 32 |
Установлено
что на первой электронной оболочке располагается не более
2-х электронов,
на второй — не более 8,
на третьей — не более 18,
на четвертой — не более 32.
Заполнение более далеких оболочек мы рассматривать не будем.
Известно, что на внешнем энергетическом уровне может находиться не более восьми электронов, его называют завершенным. Электронные слои, не содержащие максимального числа электронов, называют незавершенными.
6.Число электронов на внешнем энергетическом уровне электронной оболочки атома равно номеру группы для химических элементов главных подгрупп.
Согласно современной (квантовомеханической) модели атома энергетические уровни 9.состоят из подуровней. Число подуровней, которые образуют конкретный уровень, равно его номеру.
Подуровни обозначают буквами s, p, d, f.
| Номер энергетического уровня | Подуровни энергии |
| 1 | s, p (два подуровня) |
| 2 | s (один подуровень) |
| 3 | s, p, d (три подуровня) |
| 4 | s, p, d, f (четыре подуровня) |
.
Орбитали, или подуровни, как их еще называют, могут иметь разную форму, и их количество соответствует номеру уровня, но не превышает четырех. Первый энергетический уровень имеет один подуровень (s),
Второй - два (s,p),
третий – три (s,p,d) и т.д.
Электроны разных подуровней одного и того же уровня имеют разную форму
электронного облака: сферическую (s), гантелеобразную (p) и более сложную конфигурацию.
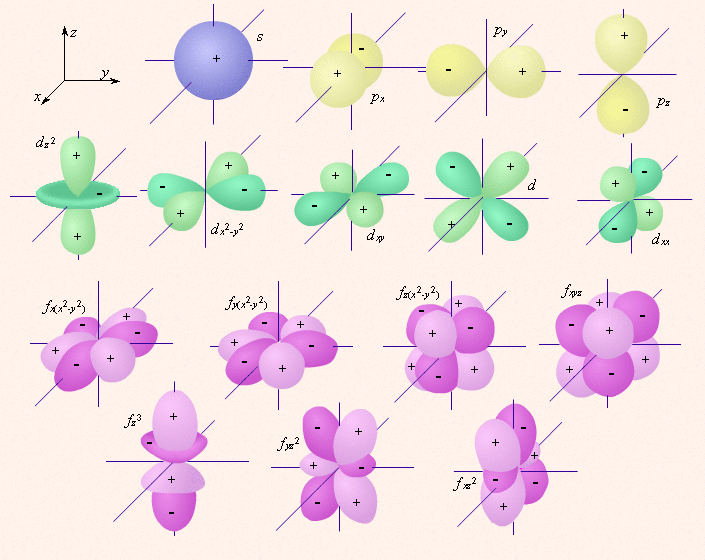 Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
Чем больше энергия электрона в атоме, тем быстрее он вращается, тем сильнее вытягивается область его пребывания, и наконец, превращается в гантелеобразную p-орбиталь:
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. Это легко объяснимо: ведь все электроны заряжены отрицательно, поэтому электронные облака взаимно отталкиваются и стремятся разместиться как можно дальше друг от друга.
Итак, p-орбиталей может быть три. Энергия их, конечно, одинакова, а расположение в пространстве - разное. Составить схему последовательного заполнения электронами энергетических уровней.


 2 е 8 е 18 е
2 е 8 е 18 е
n=1 n=2 n=3






S S P S P d





 2 е 2 е 6 е 2 е 6 е 10 е
2 е 2 е 6 е 2 е 6 е 10 е
(Карточка 3)
Теперь мы можем составить схему строения электронных оболочек атомов:
Определяем общее число электронов на оболочке по порядковому номеру элемента.
Определяем число энергетических уровней в электронной оболочке. Их число равно номеру периода в таблице Д. И. Менделеева, в котором находится элемент.
Определяем число электронов на каждом энергетическом уровне.
Используя для обозначения уровня арабские цифры и обозначая орбитали буквами s и p, а число электронов данной орбитали арабской цифрой вверху справа над буквой, изображаем строение атомов более полными электронными формулами. Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой - квадратиком на энергетической диаграмме:
На s-подуровне может находиться одна атомная орбиталь 

а на p-подуровне их может быть уже три -
(в соответствии с тремя осями координат):
Орбиталей d- и f-подуровня в атоме может быть уже пять и семь соответственно:


Пример:
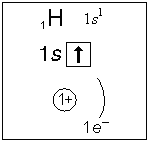
Ядро атома водорода имеет заряд +1, поэтому вокруг его ядра движется только один электрон на единственном энергетическом уровне. Запишем электронную конфигурацию атома водорода (слайд №3).
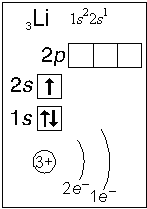
Элемент № 3- литий. Ядро лития имеет заряд +3,следовательно, в атоме лития три электрона. Два из них находятся на первом энергетическом уровне, а третий электрон начинает заполнять второй энергетический уровень. Сначала заполняется s-орбиталь первого уровня, потом s-орбиталь второго уровня (слайд №5).
III. Закрепление нового материала.
Задание для класса:
:
. 1. Изобразите строение атома следующего элемента._______________________
(элемент третье группы )
2. По данным о распределении валентных электронов найдите элемент:
а) 2s1
б) 2s22p4
в) 3s23p6
г) 3d104s1
д) 4s24p3
е) 4s24p5
ж) 3s23p4
IV. Итоги урока.
Давайте подведем итоги урока. Что мы сегодня узнали нового?
Электрон не имеет траектории и движение его происходит по орбитали.
По схеме последовательного заполнения электронами энергетических уровней научились составлять электронные формулы элементов.
Научились по электронным формулам определять химический элемент.
V. Домашнее задание: § 8, Стр. 28-30.
Нарисуйте схемы строения электронных оболочек атомов:
хлора, натрия, неона, углерода.
3 Дифференцированные карточка
по теме
«Строение электронных оболочек атомов».
Химический элемент -
Задания.
1.Запишим знак химического элемента, внизу укажем порядковый номер. ________________________________________________________________________________
2.Как произносится химический символ ______________________________________________
3.Определите количество
p+________________________________________________________
e-________________________________________________________
по порядковому номеру элемента.
4. Определите число энергетических уровней в электронной оболочке по номеру периода.
________________________________________________________________________________
5. Нарисовать рядом со знаком химического элемента столько же дуг.
6. Определим по номеру группы число электронов на внешнем энергетическом уровне, запишем его под последней дугой.
7. Определите число электронов на оставшихся энергетических уровнях,
( на 1-м – не более двух,
на 2-м – не больше восьми, на третьем не больше -18.) Ставим эти числа под соответствующими дугами.
8.Схема строения атома готова.
________________________________________________________________________________
9. Определите количество подуровней на вашем уровне.
Подуровни обозначают буквами s, p, d, f.
| Номер энергетического уровня | Подуровни энергии |
| 1 | s (один подуровень) |
| 2 | s, p (два подуровня) |
| 3 | s, p, d (три подуровня) |
| 4 | s, p, d, f (четыре подуровня) |
10.
Далее превращаем схему в формулу: каждая дуга-уровень, обозначается большой цифрой 1,2,3,4; подуровни обозначаются буквами s,p,d,f, а число электронов на них верхними индексами (см. таблицу).
11.Внешний уровень можно представить электронно-графической формулой, на которой каждая орбиталь показана клеткой, а электроны – стрелками. На одной орбитали не может находиться более двух электронов, так как они отталкиваются друг от друга.
12. 1. Изобразите строение атома следующего элемента._______________________
(элемент третье группы )







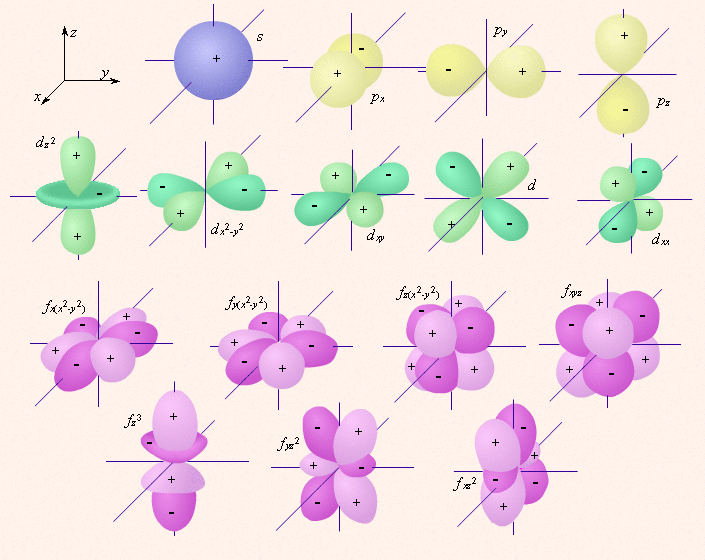 Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.
Сферическую атомную орбиталь ученые договорились называть s-орбиталью. Она самая устойчивая и располагается довольно близко к ядру.