Тема: Строение атома. Планетная модель атома. Типы оптических спектров. Квантовый характер поглощения и испускания света атомами. Линейные спектры.
Цель: Описать строения атома и его планетарную модель. Рассмотреть типы оптических спектров и квантовый характер поглощения и испускания света атомами.
Ход урока:
1. Оргмомент. Постановка цели и задач урока.
2. Проверка знаний. Выполнение теста «Закон Кулона. Напряженность»
 3. Изучение нового материала.
3. Изучение нового материала.
1. СТРОЕНИЕ АТОМА.
Атом— частица вещества микроскопических размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств. Атомы состоят из ядра и электронов (точнее, электронного «облака»). Ядро атома состоит из протонов и нейтронов. Количество нейтронов в ядре может быть разным: от нуля до нескольких десятков. Если число электронов совпадает с числом протонов в ядре, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. В некоторых случаях под атомами понимают только электронейтральные системы, в которых заряд ядра равен суммарному заряду электронов, тем самым противопоставляя их электрически заряженным ионам.
Д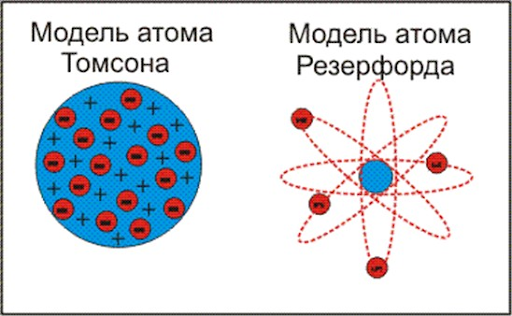 ж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
ж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
Ранняя планетарная модель атома Нагаоки. В 1904 году японский физик Хантаро Нагаока предложил модель атома, построенную по аналогии с планетой Сатурн. В этой модели вокруг маленького положительного ядра по орбитам вращались электроны, объединённые в кольца. Модель оказалась ошибочной.
Планетарная модель атома Бора-Резерфорда. В 1911 году Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие с классической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении с центростремительным ускорением должен излучать электромагнитные волны, а, следовательно, терять энергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомов Нильсу Бору пришлось ввести постулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Необходимость введения постулатов Бора была следствием осознания того, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданию квантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
2. Типы спектров
Спектры отличаются большим разнообразием. Различают спектры излучения (испускания) и спектры поглощения. Спектры излучения могут быть сплошными и линейчатыми.
Сплошной (непрерывный) спектр излучения состоит из всех спектральных цветов, непрерывно переходящих друг в друга.

Его создают вещества в твёрдом и жидком состоянии, разогретые до высокой температуры, например расплавленный металл, накалённая нить электрической лампы. Если рассматривать через спектроскоп почти бесцветное пламя газовой горелки, то мы увидим слабый сплошной спектр. Это значит, что твёрдые частицы раскалённого угля, присутствующие в газовом пламени, излучают волны всех частот. Сплошной спектр дают также светящиеся газы и пары, находящиеся под очень высоким давлением (т. е. если силы взаимодействия между их молекулами достаточно велики).
Линейчатый спектр излучения состоит из отдельных спектральных линий, каждой из которых соответствует определённая длина волны. Его излучают вещества, находящиеся в атомарном газообразном состоянии. Для получения линейчатого спектра исследуемое вещество нужно перевести в газообразное состояние и нагреть до высокой температуры.
Пример:
если внести в пламя газовой горелки кусочек поваренной соли, то пламя окрасится в жёлтый цвет, а в спектре, наблюдаемом с помощью спектроскопа, будут видны две близко расположенные жёлтые линии, характерные для спектра паров натрия.

Это означает, что под действием высокой температуры молекулы NaCl распались на атомы натрия и хлора. Свечение атомов хлора возбудить гораздо труднее, чем свечение атомов натрия, поэтому в данном спектре линии хлора не видны.
Каждому химическому элементу присущ свой спектр излучения.
Спектры поглощения получают, пропуская белый свет через исследуемое вещество. Линейчатые спектры поглощения дают газы малой плотности, состоящие из изолированных атомов, когда сквозь них проходит свет от яркого и более горячего (по сравнению с температурой самих газов) источника, дающего непрерывный спектр.
Пример:
если пропустить белый свет через сосуд с парами натрия, то на фоне сплошного спектра появится узкая чёрная линия. Это означает, что излучение с определённой длиной волны поглощается парами натрия.

Тёмная линия поглощения расположена как раз там, где находится линия спектра излучения светящегося пара натрия. Аналогичное явление наблюдается и для других элементов.
Общий для всех химических элементов закон, согласно которому
атомы данного элемента поглощают световые волны тех же самых частот, на которых они излучают,
был открыт в середине XIX в. немецким физиком Густавом Кирхгофом.






 3. Изучение нового материала.
3. Изучение нового материала. ж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.
ж. Дж. Томсон предложил рассматривать атом как некоторое положительно заряженное тело с заключёнными внутри него электронами. Была окончательно опровергнута Резерфордом после проведённого им знаменитого опыта по рассеиванию альфа-частиц.



















