

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Современные технологии и их применение на уроках химии.
Применение технологий на уроках химии. это работа, где показываются методы обучения дтей на основе педагогических технологий.
Просмотр содержимого документа
«Современные технологии и их применение на уроках химии.»
Автономная некоммерческая организация дополнительного образования
«Сибирский институт непрерывного дополнительного образования»
Современные педагогические технологии
и их применение в практике учителя химии.
Выпускная аттестационная работа
по программе профессиональной переподготовки
«Профессиональное образование: учитель химии».
Слушатель:
Щенникова Светлана Викторовна.
Руководитель:
Агалакова Елена Анатольевна,
кандидат педагогических наук, доцент
Омск-2015
Оглавление
Введение ________________________________________________________________________3
Глава 1. Современные педагогические технологии______________________ 6 1.1. Информационно – коммуникационная технология__________________________________________6 1.2. Уровневая дифференциация обучения на основе обязательных результатов. (В.В. Фирсов)_______9 1.3. Технология на основе личностной ориентации педагогического процесса______________________14 1.4 Игровые технологии _____________________________________________________________________19 1.5 Технология интегрированного обучения_____________________________________________________23 Глава 2. Применение современных педагогических технологий на уроках химии_____________________________________________________26 2.1. Технологии компьютерного обучения_____________________________________________________27 2.2. Уровневая дифференциация обучения_____________________________________________________31 2.3 Педагогика сотрудничества_______________________________________________________________ 34 2.4 Игровые технологии______________________________________________________________________ 36 2.5 Технология интегрированного обучения____________________________________________________39
Заключение______________________________________________________________________43
Список использованных источников и литературы_______________________ 47
Приложения ___________________________________________________________48
Введение
Особенность федеральных государственных образовательных стандартов общего образования - их деятельный характер, который ставит главной задачей развитие личности ученика. Современное образование отказывается от традиционного представления результатов обучения в виде знаний, умений и навыков.
Формулировки ФГОС указывают на реальные виды деятельности.
Поставленная задача требует внедрение в современную школу системно-деятельного подхода к организации образовательного процесса, который, в свою очередь, связан с принципиальными изменениями деятельности учителя, реализующего новый стандарт. Также изменяются и технологии обучения.
В общем случае технология понимается как система методов, осуществляемых в каком-либо процессе.
Что же такое педагогическая технология?
Педагогическая технология — это система теоретически обоснованных принципов и правил, а также соответствующих им приемов и методов эффективного достижения педагогом целей обучения, воспитания и развития школьников.
• Совокупность приёмов – область педагогического знания, отражающего характеристики глубинных процессов педагогической деятельности, особенности их взаимодействия, управление которыми обеспечивает необходимую эффективность учебно-воспитательного процесса;
• Совокупность форм, методов, приёмов и средств передачи социального опыта, а также техническое оснащение этого процесса;
• Совокупность способов организации учебно-познавательного процесса или последовательность определённых действий, операций, связанных с конкретной деятельностью учителя и направленных на достижение поставленных целей (технологическая цепочка).
Ученикам окончившим школу необходимо адаптироваться в сложном современном мире: им нужны не только полученные знания, но и умения их находить самим, ощущать себя компетентными людьми в любой области, творчески мыслящими, чтобы успешно утвердиться в жизни, в этом заключается цель применения новых технологий.
В этих условиях традиционная школа, реализующая классическую модель образования, стала непродуктивной, построенные на объяснительно-иллюстративном способе обучения. При использовании данной технологии учитель основное внимание в своей работе отводит трансляции готового учебного содержания. При этом преподнесение учащимся информации, определенной рамками программы, практически всегда происходит в форме монолога учителя. В связи с этим в учебном процессе возникает много проблем, главными из них являются низкий уровень навыков общения, невозможность получить развернутый ответ ученика с его собственной оценкой рассматриваемого вопроса, недостаточное включение слушающих ответ школьников в общее обсуждение. Корень этих проблем лежит не в настрое детей, не в их «пассивности», а в процедуре, которую задает применяемая технология. Объяснительно-иллюстративные технологии предписывают учителю особую роль и место в учебном процессе. У него на уроке не просто активная, но сверх доминирующая позиция: он командир, судья, но при этом обременен угнетающим чувством ответственности за все, что происходит в классе. Соответственно, ученик играет пассивную роль, которая сводится к соблюдению тишины и строгому выполнению предписаний учителя, при этом ученик ни за что не отвечает. Новые жизненные условия, в которые поставлены все мы, выдвигают свои требования.
Передо мной, как и перед моими коллегами, возникла задача – превратить традиционное обучение, направленное на накопление знаний, умений, навыков, в процесс развития личности ребенка. Новые технологии обучения не отбрасывают преподнесение информации ученикам. Просто меняется роль информации. Она необходима не только для запоминания и усвоения, сколько для того, чтобы ученики использовали ее в качестве условий или среды для создания собственного творческого продукта. Общеизвестно, что личность развивается только в процессе собственной деятельности
Уход от традиционного урока через использование в процессе обучения новых технологий позволяет устранить однообразие образовательной среды и монотонность учебного процесса, создать условия для смены видов деятельности обучающихся, позволит реализовать принципы здоровьесбережения.
Современных педагогических технологии акцентируются на воспитании подлинно свободной личности, формировании у детей способности самостоятельно мыслить, добывать и применять знания, тщательно обдумывать принимаемые решения и чётко планировать действия, эффективно сотрудничать в разнообразных по составу и профилю группах, быть открытыми для новых контактов и культурных связей. Это требует широкого внедрения в образовательный процесс альтернативных форм и способов ведения образовательной деятельности.
Рекомендуется осуществлять выбор технологии в зависимости от предметного содержания, целей урока, уровня подготовленности обучающихся, возможности удовлетворения их образовательных запросов, возрастной категории обучающихся.
В условиях реализации требований ФГОС наиболее актуальными становяся технологии:
Информационно – коммуникационная технология
Технология развития критического мышления
Проектная технология
Технология развивающего обучения
Здоровьесберегающие технологии
Технология проблемного обучения
Игровые технологии
Модульная технология
Технология мастерских
Технология интегрированного обучения
Педагогика сотрудничества. Технологии уровневой дифференциации.
Глава 1. Современные педагогические технологии
Я хочу остановиться на характеристиках, тех технологий, которые более часто я применяю на уроках химии.
1. Информационно – коммуникационная технологияЛюбая педагогическая технология – это информационная технология так
как, основу технологического процесса обучения составляет получение и преобразование информации.
Компьютерные (новые информационные) технологии обучения – это
процесс подготовки и передачи информации обучаемого, средством осуществления которых является компьютер.
При подготовке к уроку с использованием ИКТ учитель не должен забывать, что это урок, а значит составляет план урока исходя из его целей при отборе учебного материала он должен соблюдать основные дидактические принципы: систематичности и последовательности, доступности, научности и др.
При этом компьютер не заменяет учителя, а только дополняет его.
Такому уроку свойственно следующее:
1.-принцип адаптивности: приспособление компьютера к индивидуальным особенностям ребенка.
2. -управляемость: в любой момент возможна корректировка учителем процесса обучения.
3. -интерактивность и диалоговый характер обучения: ИКТ обладает способностью «откликаться» на действие ученика и учителя, комфорта при общении с компьютером.»вступать « с ними в диалог, что и составляет главную особенность методик компьютерного обучения.
4.- оптимальное сочетание индивидуальной и групповой работы.
5. -поддержание у ученика состояния психологического комфорта при общении с компьютером.
6.-неограниченное обучение: содержание, его интерпретации и приложение сколько угодно велики.
Компьютер может использоваться на всех этапах процесса обучения:
при объяснении (введении) нового материала, закреплении, повторении, контроле ЗУН
При этом компьютер выполняет следующие функции:
1. в функции учителя компьютер представляет собой:
источник учебной информации;
наглядное пособие;
тренажер;
средство диагностики и контроля.
2. в функции рабочего инструмента:
средство подготовки текстов, их хранение;
графический редактор;
средство подготовки выступлений;
вычислительная машина больших возможностей.
1. индивидуализация обучения;
2. интенсификация самостоятельной работы учащихся;
3. рост объема выполненных на уроке заданий;
4. возможность получения различного рода материалов через сеть Интернет и использование специальных дисков.
5. повышение познавательной активности и мотивации усвоения знаний за счет разнообразия форм работы, возможности включения игрового момента. Компьютер дает учителю новые возможности, позволяя вместе с учеником получать удовольствие от увлекательного процесса познания, не только силой воображения раздвигая стены школьного кабинета, но с помощью новейших технологий позволяет погрузиться в яркий красочный мир. Такое занятие вызывает у детей эмоциональный подъем, даже отстающие ученики охотно работают с компьютером.
6. интегрирование обычного урока с компьютером позволяет учителю переложить часть своей работы на ПК, делая при этом процесс обучения более интересным, разнообразным, интенсивным.
7. этот метод обучения очень привлекателен и для учителей: помогает им лучше оценить способности и знания ребенка, понять его, побуждает искать новые, нетрадиционные формы и методы обучения, стимулирует его профессиональный рост и все дальнейшее освоение компьютера.
8. Применение на уроке компьютерных тестов и диагностических комплексов позволит учителю за короткое время получать объективную картину уровня усвоения изучаемого материала у всех учащихся и своевременно его скорректировать. При этом есть возможность выбора уровня трудности задания для конкретного ученика
9. Для ученика важно то, что сразу после выполнения теста (когда эта информация еще не потеряла свою актуальность) он получает объективный результат с указанием ошибок, что невозможно, например, при устном опросе.
10. Освоение учащимися современных информационных технологий.
Но, наряду с плюсами, возникают различные проблемы как при подготовке к таким урокам, так и во время их проведения.
Существующие недостатки и проблемы применения ИКТ1. Нет компьютера в домашнем пользовании многих учащихся
2. У учителей недостаточно времени для подготовки к уроку, на котором используются компьютеры.
3. Недостаточная компьютерная грамотность учителя.
4. В рабочем графике учителей не отведено время для исследования возможностей Интернет.
5. Сложно интегрировать компьютер в поурочную структуру занятий.
6. Не хватает компьютерного времени на всех.
7. В школьном расписании не предусмотрено время для использования Интернет на уроках.
8. При недостаточной мотивации к работе учащиеся часто отвлекаются на игры, музыку, проверку характеристик ПК и т.п.
9. Существует вероятность, что, увлекшись применением ИКТ на уроках, учитель перейдет от развивающего обучения к наглядно-иллюстративным методам.
В данной технологии, уровневой дифференциации обучения является явное введение в дополнение к уровню преподавания, базового уровня обязательной общеобразовательной подготовки, или уровня обязательных требований (в педагогической литературе его иногда называют также стандартом образования). Базовый уровень определяет и задает так называемые обязательные результаты обучения (сокращенно ОРО), которые должны быть достигнуты всеми учащимися.
Важнейшие функции базового уровня связаны с тем, что он, по определению, задает нижнюю границу результата полноценного и качественного школьного образования. Возможность ограничиться этим уровнем при изучении нелюбимых или трудных предметов, обеспечивая достаточные пределы их усвоения, одновременно является действенным фактором ликвидации перегрузки школьника. С другой стороны, только освободив ученика от непосильной суммарной учебной нагрузки, мы сможем направить его усилия в область склонностей и интересов, способствуя развитию ребенка, формированию положительной мотивации учения. Тем самым идея государственного уровня обязательной общеобразовательной подготовки диалектически соотносится со стремлением к максимально полному раскрытию способностей детей. Таким образом, обязательные результаты обучения становятся основой для дифференциации и индивидуализации требований к учащимся. А это в свою очередь, создает реальную и прочную базу для перехода от авторитарной педагогики, к педагогике сотрудничества ученика и учителя, к реализации идеи педагогического договора по отношению к обязательному базовому уровню обучения.
Но самое главное, что ориентация на посильные и доступные абсолютному большинству учащихся обязательные результаты обучения дает ученику возможность на каждом уроке испытывать учебный успех. Из неуспевающего или посредственного ученика (ведь по сравнению с "идеальным образцом усвоения", оцениваемым пятеркой, все плохо!) ребенок имеет реальную, обеспеченную методически, возможность стать человеком, достойным уважения; человеком, удовлетворяющим государственным требованиям; добросовестным тружеником.
требования базового уровня.
Базовый уровень нельзя представлять в виде "суммы знаний", предназначенных для изучения в школе. Ведь существенно не столько то, что изучалось, сколько то, что реально усвоено школьником. Поэтому его следует описывать в терминах планируемых результатов обучения, доступных проверке и контролю за их достижением.
Обязательность базового уровня для всех учащихся в условиях гуманного обучения означает, что совокупность планируемых обязательных результатов обучения должна быть реально выполнима, т.е. посильна и доступна абсолютному большинству школьников.
При демократической организации учебного процесса обязательность базового уровня, кроме того, означает, что вся система планируемых обязательных результатов должна быть заранее известна и понятна школьнику.
Базовый уровень должен быть задан по возможности однозначно, в форме, не допускающей разночтений, двусмысленностей и т.д.
Будучи основным рабочим механизмом новой технологии обучения, базовый уровень должен обеспечивать ее гибкость и адаптивность; возможности для эволюционного развития.
Фактически предлагается введение двух стандартов:
стандарта для обучения (уровень, который должна обеспечить школа интересующемуся, способному и трудолюбивому выпускнику)
и стандарта обязательной общеобразовательной подготовки (уровень, которого должен достичь каждый).
Пространство между уровнями обязательной и повышенной подготовки должно быть заполнено своеобразной "лестницей" деятельности (Н. Н. Решетников), добровольное восхождение по которой от обязательного к повышенным уровням способно реально обеспечить школьнику постоянное пребывание в зоне ближайшего развития обучение на индивидуальном максимально посильном уровне. Таким образом создаются предпосылки для диалектического разрешения извечной дилеммы прав и обязанностей ученика в обучении: школьник обязан удовлетворить государственным требованиям уровня обязательной подготовки и имеет право (естественно, подкрепленное возможностями) двигаться дальше. Налицо психологически понятная детям ситуация договора, способствующая добровольному включению школьника в сотрудничество с учителем.
Оценивание знаний.
Существенной особенностью технологии уровневой дифференциации обучения является ее органичная связь с системой контроля результатов учебного процесса и системы оценивания достижений школьников. Альтернативой способу "вычитания" является "оценка методом сложения", в основу которой кладется минимальный уровень общеобразовательной подготовки, достижение которого требуется в обязательном порядке от каждого учащегося. Критерии более высоких уровней строятся на базе минимального посредством содержательного приращения по глубине или объему усвоения.
Контроль выполнения заданий обязательного уровня осуществляется в форме зачетов, являющихся необходимым элементом технологии.
Целевые ориентации.
1. Обучение каждого на уровне его возможностей и способностей.
2. Приспособление обучения к особенностям различных групп учащихся.
Предусматривается:
- тематический контроль;
- полнота проверки обязательного уровня подготовки ;
- открытость образцов проверочных заданий обязательного уровня ;
- оценка методом сложения (общий зачет – сумма частных зачетов) ;
- двоичность в оценке обязательного уровня (зачет – незачет);
- повышенные оценки за достижения сверх базового уровня ;
- «закрытие» пробелов (до сдача, а не пересдача);
- возможность «дробных» зачетов;
- кумулятивность итоговой оценки (годовая оценка вытекает из всех полученных).
Зачеты проводятся в учебное время, при этом:
- предусматривается резерв времени для доработки;
- возможна помощь учителя во время зачета;
- учащимся даются «ключи» к проверочным знаниям;
- на каждого ведется лист учета и контроля;
- в случае, если учащийся претендует на оценки «4» и «5» , итоговый контроль предусматривает экзамен «на подтверждение» по всему материалу. Эффективная организация обучения невозможна без использования индивидуально-дифференцированного подхода к ученикам. Учителю необходимо учитывать познавательные интересы всех учащихся, развивать каждого в меру его сил и способностей.
Формы использования в образовательном процессе:
Взаимообучение и взаимоконтроль в условиях работы пар.
Работа с разно уровневыми тестами.
Выполнение практических заданий разного уровня.
Творческие групповые задания для подготовки к семинарам и деловым играм, урокам-конкурсам.
Зачет по проверке базовых знаний в различных формах
Вполне очевидно, что в процессе внедрения технологии уровневой дифференциации главная роль принадлежит учителю. Проходя через творческое сознание педагога, через его личный опыт и преобразуя этот опыт, идеи уровневой дифференциации обучения приобретают живое воплощение. Обеспечив методически новую технологию, учитель обязательно увидит ее плюсы, подтвердит ожидаемые позитивные результаты.
Технология уровневой дифференциации обучения направлена на непосредственную реализацию образовательных стандартов в учебном процессе, на «выращивание» и адаптацию стандартов к ученику и к школе. Тем самым она призвана внести весомый вклад в модернизацию образования, а значит, имеет полное право быть востребованной педагогами.
3.Технология на основе личностной ориентации педагогического процесса
Педагогика сотрудничества является одной из наиболее всеобъемлющих педагогических обобщений 80-х годов, вызвавших к жизни многочисленные инновационные процессы в образовании.
Название технологии было дано группой педагогов-новаторов, в обобщенном опыте которых соединились лучшие традиции советской школы (Н.К.Крупская, С.Т.Шацкий, В.А.Сухомлинский, А.С.Макаренко), достижения русской (К.Д.Ушинский, Н.П.Пирогов, Л.Н.Толстой) и зарубежной (Ж.Ж.Руссо, Я.Корчак, К.Роджерс, Э.Берн) психолого-педагогической практики и науки.
Педагогика сотрудничества имеет следующие классификационные характеристики:
По уровню применения: общепедагогическая.
По философской основе: гуманистическая.
По основному фактору развития: комплексная: био-, социои психогенная.
По ориентации на личностные структуры: всесторонне гармоническая.
По характеру содержания: обучающая + воспитательная, светская, гуманистическая, общеобразовательная, проникающая.
По типу управления: система малых групп.
По организационным формам: академическая + клубная, индивидуальная + групповая, дифференцированная.
По подходу к ребенку: гуманно-личностная, субъект-субъектная (сотрудничество).
По преобладающему методу: проблемно-поисковая, творческая, диалогическая, игровая.
По категории обучаемых: массовая (все категории).
Целевые ориентации.
Переход от педагогики требований к педагогике отношений. Гуманно-личностный подход к ребенку. Единство обучения и воспитания.
Концепция сотрудничества.
В «Концепции среднего образования Российской Федерации» сотрудничество трактуется как идея совместной развивающей деятельности взрослых и детей, скрепленной взаимопониманием, проникновением в духовный мир друг друга, совместным анализом хода и результатов этой деятельности.
Как система отношений сотрудничество многоаспектно; но важнейшее место в нем занимают отношения «учитель - ученик».
Поэтому два субъекта одного процесса должны действовать вместе, быть сотоварищами, партнерами, составлять союз более старшего и опытного с менее опытным (но обладающим преимуществами молодости); ни один из них не должен стоять над другим.
Сотрудничество в отношениях «ученик - ученик» реализуется в общей жизнедеятельности школьных коллективов, принимая различные формы (содружества, соучастия, сопереживания, сотворчества, соуправления).
В педагогике сотрудничества выделяются четыре направления:
Гуманно-личностный подход к ребенку.
Дидактический активизирующий и развивающий комплекс.
Концепция воспитания.
Педагогизация окружающей среды.
1.Гуманно-личностный подход.
Гуманно-личностный подход ставит в центр школьной образовательной системы развитие всей целостной совокупности качеств личности.
Цель школы - разбудить, вызвать к жизни эти внутренние силы и возможности, использовать их для более полного и свободного развития личности. Гуманно-личностный подход объединяет следующие идеи:
- новый взгляд на личность как цель образования, личностную направленность учебно-воспитательного процесса;
- гуманизацию и демократизацию педагогических отношений;
- отказ от прямого принуждения как метода, не дающего результатов в современных условиях;
- новую трактовку индивидуального подхода; формирование положительной
Я-концепции.
Новый взгляд на личность представляют следующие позиции:
- личность проявляется, выступает в раннем детстве, ребенок в школе - полноценная человеческая личность;
- личность является субъектом, а не объектом в педагогическом процессе;
- личность - цель образовательной системы, а не средство для достижения каких-либо внешних целей;
- каждый ребенок обладает способностями, многие дети талантливы;
- приоритетными качествами личности являются высшие этические ценности (доброта, любовь, трудолюбие, совесть, достоинство, гражданственность и др.).
Гуманное отношение к детям включает:
- педагогическую любовь к детям, заинтересованность в их судьбе;
- оптимистическую веру в ребенка; сотрудничество, мастерство общения;
- отсутствие прямого принуждения; приоритет положительного стимулирования;
- терпимость к детским недостаткам.
Демократизация отношений утверждает:
- уравнивание ученика и учителя в правах;
- право ребенка на свободный выбор;
- право на ошибку; право на собственную точку зрения;
-соблюдение Конвенции о правах ребенка;
- стиль отношений учителя и учеников: не запрещать, а направлять; не управлять, а соуправлять; не принуждать, а убеждать; не командовать, а организовывать; не ограничивать, а предоставлять свободу выбора.
Ученье без принуждения характеризует:
- требовательность без принуждения, основанная на доверии;
- увлеченность, рожденная интересным преподаванием;
- замена принуждения желанием, которое порождает успех; ставка на самостоятельность и самодеятельность детей;
- применение косвенных требований через коллектив.
Новая трактовка индивидуального подхода включает:
- отказ от ориентировки на среднего ученика;
- поиск лучших качеств личности;
- применение психолого-педагогической диагностики личности (интересы, способности, направленность, Я-концепция, качества характера, особенности мыслительных процессов);
- учет особенностей личности в учебно-воспитательном процессе;
- прогнозирование развития личности; конструирование индивидуальных программ развития, его коррекция.
В школьные годы Я-концепция - основа внутреннего стимулирующего механизма личности. Положительная, мажорная Я-концепция (Я нравлюсь, Я способен, Я значу) способствует успеху, эффективной деятельности, положительным проявлениям личности.
2.Дидактический активизирующий и развивающий комплекс педагогики сотрудничества
-открывает новые принципиальные подходы и тенденции в решении вопросов «чему» и «как» учить сегодня детей:
- содержание обучения рассматривается как средство развития личности, а не как самодовлеющая цель школы;
- обучение ведется прежде всего обобщенным знаниям, умениям и навыкам и способам мышления;
- идет объединение, интеграция школьных дисциплин;
- вариативность и дифференциация обучения;
- используется положительная стимуляция ученья.
3.Концепция воспитания.
Концептуальные положения педагогики сотрудничества отражают важнейшие тенденции, по которым развивается воспитание в современной школе:
-превращение школы Знания в школу Воспитания;
- постановка личности школьника в центр всей воспитательной системы;
- гуманистическая ориентация воспитания, формирование общечеловеческих ценностей;
- развитие творческих способностей ребенка, его индивидуальности;
- возрождение русских национальных и культурных традиций;
- сочетание индивидуального и коллективного воспитания;
- постановка трудной цели.
4.Педагогизация окружающей среды .
Педагогика сотрудничества ставит школу в ведущее, ответственное положение по отношению к остальным институтам воспитания, деятельность которых должна быть рассмотрена и организована с позиций педагогической целесообразности.
Важнейшими социальными институтами, формирующими подрастающую личность, являются школа, семья и социальное окружение (среда). Результаты (личность выпускника) определяются совместным действием всех трех источников воспитания. Поэтому на первый план выдвигаются идеи компетентного управления, сотрудничества с родителями, влияния на общественные и государственные институты защиты детства, их общая забота о подрастающем поколении - будущем всей страны.
4. Игровые технологии
«Игра-это возможность отыскать себя в обществе,
себя в человечестве, себя во Вселенной»
Я.Корчак.
Игра – одно из замечательных явлений жизни, деятельность как будто бесполезная и вместе с тем необходимая. Невольно чаруя и привлекая к себе как жизненное явление, игра оказалась весьма серьезной и трудной проблемой для научной мысли. Игра наряду с трудом и ученьем - один из основных видов деятельности человека, удивительный феномен нашего существования. По определению,
игра - это вид деятельности в условиях ситуаций, направленных на воссоздание и усвоение общественного опыта, в котором складывается и совершенствуется самоуправление поведением.
В человеческой практике игровая деятельность выполняет такие функции:- развлекательную (это основная функция игры - развлечь, доставить удовольствие, воодушевить, пробудить интерес);
- коммуникативную: освоение диалектики общения;
- самореализации в игре как полигоне человеческой практики;
- игротерапевтическую: преодоление различных трудностей, возникающих в других видах жизнедеятельности;
- диагностическую: выявление отклонений от нормативного поведения, самопознание в процессе игры;
- функцию коррекции: внесение позитивных изменений в структуру личностных показателей;
- межнациональной коммуникации: усвоение единых для всех людей социально-культурных ценностей;
- социализации: включение в систему общественных отношений, усвоение норм человеческого общежития
Понятие «игровые педагогические технологии» включает достаточно обширную группу методов и приемов организации педагогического процесса в форме различных педагогических игр.
В отличие от игр вообще педагогическая игра обладает существенным признаком — чётко поставленной целью обучения и соответствующими ей педагогическими результатами, которые могут быть обоснованы, выделены в явном виде и характеризуются учебно-познавательной направленностью.
Игровая форма занятий создаётся на уроках при помощи игровых приёмов и ситуаций, которые выступают как средство побуждения, стимулирования учащихся к учебной деятельности.
Реализация игровых приёмов и ситуаций при урочной форме занятий происходит по таким основным направлениям:
-дидактическая цель ставится перед учащимися в форме игровой задачи;
- учебная деятельность подчиняется правилам игры;
учебный материал используется в качестве её средства.
-в учебную деятельность вводится элемент соревнования, который переводит дидактическую задачу в игровую;
-успешное выполнение дидактического задания связывается с игровым результатом.
По характеру педагогического процесса выделяются следующие группы игр:
а) обучающие, тренировочные, контролирующие и обобщающие;
б) познавательные, воспитательные, развивающие;
в) репродуктивные, продуктивные, творческие;
г) коммуникативные, диагностические, профориентационные, психотехнические.
Концептуальные основы игровых технологий
Психологические механизмы игровой деятельности опираются на фундаментальные потребности личности в самовыражении, самоутверждении, самоопределении, саморегуляции, самореализации.
• Игра - форма психогенного поведения, т.е. внутренне присущего, имманентного личности (Д.Н.Узнадзе).
• Игра - пространство "внутренней социализации" ребенка, средство усвоения социальных установок (Л.С.Выготский).
• Игра - свобода личности в воображении, "иллюзорная реализация нереализуемых интересов" (А.Н.Леонтъев).
• Способность включаться в игру не связана с возрастом человека, но в каждом возрасте игра имеет свои особенности.
• Содержание детских игр развивается от игр, в которых основным содержанием является предметная деятельность, к играм, отражающим отношения между людьми, и, наконец, к играм, в которых главным содержанием выступает подчинение правилам общественного поведения и отношения между людьми.
• В возрастной периодизации детей (Д.Б.Эльконин) особая роль отведена ведущей деятельности, имеющей для каждого возраста свое содержание. В каждой ведущей деятельности возникают и формируются соответствующие психические новообразования. Игра является ведущим видом деятельности для дошкольного возраста.
Особенности игровых технологий
Все следующие за дошкольным возрастные периоды со своими ведущими видами деятельности (младший школьный возраст - учебная деятельность, средний -общественно полезная, старший школьный возраст - учебно-профессиональная деятельность) не вытесняют игру, а продолжают включать ее в процесс
Игровые технологии в среднем и старшем школьном возрасте. В подростковом возрасте наблюдается обострение потребности в создании своего собственного мира, в стремлении к взрослости, бурное развитие воображения, фантазии, появление стихийных групповых игр. Особенностями игры в старшем школьном возрасте является нацеленность на самоутверждение перед обществом, юмористическая окраска, стремление к розыгрышу, ориентация на речевую деятельность.
5. Технология интегрированного обучения
Все науки настолько связаны между собою,
что легче изучать их все сразу,
нежели какую-либо одну из них в отдельности от всех прочих.
Р. Декарт
Термин «интеграция», означающий «объединение, соединение, суммирование». Ведущим принципом развития современных образовательных систем становится принцип интеграции. Сущностью этого принципа является понимание условности строгого деления естественнонаучного и гуманитарного знания на отдельные образовательные области, стремление к созданию синтетических, интегрированных систем знаний, дающих школьникам представление о целостной картине мира.
Объектами интеграции в учебном познании могут выступать:
виды знаний, система научных понятий; законы, теории, идеи; модели объективных процессов.
С позиций развития личности интеграция создает условия для:
• выхода на более высокий уровень осмысления; • совершенствования индивидуально-личностного аппарата познания; • развития свободы мышления; • формирования креативности учащихся.
В настоящее время в российском образовании имеют место следующие
концепции и технологии интеграции на базе общего образования:
– интеграция содержания образования, уменьшение многопредметности, укрупнение образовательных областей (концепция В.В. Серикова);
– генерализация содержания учебных предметов (концепция внутрипредметной интеграции – В.И. Загвязинский);
– укрупнение дидактических единиц (П.М. Эрдниев);
– технологии интегрирования учебных предметов (физика + химия – А.И. Гуревич);
– объединение в одних пространственно-временных координатах различных технологий, методов, приемов (концепция синтеза дидактических систем – Л.А. Артемьева, В.В. Гаврилюк, М.И. Махмутов);
– соединение в единое целое воспитания и обучения, обучения и труда, усилий школы и общества (концепция интеграции воспитательных сил общества – В.В. Семенов);
– экологическое образование, гармонизация системы «природа – человек»;
– глобальное образование;
– гражданское образование. Наконец, интегральными являются новые информационные (компьютерные) технологии.
Интегрированный урок – особый тип урока, на котором изучается взаимосвязанный материал двух или нескольких предметов. Такие уроки используются в тех случаях, когда знание материала одних предметов необходимо для понимания сущности вопросов, задач при изучении другого предмета.
Формы интегрированных уроков могут быть различны. В форме интегрированных уроков целесообразно проводить обобщающие уроки, на которых раскрываются проблемы двух или нескольких предметов.
Интегрированные уроки – комплексная проблема современной дидактики. Дидактика интегрированного урока имеет структуру, состоящую из трёх элементов:
знания и умения из первой предметной области,
знания и умения из второй предметной области,
интеграция этих знаний и умений в процессе обучения.
Интеграцию учебных дисциплин мы строим по принципу сотрудничества, на добровольной и взаимовыгодной основе. Здесь учитываем общие интересы всех участников интеграции.
Обучающийся должен знать ответ на вопрос, где, когда и как можно использовать приобретённые знания и в жизни, и на производстве. Учебно-воспитательный процесс должен иметь профессиональную направленность.
Интегрированные уроки развивают потенциал обучающихся, побуждают к познанию окружающей действительности, к развитию логики мышления, коммуникативных способностей.
Интегрированные уроки позволяют организовывать повторение, закрепление полученных знаний, формировать умения и навыки в практической деятельности, контролировать приобретённые знания, осуществлять индивидуальный, дифференцированный подход к обучающимся в процессе учебно-воспитательной работы.
Именно такая подготовка обеспечивает конкурентоспособного специалиста в интегрированном информационном пространстве современного общества.
В настоящее время перед учителем остро стоит проблема, как повысить интерес школьников к химии, ведь качество знаний учащихся во многом определяется интересом к учебному предмету.
Жизнь в современном мире подразумевает наличие у человека определенного багажа химических познаний и навыков обращения с некоторыми химическими веществами. Учитель привлечет внимание учеников к предмету, если он его заинтересует и будет давать ответ на вопрос: «А зачем мне это знать?» Поэтому на современном уроке одной из основополагающих целей должен быть ответ на вопрос: «Где в повседневной жизни мы применим полученные знания и навыки?» Помогут построить урок именно таким образом передовые педагогические идеи, собранные в современных образовательных технологиях, в повышении мотивации к изучению химии через использование современных передовых идей, проверенных на деле и имеющих большой потенциал.
Для того чтобы урок сделать развивающим, учитель должен:
-заменить репродуктивную вопросно-ответную систему урока и типы заданий на более сложные, выполнение которых задействует самые разнообразные психические качества (память, внимание, мышление, речь и др.).
-вовлечь учащихся в самоуправление и саморегуляцию познавательных процессов на уроке, привлекая их к постановке задач урока, разработке плана его проведения, контролю и самоконтролю, к оцениванию, самооцениванию и взаимооцениванию результатов деятельности. Учащиеся могут выступать лаборантами, ассистентами, помощниками учителя, консультантами.
Этому способствуют проблемные вопросы, поисковые задания, задания на наблюдения, решение практических задач, выполнение исследовательских заданий и др.;
Поэтому современный урок, по – моему, должен построен в сочетании специально организованной деятельности и обычного межличностного общения (готовность ребенка к контакту, доверительность, заинтересованность), таким образом через личностный план общения на уроке реализуется учет возрастных, психологических особенностей учащихся: их готовность к расширению круга общения, к сопереживанию проблем взрослых, стремление к самоутверждению.
Достичь поставленных целей мне помогают современные образовательные технологии, такие как
технология уровневой дифференциации обучения;
групповые технологии;
технологии компьютерного обучения
игровые технологии;
технология интегрированного обучения;
педагогика сотрудничества
В конце XX века человечество вступило в стадию развития, которая получила название постиндустриальная или информационная. Поэтому на современном этапе в химическое образование должны быть включены информационные компоненты. Учащимся необходимо, прежде всего, овладеть компьютером в качестве одного из средств познания процессов и явлений, происходящих в природе и используемых в практической деятельности. Компьютер также позволяет изучить процессы, скрытые от непосредственного наблюдения и потому плохо воспринимаемые детьми. Причем эти процессы можно неоднократно повторить с индивидуальной скоростью усвоения. Компьютер задействует наглядно-образное мышление, способствующее более эффективному усвоению учебного материала.
Высокий обучающий эффект можно достичь при систематическом использовании на уроках компьютера.
Сегодня просто необходимо проводить уроки с использованием ИКТ. Необходимо, потому что урок с использованием ИКТ — это наглядно, красочно, информативно, экономит время, позволяет работать каждому ученику в своем темпе, позволяет учителю работать с учеником дифференцированно и индивидуально, даёт возможность оперативно проконтролировать и оценить результаты обучения.
Трудное восприятие учащимися теоретических основ химии связано с изучением процессов, которые скрыты от непосредственного наблюдения. Использование ИКТ позволяет визуализировать эти процессы; предоставляет возможность многократного повторения и продвижения в обучении со скоростью, благоприятной для каждого ребёнка в достижении понимания того или иного учебного материала; обеспечивает также возможность приобщения к современным методам работы с информацией. Виртуализация некоторых процессов с использованием анимации служит формированию наглядно — образного мышления учащихся и более эффективному усвоению учебного материала. Учащиеся становятся активными участниками урока не только на этапе его проведения, но и при подготовке, на этапе формирования структуры урока. Использование разных видов деятельности, позволяет учащимся самостоятельно добывать необходимую информацию, мыслить, рассуждать, анализировать, делать выводы. ИКТ создаёт ситуацию успеха для каждого ученика.
В своей работе я применяю разные формы и методы обучения, стараюсь использовать разнообразные приемы организации учебной деятельности. В настоящее время занимаюсь вопросами применения информационных технологий, как на уроках, так и во внеурочной деятельности.
Широкое использование анимации, химического моделирования с использованием компьютера делает обучение более наглядным, понятным и запоминающимся. Не только учитель может проверить знания ученика, используя систему тестирования, но и сам ребенок может контролировать степень усвоения материала.
Использование виртуальных экскурсий значительно расширяет кругозор ребенка и облегчает понимание сути химических производств. Главное достоинство компьютерного проектирования на уроке химии – его использование при рассмотрении взрыво- и пожароопасных процессов, реакций с участием токсичных веществ, словом, всего, что представляет непосредственную опасность для здоровья обучаемого
В связи с тем, что запасы химических реактивов уже не пополняются несколько лет, ИКТ помогает показать опыты, при не понимании опыт можно повторить несколько раз. Я говорю о тех случаях, когда нет возможности в демонстрации из-за отсутствия необходимых реактивов или условий для проведения.
Компьютер может использоваться на всех этапах процесса обучения:
- при объяснении (введении) нового материала, закреплении, повторении, контроле знаний, умений и навыков.
На сегодняшний день я использую ИКТ в преподавании химии
по следующим направлениям:
1.Подготовка печатных дидактических материалов (карточек для самостоятельных работ, индивидуальных работ). Приложение 1.
2. Подготовка печатных дидактических материалов (карточек для лабораторных, практических работ). Приложение 2
3.Тесты. Приложение 3. Приложение 8.
4. Кроссворды. Приложение 4
5.Для подведения итогов своей работы за определенные периоды я также применяю следующие формы информационно-коммуникативных технологий включающие текстовые таблицы, схемы, графики, диаграммы. Приложение 5.
6. Подбор иллюстративного материала к занятиям, оформления стендов, папок.
7. Подбор дополнительного познавательного материала к занятиям (энциклопедии);
8. Оформление групповой документации (списки детей, сведения о родителях, планирование и т.п.), отчетов.
9. Создание презентаций в программе Рower Рoint для повышения эффективности образовательных занятий с детьми. Мною созданы серии презентаций к занятиям.
10. Использование Интернета в педагогической деятельности, с целью информационного и научно-методического сопровождения образовательного процесса.
• Обмен опытом, знакомство с периодикой, наработками других педагогов .
• Создание персональной электронной почты .
Образовательная деятельность детей связана с большим нервным напряжением. Нагрузку испытывают органы слуха, зрения, мышцы туловища. Внешне это проявляется потерей интереса, ослаблением внимания и памяти, снижением работоспособности. Поэтому я применяю небольшие интересные задания, чтобы сосредоточить внимание учеников. Приложение 6.
Таким образом, использование информационно-коммуникационных технологий на ученика способствует
-ИКТ способствует повышению познавательного интереса к предмету;
-ИКТ содействует росту успеваемости учащихся по предмету;
- ИКТ позволяет учащимся проявить себя в новой роли;
- ИКТ формирует навыки самостоятельной продуктивной деятельности;
- ИКТ способствует созданию ситуации успеха для каждого ученика.
использования информационно-коммуникационных технологий на учителя.
-экономию времени на уроке;
- глубину погружения в материал;
- повышенную мотивацию обучения;
- интегративный подход в обучении;
- возможность одновременного использования аудио-, видео-, мультимедиа- материалов;
- возможность формирования коммуникативной компетенции учащихся, т.к. ученики становятся активными участниками урока не только на этапе его проведения, но и при подготовке, на этапе формирования структуры урока;
- привлечение разных видов деятельности, рассчитанных на активную позицию учеников, получивших достаточный уровень знаний по предмету, чтобы самостоятельно мыслить, спорить, рассуждать, научившихся учиться, самостоятельно добывать необходимую информацию.
Интеграция новых ИКТ - технологий в образовательный процесс необходимое условие модернизации системы образования.2. Уровневая дифференциация обучения
В обучении химии разноуровневая дифференциация имеет особое значение. Это обусловлено спецификой учебного предмета: у одних учащихся усвоение химии сопряжено со значительными трудностями, а у других проявляются явно выраженные способности к изучению этого предмета. В данной ситуации учителю важно учитывать как познавательные интересы учащихся, так и индивидуальный темп их развития. Такой подход основан на многоуровневом планировании результатов обязательной подготовки учащихся (усвоение минимума) и формировании повышенных уровней овладения материалом. Учащиеся получают право и возможность выбирать уровень обучения, учитывая свои способности, интересы, потребности, варьировать свою учебную нагрузку, учиться адекватно оценивать свои знания. В процессе обучения дифференциация осуществляется, прежде всего, через применение разноуровневых заданий для учащихся, выполняемых на уроке с целью закрепления знаний, в качестве контрольных заданий на зачетах, контрольных работах. Дифференциация в обучении открывает перед учащимися возможности выбора уровня обучения, а вместе с ним и уровня теоретической и практической подготовки по химии. В процессе управления учитель ищет способы, как направлять, корректировать работу учеников, вовремя приходить на помощь отстающим. Он проявляет заботу не только о том, как усваивается учебный материал, формируется умения и навыки, но и как развиваются, воспитываются ученики.
Например, дифференцированная контрольная работа. Приложение 7.стр.65.
Обучающиеся получают индивидуальные карточки, ученики со слабыми знаниями выполняют задания невысокого уровня сложности ( 2 или 3 задания). Более сильные ученики решают четыре или пять заданий карточки, позволяющих проверить не только практические, но и теоретические знания. Соответственно, уровень 1 оценивается на 3 балла, уровень 2 – 4 балла, уровень 3 – 5 баллов. Но обучающиеся могут получить и более высокую оценку, ответив устно, или выполнив дополнительные задания.
Используются в работе и тестовые задания, состоящие из нескольких уровней.
Приложение 7. Приложение,8.. Для того чтобы исключить вероятность угадывания правильного ответа, вариантов ответов должно быть не меньше четырех. Тестовые задания составляются приближенно к итоговой аттестации (ГИА или ЕГЭ), для того чтобы учащиеся заранее подготовиться к экзаменам и предстоящее тестирование не вызывало страха.
Многократное повторение близких по содержанию знаний понятий, безусловно, способствует более прочному и осмысленному пониманию главнейших теоретических положению курса, более активному приобретению навыков и умений. Для того чтобы обучающиеся могли применять химические знания, составляются задачи с профессиональным содержанием.
При решении расчетных задач, Приложение7.10, также учитывается уровень знаний и способностей учащихся. Одну и ту же задачу можно решить разными способами, и существуют методические разработки, в которых учитывается правостороннее и левостороннее развитие ученика. Также были составлены карточки с заданиями для каждого ученика, что заставляет, не надеется на списывание у соседа, а решить все самому.
Разноуровневый подход используется и при задании домашней работы. Учащимся задается определенное количество заданий. Приложение 7.7. Из них он может выполнить обязательный минимум, а также свыше этого минимума. Важный психологический эффект: самостоятельный выбор задания дает дополнительную возможность самореализации ученику, и предмет становится ему интереснее. Из всех заданий ученик выбирает тот уровень сложности, на который способен «замахнуться», и таким образом сам как бы отслеживает уровень своей компетентности. И, наконец, выбирая свои задачи, ученик волей-неволей читает остальные. Таким образом, его учебный кругозор становится шире, то есть он знает гораздо больше задач, чем решает, а также учится с первого взгляда оценивать сложность задачи.
Таким образом, основная цель разноуровневой дифференциации состоит в том, чтобы создать условия для самореализации каждого ученика в соответствии с его интересами и, главное, возможностями. Эта технология позволяет учащимся реально оценивать свои силы, а также видеть свои достижения. В результате повышается интерес к предмету, между учителем и учащимися устанавливаются партнерские отношения, снижается психологическое напряжение учащихся на уроках. Повышается качество знаний и активность слабоуспевающих учащихся.
Никто не оспаривает тот факт, что химия – это очень важная наука. Но она скучна, если опирается только на научные достижения и факты. Модернизация образования предполагает ориентацию не только на усвоение каждым обучающимся определенной суммы знаний, но и на развитие его личности, познавательных и созидательных способностей. Очень важным при этом является практическое применение полученных на уроках знаний в повседневной жизни, окружающем мире.
3.Педагогика сотрудничества В работе с детьми многие педагоги не всегда учитывают их возрастные особенности, что сказывается на эффективности педагогического труда и темпах развития личности ребёнка. Какой учитель не мечтает, чтобы его ученики получали только хорошие и отличные оценки? Увы, этой мечте не всегда суждено сбыться, всем понятно, что у каждого ребенка свои индивидуальные интеллектуальные способности, разный уровень мотивации обучения, да и содержание образовательных программ, особенно в основной школе стремительно усложняется, уровень навыков требований по всем учебным предметам повышается от класса к классу. Поэтому применение «Личностно-ориентированное обучение на уроках химии особенно важно, оно обеспечивает всемерный учёт возможностей и способностей обучаемых и создаёт необходимые условия для развития их индивидуальных способностей. Важно понять, что дети не делятся на "хороших" и "плохих". Все дети хорошие, лишь учатся они по-разному. В работе с детьми, а особенно с неуверенными в себе, с заниженной самооценкой, тревожными и мнительными учитель должен стремиться к созданию для каждого ученика "ситуации успеха", благодаря которой ребенок сможет поверить в свои силы, способности, потенциальные возможности. Личностно- ориентированное обучение - способ организации обучения, в процессе которого обеспечивается всемерный учёт возможностей и способностей обучаемых и создаются необходимые условия для развития их индивидуальных способностей. На уроке химии создается та учебная ситуация, когда не только излагаются знания, но и раскрываются, формируются и реализуется личностные особенности учащихся. На таком уроке господствует эмоционально положительный настрой учащихся на работу.
Готовясь к урокам по химии, учитель должен продумать не только, какой материал он будет сообщать на уроке, но и какие содержательные характеристики по поводу этого материала возможны в субъектном опыте учащихся ( как результат их предшествующего обучения у разных учителей и собственной жизнедеятельности).
Важна при этом и форма обсуждения детских «версий». Она не должна быть жесткой, в виде оценочных ситуаций (« правильно - неправильно»). Задача учителя - выявить и обобщить «версии» учеников, выделить и поддержать те из них, которые наиболее адекватны научному содержанию, соответствуют теме урока, целям и задачам предмета. Ученикам предоставляется возможность задавать вопросы, высказывать оригинальные идеи и гипотезы. Обмениваться мыслями, мнениями, дополнять и анализировать ответы товарищей. Побуждать учащихся к поиску альтернативной информации при подготовке к уроку. Чередовать виды работ, типы заданий, что уменьшает утомляемость учащихся.
Личностно- ориентированная педагогика открывает новые принципиальные подходы и тенденции в решении вопросов «чему» и «как» учить сегодня. Содержание обучения рассматривается как средство развития личности, а не как самодовлеющая цель. Учитель не просто создает благожелательную творческую атмосферу, он признает самобытность и уникальность каждого обучаемого.
В рамках ЛОО как самостоятельные технологии можно выделить: разноуровневое обучение, коллективное взаимообучение, модульное обучение, технологию проектного метода, игровые и информационно-коммуникативные технологии, технологию сотрудничества. Приложения1. Приложение 3. Приложение 4. Приложение7 Приложение 8. Приложение 9. Таким образом, использование технологий ЛОО на уроках химии и во внеурочной работе в течении нескольких лет дает высокие и стабильные результаты обучения развивает творческие исследовательские способности учащихся, повышает их активность, способствует интенсификации учебно-воспитательного процесса, приобретению навыков самоорганизации, помогает развитию познавательной деятельности учащихся и интереса к предмету. Все это подтверждают результаты итоговой и промежуточной аттестации. Приложение 5. 4.Игровые технологииОбучение школьника происходит воздействием на его органы зрения: демонстрация опытов, чтение материала (в памяти остается 50% наблюдаемого, 30% прочитанного), органа слуха – монолог учителя, диалог с учителем, с одноклассниками (в памяти остается 10% услышанного), практическая деятельность самого ученика, самостоятельная работа (в памяти остается 90% сделанного самим). Выучить необходимый материал ученика можно либо заставить, либо заинтересовать. Игра предполагает участие всех участников в той мере, на какую они способны. Учебный материал в игре усваивается через все органы приема информации, причем делается это непринужденно, как бы само собой, при этом деятельность учащегося носит творческий характер. Происходит 100% активизация деятельности учеников на уроке. Причем интеллектуально развитые дети занимают лидирующее положение, обучая отстающих в командной игре. Известно, что слово сверстника имеет больший вес для подростка, чем слово учителя. Соревновательность в работе, возможность посовещаться, острейший дефицит времени – все эти игровые элементы активизируют учебную деятельность учащихся, формируют интерес к предмету.
По определению, игра - это вид деятельности в условиях ситуаций, направленных на воссоздание и усвоение общественного опыта, в котором закладывается и совершенствуется самоуправление поведением.Мы хорошо понимаем, что ребята, которые впервые пришли в кабинет химии, в большенстве своем проявляют особый интерес к дисциплине химии, зачастую связанный именно с проведением экспериментов и опытов на занятиях, но к сожалению, интерес этот у большенства учеников 8 класса скоро пропадает, из-за большой теоретической нагрузки.
Многолетний опыт преподавания химии подсказывает, что на начальном этапе обучения целесообразно использовать методы активного обучения: игры, занимательную дидактику, ролевые и сюжетные постановки. Это создает непринужденную обстановку на уроке и позволяет активизировать познавательный интерес учащихся, их познавательную деятельность. Приложение 1 Приложение4 Приложение,9.Часто бывает, что при изучении сложного или объемного материала внимание учащихся рассеивается, они никак не могут сосредоточиться на уроке. Именно в таких случаях необходимо привлечь их внимание каким-либо интересным рассказом или игрой. Занимательная игровая дидактика, исторические сведения, курьезные случаи из жизни ученых-химиков помогут учителю разнообразить и оживить изложение сухого материала, вызвать интерес к теме и предмету в целом, активизировать ассоциативную память учащихся в процессе обучения. Приложение 6
Дидактические игры позволяют эффективно реализовывать все ведущие функции обучения: образовательную, воспитательную и развивающую - на основе принципов педагогики сотрудничества. Использование такой формы обучения решает сразу несколько задач.
Игра позволяет научить распознавать объекты, сравнивать их, характеризовать, раскрывать понятия, обосновывать их, применять. В результате использования методов игрового обучения стимулируется познавательная деятельность учащихся, активизируется их мышление. Школьники самопроизвольно, часто на основе ассоциаций, запоминают специальные сведения, решают проблемные вопросы. В ходе игры выявляются личностные черты характера учащихся, усиливается мотивация к изучению предмета. Все это говорит об эффективности обучения в процессе игры, имеющей черты как учения, так и труда. Практика показывает, что в дидактических играх по химии с большим интересом участвуют слабоуспевающие, которых увлекает сам процесс игры, дух соревнования, стремление к тому, чтобы их команда одержала победу, что способствует лучшему усвоению и углублению знаний по пройденной теме.Для совершенствования знаний по отдельным вопросам темы можно использовать на уроках химии игры, которые называются «Химический лабиринт», «Рассказы-задачи», «Крестики-нолики», Термины-синонимы. Найдите соответствие. Верю - не верю. «Что? Где? Когда?», «Звездный час», «Отгадай химический элемент» «Химический аукцион», «Химическое лото», «Химия в твоих руках», «Своя игра» и другие Игра — это метод обучения, требующий интенсивного участия обучаемых. Как правило, игре предшествует подготовка слушателей, включающая теоретический курс и ряд практических занятий по отработке навыков решения задач. Применение игр позволяет решить задачу, связанную с необходимостью информационной перегрузки, с организацией психологического и физиологического отдыха. Дети успешно обучаются в игровой деятельности, непроизвольно запоминая информацию, поскольку в игровых формах присутствует главный фактор обучения - активность учащихся, а также сопутствующий – общение.
На уроках с применением игровых технологий используются также компьютерные технологии (презентации, демонстрации видеоопытов), здоровьесберегающие технологии (физкультминутки, цветотерапия), развивающее обучение (приемы, направленные на развитие воображения, памяти, речевых навыков, мышления), проблемно-поисковые и проблемно-интегрированные технологии (постановка и решение межпредметных учебных проблем), технологии критического мышления (вызов, осмысление содержания, рефлексия) и обучения в сотрудничестве. Игра имеет большое значение в приобретение и в формировании учебных умений и навыков.
5.Технология интегрированного обучения
Известный химик А. Е. Арбузов писал:
«Не могу представить себе химика,
не знакомого с высотами поэзии,
с картинами живописи, с хорошей музыкой».
Давно было замечено, что не только плохо успевающие, но даже многие отличники совершенно не соотносят сведения о внешнем мире, полученные на одном уроке со сведениями о том же предмете, которые им сообщают на других уроках. Дети часто не связывают воедино и разрозненные факты, которые мы им сообщаем в рамках одного предмета.
Самая важная цель обучения и воспитания заключается в том, чтобы любой человек умел действовать самостоятельно, применять полученные знания в жизни, умел свободно общаться и был ответственным за все, что он делает.
Интеграция с теми предметами, которые кажутся школьникам достаточно привлекательными, позволяет успешно повышать интерес к химии и развивать мотивацию ее изучения. Интеграция с прикладными дисциплинами раскрывает возможности практического применения приобретенных химических знаний.
На мой взгляд, конечная цель интеграции – дать учащимся целостное представление об окружающем мире с целью использования его в дальнейшей жизни, устранить разобщённость учебных предметов, повысить интерес обучающихся к учению;
Химия относится к естественнонаучным дисциплинам и является трудной для усвоения учащимися в силу того, что является очень логичной наукой и требует выстраивания причинно-следственной связей, но чтобы заинтересовать учащихся, мотивировать их на обучение этому предмету, связать обучение с решением практических задач посредством практической реализации интегративных связей, таких как химия –биология, химия - физика, химия – математика, химия – экология, химия – история, химия – география, химия - литература
Связь химии – физики.
Без физической основы трудно представить разделы химии как «Строение атома» или «Окислительно-восстановительные реакции.
«Математика – царица наук»
Любая химическая задача, уравнение может быть решена только с помощью математических навыков и приобретенных логических приемов. Для того чтобы решить химическую задачу, необходимо: определить
что требуется в задаче, выписать основные химические формулы для рения задачи, а в дальнейшем использование математических знаний для решения химических задач.
Связь химии с информатикой.
На сегодняшний день роль компьютера трудно переоценить. Интернет и различные программы помогают ребятам узнать больше о современном состоянии науки, ученики с удовольствием деляться с учителем новой информацией. Учащиеся должны уметь правильно оформлять свои доклады и рефераты, а в электронной версии этот материал можно дополнить и обработать, а так же развитие информационного пространства повышает интерес учащихся к новым методам и формам обучения.
Связь химии с историей.
Химия непосредственно связана с историей, потому что химия, как наука формировалась ни одно тысячелетие. Таким образом, любое открытие, явление имело свою дату, своего ученого. Экономическая обстановка той или иной эпохи влияло на развитие химии, а зачастую и тормозило важнейшие открытии.
Связь химии с биологией и экологией.
В основе любого биологического процесса лежит химическое превращение. Таким образом, видна тесная связь между химией и биологией. Примером послужить окисление глюкозы в организме человека.
Другая сторона биологического процесса является конечный продукт, который получается при этом. В результате продукты окисления, такие как альдегиды, оказывают отравляющее действие на организм. Чтение литературных отрывков, стихов на уроке химии придаёт изучаемому материалу особую привлекательность и развивает интерес учащихся. Использование литературных загадок при изучении нового материала развивает логическое мышление, а так же способствует их эвристической деятельности учащихся на уроке.
Пример 1: Я на бумаге оставляю
Конечно, очень жирный след.
И рисовать вам помогаю.
Уже я много – много лет!
Не прочен я, не как гранит!
А называюсь я ... (графит) Приложение 10.
Самая эффективная форма интеграции - интегрированные уроки. Проведение интегрированных уроков создает условия для использования разнообразных заданий, способствующих развитию интереса учащихся к предмету. Интегрированному процессу присущи признаки взаимопроникновения одного учебного предмета в другой, логико-содержательная основа и педагогическая целенаправленность, относительная самостоятельность. Методика интегрированного урока отличается от методики традиционного урока тем, что преподаватели одновременно ведут урок по какой-либо теме. Необходимо, чтобы в структуре интегрированного урока органически сочетались личности преподавателей и учеников, их взаимодействия друг с другом, чтобы данный урок представлял целостную психолого-педагогическую систему. Интегрированные уроки надолго остаются в памяти школьников.
Пример: «Нахождение массовой доли элемента в веществе» - химия, биология, экология, «Металлы в организме человека» - химия, биология, экология, литература. «Земля - наш общий дом» - химия, география. «Астрологические свойства сплавов» - химия, биология.
Можно использует три типа интегрированных уроков:
1.урок – изучение нового материала; 2. урок – обобщение и закрепление изученного; 3урок – контроля знаний.
Таким образом, при изучении такого предмета как химия, видна тесная связь с многими науками, и задача учителя – раскрыть и показать эти связи, а также единство наук между собой.
И в заключении хочу привести разработку урока химии в 8 классе по теме "Оксиды". Приложение 11.
При разработки данного урока я применяла несколько технологий, которые , как я думаю способствовали лучшему усвоению учениками нового материла, задачами данного урока было
1. Ввести понятия оксидов, как сложных бинарных соединений; их признаки , классификацию
2.Познакомить с формулами важнейших оксидов.
3. Отрабатывать умения записывать и читать формулы оксидов.
4. Тренироваться в составлении молекулярных формул оксидов.
5.Уметь выделять оксиды среди других классов веществ и выделять оксиды металлов по их признакам.
7.Формировать учебные навыки систематизации учебного материала через заполнение таблиц, составление схем.
При подготовке данного урока была разработаны презентация , в которой наглядно давался новый материал, задания в виде кроссворда, подготовлены таблицы для заполнения, карточки с заданиями - "исключите лишнее вещество", "выберите оксиды", " дайте название следующим бинарным соединениям, расставьте степени окисления химических элементов", " Тренинг «Проверь себя»", "Крестики-нолики", Тест вставьте формулы названных в тексте оксидов".
В начале урока, чтобы мотивировать детей к учебной деятельности дается кроссворд, результатом которого будет объявлена тема нашего урока, ученики работают в парах,
тем самым формируются умение самостоятельно выделять и формировать учебно-познавательный интерес к новому учебному материалу, они учатся
умению взаимодействовать друг с другом, помогать друг другу, стимулировать напарника для взаимной работы.
На основе полученной информации предлагается сделать вывод, о каком классе веществ идет речь, таким образом, определяя тему урока
Формулируют тему урока.
Предположительный ответ – оксиды.
Затем идет первичное ознакомление нового материала , где учитель по мимо рассказа использует слайды презентации "Опорный конспект", это также еще и зрительная память для детей.
Работают по конспекту, дают определения и находят общие признаки оксидов. Учатся читать и называть оксиды. При этом ведется фронтальная беседа ,дети работают в парах и индивидуально.
На данном этапе ученики учатся умею добывать новые знания: находить ответы на вопросы, использовать учебник, свой жизненный опыт и информацию, полученную на уроке.
Учатся умению оформлять свои мысли в устной форме; слушать и понимать речь других (обучение в сотрудничестве).
На следующем этапе - это освоение, отработка, закрепление материала, ученикам предлагается несколько заданий на карточках - "исключите лишнее вещество", "выберите оксиды", " дайте название следующим бинарным соединениям, расставьте степени окисления химических элементов", " Тренинг «Проверь себя»". Это все затем проверяется по ответам презентации.
На данном этапе формируем умение слушать и понимать других, работать в парах учитывая позицию собеседника, закрепляем умение работать с новой информацией по теме (отбирать, выделять, обобщать)
На заключительном этапе проверяем умение применять знания нового материала . Класс делится на две группы:
1. группы участвуют в игре “Крестики нолики”, находят выигрышный путь, объясняя свой выбор. слайд №11
2. группа проходит тестирование на компьютере. Слайд №12
На данном этапе оценивается умение структурировать знания; дается оценка процесса и результатов деятельности.
Подведение итогов урока. Рефлексия. Коррекция самооценок, самоанализа, выставление оценок. -приложение №2
Уметь оценивать правильность выполнения действия на уровне адекватной ретроспективной оценки.
Способность к самооценке на основе критерия успешности учебной деятельности. Оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья.
Между выполнением заданий идут небольшие сообщения о значении различных оксидов для человека, их применении в жизни, дети рассказывают где они встречаются с ними на собственном опыте.
Таким образом чтобы подготовить данный урок применялись такие технологии как ИКТ, технология сотрудничества, игровая технология, технология интегрирования.
, т.е при помощи различных технологий урок становится более интересным.
Применяя различные технологии на уроках химии, это приводит к тому, что дети не остаются безучастными к изучению учебного материла, им интересно и поиграть, и обсудить, и сделать тест. Самое главное чтобы не было однообразно, тогда они даже не замечают как делая задания, участвуя в диспутах учат школьную программу. Конечно, чтобы подготовить даже один урок для всех учеников в классе, учителю нужно проделать большую работу, но по другому сейчас не возможно воспитать всесторонне развитую личность.
Список литературы.
1. Фирсов В.В. Дифференциация обучения на основе обязательных результатов обучения. - М., 1994.
2. Никитин Б.П. Ступеньки творчества, или Развивающие игры. М., 1990.
3. Селевко Г.К. Энциклопедия образовательных технологий. В 2-х т. Т. 1. – М.: Народное образование, 2005.
4. Селевко Г.К. Современные образовательные технологии. Ярославль, 2008.
5. Селевко Г.К. и др. Дифференциация обучения. - Ярославль, 1995.
5. Л. И. Кузнецова "Новая технология преподавания химии".
6. http://aplik.ru/10-klass/sovremennye-pedagogicheskie-tekhnologii-i-ikh-rezultativnost/
7. Лопанова Е.В., Рабочих Т.Б. Компетеностный подход в обучении: технологии реализации: Учебно-методическое пособие. – Омск: - 100 с.
8.Инновационные педагогические технологии в учебно-воспитательном процессе современного образовательного учреждения: материалы Международной заочной научно-практической конференции. 02 июля 2013 г. / гл. ред. Баранов А.С. – Чебоксары: ЦДИП «INet», 2013. – 184 с
Подготовка печатных дидактических материалов (карточек для самостоятельных работ, индивидуальных работ):
а). Распределите приведенные ниже вещества на три группы. Назовите эти группы.
СаО, Аl(ОН)3, СuО, НСl, Н2О, Сl2О7, Fе(ОН)2, НNО3, NаОН, Н2SО4 .
| Оксиды | Основания | Кислоты |
| СаО, СuО, Н2О, Сl2О7 | Аl(ОН)3, Fе(ОН)2, NаОН | НСl, НNО3, Н2SО4 |
б). Крестики-нолики «Основания»
Найдите выигрышный путь, состоящий из формул оснований.
| Са(ОН | Ва(ОН)3 | СО2 |
| Fе(ОН)2 | Аl(ОН)3 | Сu(ОН)2 |
| NаН | КОН | НI | СаН2 | КСl | НNО3 | |
| Н2О | СаСl2 | LiОН | О2 | СаСО3 | Zn(ОН)2 |
Назовите эти основания.
в). Задание « Найди родственников»
Из перечня формул составьте генетический ряд.
1вариант : Ca(OH)2, CI2, HCI, Ca, P, CaCO3, NaOH, CaO, CO2.
2 вариант: AI, NaOH, AI(OH)3, CaO, CO2, Ca, AI2O3 , P, AICI3
3 вариант: NaOH, HNO3, Ca, P, NaH, CO2, Na, NaNO3, Fe.
4 вариант: Ca(OH)2, CI2, AI(OH)3,CI2O7, NaNO3, Fe, HCIO4 , AICI3, Na
г). Лишнее вещество.а) SO3, HNO3, FeO, K2O, CO2, CuO. (лишнее HNO3, т.к. оксиды)
б) HNO3, H2SO4, Al(OH)3, HCl, H3PO4, H2CO3.(лишнее Al(OH)3, т.к. кислоты)
в) Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH, Ba(OH)2. (лишнее Ba, т.к. основания)
г) KNO3, FeSO4, NaCl, Al2S3, BaO, CaCO3 (лишнее BaO, т.к. соли)
д). Распределение веществ по классам.SO3, HNO3, FeO, K2O, CO2, CuO HNO3, H2SO4, Al(OH)3, HCl, H3PO4, H2CO3 Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH.
Приложение.1 – продолжение
е) Оксиды углерода. – сравнительная характеристика
| Критерии сравнен | СО | СО2 |
| Название | Оксид углерода (II ) | Оксид углерода (IV ) |
| Цвет | бесцветный | бесцветный |
| Растворимость в воде | Не растворяется | Растворяется плохо |
| Запах | Без запаха | Без запаха |
| Физиологическое действие | Ядовит, вызывает угар | Инициирует вдох |
| Химические свойства | ||
| Характер | несолеобразующий | кислотный |
| Окисляемость | 2CO+O2=2CO2 CO+CuO=Cu+CO2 | Не окисляется |
|
| CO+NaOH p,t HCOONa
| 2NaOH+CO2=Na2CO3+H2O
|
| Взаимодействие с основными оксидами | Не взаимодействует | CaO+ CO2=CaCO3
|
| Взаимодействие с водой | Не взаимодействует | CO2+H2O= H2CO3 |
|
| При сгорании углерода в недостатке кислорода. При взаимодействии с раскаленным углём C+O2=2COнедост. CO2+C=2CO | Термическое разложение извести CaCO3t CaO+ CO2 При действии на карбонаты раствором кислоты CaCO3+2HCl=CaCl2+CO2+H2O
|
| Применение | Используют в гидрометаллургии, как восстановитель | Используют при тушении пожаров; при производстве удобрений, соды, газированной воды; для создания инертной среды |
ж) Назовите вещества:
Fe(OH)2, CaO, H2SiO3, Cr3(PO4)2, Co(NO3)3, HF, As2O3, BaSO4, MgS, HNO3, CO2, CaCO3, CaCl2, Co(OH)3, Na3PO4, Co, CO, Fe
з) Напишите формулу вещества
Карбонат цинка
Гидроксид железа (III)
Оксид азота (I)
Фтороводородная кислота
Гидроксид магния
Оксид ванадия (V)
Нитрит бария
Оксид селена (IV)
Сероводородная кислота
Нитрат меди (II)
Фосфат стронция
Сульфид алюминия
Оксид марганца (VII)
Сульфат бария
Силикат лития
Хлорид натрия
Фторид серебра (I)
Нитрат цинка
Серная кислота
Оксид фосфора (V)
Оксид фосфора (III)
а)Лабораторный опыт
ИНСТРУКТИВНАЯ КАРТА:
Форма работы: парная.
Время работы – 8-10 минут.
Задание:
Исследовать окраску индикаторов в кислотных средах.
Оборудование и реактивы:
3 пробирки с соляной и 3 пробирки с лимонной кислотами, жидкие индикаторы: лакмус, фенолфталеин и метилоранж, стеклянные палочки.
Правила техники безопасности:
Внимание! Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов:
1 группа: В пробирку с соляной кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
Во 2-ю пробирку с соляной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
В 3-ю пробирку с соляной кислотой добавьте каплю лакмуса. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
2 группа: В пробирку с лимонной кислотой добавьте каплю фенолфталеина. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
Во 2-ю пробирку с лимонной кислотой добавьте каплю метилоранжа. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
В 3-ю пробирку с лимонной кислотой добавьте каплю лакмуса. Перемешайте стеклянной палочкой. Результаты наблюдений запишите в таблицу.
Приложение 2.продолжение.1
Действие кислот на индикаторы
| Индикатор | Окраска индикатора в воде | Окраска индикатора в растворе соляной кислоты (HCl) | Окраска индикатора в лимонной кислоте |
| Лакмус | Желтая |
|
|
| Фенолфталеин | Бесцветная |
|
|
| Метилоранж | Оранжевая |
|
|
Обсуждение результатов и формулирование выводов:
1. Какие индикаторы изменили свой цвет в кислотах? (Лакмус и метилоранж).
2. Одинаковые ли изменения цвета этих индикаторов вы наблюдали в обеих кислотах? (Да).
3. Какую окраску приобрели лакмус и метилоранж и в соляной, и в лимонной кислотах?
(Лакмус стал красным, а метилоранж - розовым).
На основании проведенных опытов сделаем выводы:
независимо от вида кислоты (органической или неорганической) индикаторы изменяют свой цвет одинаково; а это означает, что все кислоты обладают сходными свойствами.
С чем же это связано? (С наличием атомов водорода).
Приложение 2.продолжение.2
б). ИНСТРУКТИВНАЯ КАРТА. (Металлы)
Задание:
Исследовать взаимодействие магния с кислотами и щелочами.
Оборудование и реактивы:
Пробирки, стеклянные палочки, соляная кислота, гидроксид натрия.
Правила техники безопасности:
Внимание! Работать с кислотами и щелочами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты или щелочи на кожу надо смыть ее струей воды.
Проведение опыта и оформление результатов
1. В пробирку с магнием осторожно добавьте 2мл соляной кислоты. Что наблюдаете? Составьте уравнение химической реакции и электронный баланс к ней.
2. После того, как магний весь раствориться в пробирку добавьте 2 мл гидроксида натрия. Что наблюдаете? Составьте молекулярные, полные и сокращенные ионные уравнения.
3. К полученному осадку добавьте 2мл соляной кислоты. Что наблюдаете? Составьте молекулярные, полные и сокращенные ионные уравнения.4. Составьте генетический ряд.
Стимул: В природе все взаимосвязано и все вещества имеют родственные (генетические) связи. Докажите это опытным путем.
ТЕСТ.
1. Признаки химической реакции
а) изменение формы, б) выпадение осадка, в) выделение газа, г) изменение цвета, д) измельчение
2. Коэффициент перед формулой алюминия в химической реакции: Al + O2 → Al2O3
а) 2, б) 4, в) 3, г) 6, д) 5
3. К реакциям соединения относятся реакции:
а) 3HNO3 + Fe(OH)3 → Fe(NO3)3 + 3H2O, б) 2H2 + O2 → 2H2O
в) 4NO2 +2H2O + O2 →4HNO3, г) Na + Cl2 →NaCI, д) Cu(OH)2 → CuO + H2O
4. Реакция: CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4 относится к типу
а) замещения, б) разложения, в) соединения, г) обмена, д) горения
5. К реакциям разложения относятся реакции:
а) NaCl + KOH = NaOH + KCl, б) CaCO3 = CaO + CO2
в) 2H2O2 → 2H2О + O2, г) AgNO3 → Ag + NO2 + O2, д) 2Н2 + О2→2Н2О
Приложение 3.- продолжение1
Тесты. для 8 класса Тема: Предмет химии. Вещества.1.Что изучает наука химия?
1. Это наука о веществах 2. Это наука о превращении веществ 3. Это наука о свойствах веществ 4. Это наука о веществах, их свойствах и превращениях.
2.Что такое сложное вещество?
1. Вещество , образованное химическими элементами 2. Вещество, образованное атомами химических элементов 3. Вещество, образованное атомами одного химического элемента 4. Вещество, образованное атомами разных химических элементов.
3. В каком ряду расположены только тела
1. поваренная соль, сахар, свеча 2. вода, железо, сера 3. медь, гвоздь, кислород 4. Кирпич, медная монета, керамический стакан.
4.Верныли следующие суждения?
А). Химия –это наука о веществах и их свойствах
В) Химия –это наука о веществах и их свойствах и превращениях
1. Верно только А 2. Верно только В 3. Верны оба суждения 4. Оба суждения неверны.
5.Тело
1. Стекло 2. Полиэтилен 3. Свинец 4. Стакан
Приложение 3.- продолжение2
6 Вещество:
1. Алюминиевая проволока 2. Медная монета 3. Цинковая пластина 4. Медь
7.Простое вещество:
1. Водород 2. Углекислый газ 3. Угарный газ 4. Поваренная соль
8. Сложное вещество
1. Фосфор2. Углекислый газ 3. Сера 4. Медь.
9. Говорят о водороде, как о простом веществе:
1. Водород – самый легкий газ 2. Порядковый номер водорода в Периодической таблице-1 3. Водород входит в состав воды 4. Водород входит в состав оснований
10. Говорят о сере как о химическом элементе
1. Сера не реагирует с соляной кислотой 2. Сера входит в состав серной кислоты 3. Сера желтого цвета 4. Сера горит синим пламенем
Тест разного уровня сложности,по теме «Оксиды. Кислоты. Основания. Соли
1. Какое из веществ имеет запах?
а) H2SiO3 в) H3PO4 б) H2SO4 г) HCl
2. Выберите формулу кислоты соответствующей SO2 :
а) H2SO3 в) H2SO4 б) HNO3 г) H2CO3
3. Реакция получения щелочи:
а) железо + вода в) алюминий + вода б) натрий + вода г) цинк + вода
Приложение 3.- продолжение3
4. Какая реакция является реакцией нейтрализации:
в) NaOH + HClа) NaCl + H2SO4 г) Zn + HCl б) CuO + HNO3
5. В какой цвет окрашивают кислоты индикатор лакмус:
а) жёлтый в) синий б) красный г) малиновый
6. Какое вещество взаимодействует с соляной кислотой и в результате выделяется водород:
а) сера в) серебро б) кремний г) магний
7. Что такое силикаты?
а) соли кремниевой кислоты в) соединения кремния с кислородом б) соли угольной кислоты г) соединения кремния с углеродом
8. В какой цвет окрашивает лакмус в растворе щелочи:
а) малиновый в) синий б) не меняется г) красный
9. Какой гидроксид является щелочью
: а) гидроксид меди в) гидроксид кальция б) гидроксид цинка г) гидроксид железа
10. Какое вещество может реагировать с раствором гидроксида кальция:
а) сульфат бария в) оксид цинка б) углекислый газ г) хлорид натрия
11. Вещество, существующее в природе в трёх агрегатных состояниях: а) поваренная соль в) вода б) песок г) сахар
Приложение 4. Кроссворды. Тема «Азот»
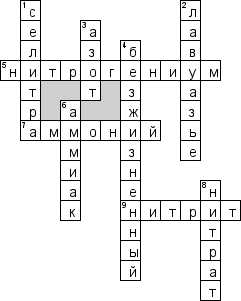
По горизонтали
5. Латинское название азота, означает рождающий селитру
7. Ион, входит во многие соединения, где играет роль одновалентного металла
9. Соль азотистой кислоты
По вертикали
1. Удобрение
2. Ученый, который ввел название азот
3. Самый распространенный элемент в атмосфере
4. Что в переводе означает слово азот
6. Газ с резким неприятным запахом
8. Соль азотной кислоты
Кроссворды по названиям химических элементов.
Заполните пустые клетки русскими названиями следующих химических элементов: Ag, Br, Fe, Н, I, О, Sn.
Кроссворд по повторению первоначальных химических понятий .
Ключевым словом является один из способов разделения смеси. (Выпаривание.)
1. Физическое свойство веществ. (Цвет.)
2. Химический элемент As. (Мышьяк.)
3. Предмет, который в руках детей может оказаться «опасной игрушкой». (Спички.)
4. Предмет, который прикрепляется к штативу. (Лапка.)
5. Стеклянная посуда для проведения химических реакций. (Пробирка.)
6. Химический элемент Zn. (Цинк.)
7. Физическое свойство веществ. (Твердость.)
8. 2Fe(OH)3 = Fe2O3 + 3H2O — тип реакции. (Разложение.)
9. Химический элемент In. (Индий.)
10. Предмет, который используют при фильтровании.
(Фильтр.)
11. Химический элемент ? + Сера = сульфид этого химического элемента. (Железо.)

Приложение 5.
| Контрольные работы. | 1.Атомы химических элементов | 2.Простые вещества | 3.Соединения химических соединений | 4.Изменения, происходящие с веществами | 5.Итоговая |
| года | |||||
| 2011-2012 уч. Год Кач. | 64 | 40 | 78 | 40 | 20 |
| 2011-2012 уч. год. Успев. | 100 | 100 | 100 | 100 | 100 |
| 2012-2013 уч. год. Кач. | 47 | 30 | 48 | 54 | 60 |
| 2012-2013 уч.год. Успев. | 100 | 100 | 100 | 100 | 100 |
| 2013-2014 уч.год. Кач. | 70 | 65 | 89 | 46 | 60 |
| 2013-2014 уч. год. Успев | 100 | 100 | 100 | 100 | 100 |
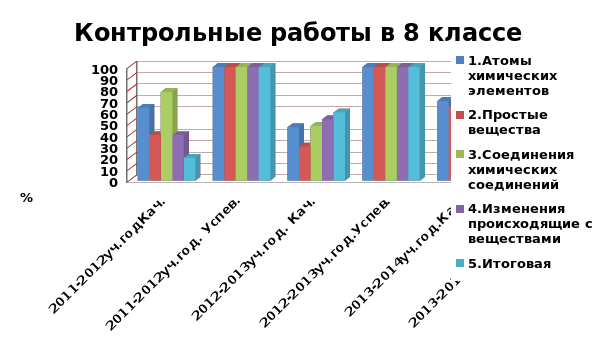
Приложение 6. 1.Отгадываю химический элемент.
Каждый ученик загадывает свой химический элемент. Учитель предлагает провести с номером этого элемента следующие вычисления. 1. номер элемента удвоить 2. к произведению прибавить 5 3. сумму умножить на 5 4. результат сообщить учителю. Объяснение игры: Пример №25 25*2=50 50+5=55 55*5=275. Отбрасываем последнюю цифру – 27 27-2=25 марганец Учитель называет задуманный элемент.
2.Загадки.
«Загадка» для первой группы.
Используют в производстве спичек.
Просто вещество – неметалл, имеет жёлтый цвет.
По латыни Sulfur.
Ответ: сера.
«Загадка» для второй группы.
Этот элемент имеет наивысшую электрическую проводимость.
Простое вещество – металл белого цвета.
По латыни Argentum.
Ответ: серебро.
«Загадка» для третьей группы.
Входит в состав медного купороса.
Простое вещество – металл красно – розового цвета.
По латыни Cuprum.
Ответ: медь.
«Загадка» для четвёртой группы.
Простое вещество - неметалл красного цвета.
Имеет несколько аллотропных модификаций.
В переводе с латыни «светоносный».
Ответ: фосфор.
Приложение 6. продолжение.1
3)Правила выживания в химической лаборатории
1. Если вы откупорили что-либо – закупорьте.
2. Если в руках у вас жидкое – не разлейте, порошкообразное – не рассыпьте, газообразное – не выпустите наружу.
3. Если включили – выключите.
4. Если открыли – закройте.
5. Если разобрали – соберите.
6. Если вы не можете собрать – позовите на помощь умельца.
7. Если вы не разбирали – не вздумайте собирать.
8. Если вы одолжили что-либо – верните.
9. Если вы пользуетесь чем-либо – держите в чистоте и порядке.
10. Если вы привели что-либо в беспорядок – восстановите статус-кво.
11. Если вы сдвинули что-либо – верните на место.
12. Если вы хотите воспользоваться чем-либо, принадлежащим другому, – попросите разрешение.
13. Если вы не знаете, как это действует, – ради Бога не трогайте! 14. Если вас не касается – не вмешивайтесь.
Курьезные случаи из жизни ученых-химиков .Менделеев — чемоданных дел мастер
Известно ли Тебе, что всемирно известный русский химик Дмитрий Иванович Менделеев любил изготавливать рамки для портретов, с удовольствием переплетал книги и... делал чемоданы? Однажды выбирая необходимый товар для будущих шедевров, он услышал, как один покупатель спрашивал о нем.
— Кто этот почтенный господин?
— Как? Вы не в курсе? Знать нужно таких людей, — с уважением сказал приказчик. — Это Менделеев — чемоданных дел мастер.
Как профессор Зинин студентов наказывал
Это сейчас учитель и кричать на учеников не имеет права, а раньше преподавателю разрешалось даже дать студенту подзатыльник. Так профессор Казанского университета в России Николай Николаевич Зинин не только ругал недобросовестных учеников, но и мог порядочно выпороть. Студенты не обижались на академика, ведь разрешено было дать профессору сдачи — взять некий реванш. Однако осмелиться на подобное желающих не было: Зинин был настолько сильным и мог так сжать виновника его раздражения в объятиях, что тот еще долго не мог опомниться.
В один из дней 1837 г. в подвале частного пансиона в Казани раздался оглушительный взрыв. Виновником его оказался воспитанник Саша Бутлеров, увлекавшийся химией и в тайне от начальства превративший подвал в свою «лабораторию». За это он был посажен в карцер и по мудрому решению педагогического совета был выведен в столовую с повешенной на груди доской, на которой крупными буквами было написано: «ВЕЛИКИЙ ХИМИК». Придумывая эту ироничную надпись, незадачливые воспитатели Саши не допускали, конечно, и мысли, что она может стать пророческой, что заклейменный ею «нарушитель пансионных правил» станет действительно великим химиком – Александром Михайловичем Бутлеровым
Однажды на камзоле Ломоносова продырявились локти. Повстречавший его друг ехидно заметил по этому поводу:
– Ученость выглядывает оттуда...
– Нисколько, сударь, – немедленно ответил Ломоносов, – глупость заглядывает туда
Контрольная работа по теме: 8 класс
«Растворение. Растворы. Свойства растворов электролитов»
Задание 1 Даны уравнения.
Вариант 1: Вариант 2
1) FeO + 2H+ = H2O + Fe2+ 1) H2SiO3 + 2OH-= 2H2O +SiO2-3
2) 2H+ + Cu(OH)2 = Cu2+ 2H2O 2) H++ OH- = H2O
3) SiO2-3 + 2H+= H2SiO3 3) Cu2+ + 2OH- = Cu(OH)2
4) 2H+ + CO2-3 = CO2 + H2O 4) SO2 + 2OH- = SO2-3 +H2O
5) Zn0 + 2H+ = Zn2+ + H02 5) NH+4 + OH- = NH3 +H2O
1-й уровень а) Свойства какого класса электролитов описаны этими ионными уравнениями? б) Для любого из приведенных ионных уравнений запишите два молекулярных уравнения.
2-й уровень
1) FeO + 2H+ = 1) H2SiO3 + 2OH-=
2) 2H+ + Cu(OH)2 = Cu2+ 2H2O 2) H++ OH- = H2O
3) SiO2-3 + 2H+= 3) Cu2+ + 2OH- =
4) 2H+ + CO2-3 = CO2 + H2O 4) SO2 + 2OH- = SO2-3 +H2O
5) Zn0 + 2H+ = 5) NH+4 + OH- =
а).Закончить ионные уравнения. б) Для одного из законченных и одного из незаконченных в задании ионных уравнений запишите по одному молекулярному уравнению
3-й уровень
Приложение 7. продолжение.1Вариант 1: Вариант 2
1) FeO + 2H+ = 1) H2SiO3 + 2OH-=
2) 2H+ + Cu(OH)2 = 2) H++ OH- = H2O
3) SiO2-3 + 2H+= 3) Cu2+ + 2OH- =
4) 2H+ + CO2-3 = 4) SO2 + 2OH- =
5) Zn0 + 2H+ = 5) NH+4 + OH- =
а)Свойства какого класса электролитов описаны этими ионными уравнениями? б) Закончить ионные уравнения.в) Конкретизируйте их молекулярными уравнениями.
Задание 2 Даны переходы
Вариант 1: Ca - CaO -- Ca(OH)2 -- Ca(NO3)2
Вариант 2: S --- SO2 --- H2SO3 ---K2SO3
1-й уровень а) Генетический ряд какого элемента описан цепочкой превращений? б) Запишите молекулярные уравнения переходов. в) Рассмотрите 1-й переход в свете ОВР,а последний – в свете ТЭД
2-й уровень
Вариант 1: Ca - CaO -- Ca(OH)2 -- Ca(NO3)2 --- CaCO3
Вариант 2: S --- SO2 --- H2SO3 ---K2SO3 ---SO2
а) Генетический ряд какого элемента описан цепочкой превращений? б) Запишите молекулярные уравнения переходов. в) Рассмотрите 1-й переход в свете ОВР,а последний – в свете ТЭД
3-й уровень Вариант 1: Cu --- ____- -- CuSO4 -- Cu(OH)2 -- _____ -----Cu
Вариант 2: Si---- ____ -----Na2SiO3 ---____ ---- SiO2 -----Si
Приложение 7. продолжение.2а) Генетический ряд какого элемента описан цепочкой превращений? б) Заполните пропуски звеньев в этой цепочке. в) Запишите молекулярные уравнения переходов г) Там, где это имеет место, рассмотрите уравнения в свете ОВР и в свете ТЭД.
Задание 3 (дополнительное) Предложите: а) по одному (1-й уровень) б) по два (2-й уровень) в) по три (3-й уровень) ионных и молекулярных уравнений качественных реакций для Вариант 1: Сульфата железа (III) Вариант 2: Хлорида бария
Контрольная работа по теме: «Неметаллы» 9класс
Задание 1
Запишите уравнения реакций переходов:
1-й уровень. Вариант 1: S--- FeS---- SO2----- SO3---- H2SO4 ---- BaSO4.
Вариант 2: N2 NH3 NO NO2 HNO3 Cu(NO3)2.
Вариант 3: C CH4 CO2 CaCO3 Ca(HCO3)2 CaCO3 CaO
Вариант 4: Si Mg2Si SiO2 Na2SiO3 H2SiO3 SiO2 Si
2-й уровень – Вариант 1: S FeS SO2 SO3 _______ BaSO4.
Вариант 2: N2 NH3 NO NO2 _____ Cu(NO3)2.
Вариант 3: C CH4 CO2 CaCO3 Ca(HCO3)2 _____ CaO
Вариант 4: Si Mg2Si SiO2 Na2SiO3 H2SiO3 _____ Si Рассмотреть первый переход в свете ОВР, а последний в свете ТЭД
3-й уровень Вариант 1: S FeS SO2 SO3 _______ BaSO4.
Вариант 2: N2 NH3 NO NO2 _____ Cu(NO3)2.
Вариант 3: C CH4 CO2 CaCO3 Ca(HCO3)2 _____ CaO
Вариант 4: Si Mg2Si SiO2 Na2SiO3 H2SiO3 _____ Si Каждый переход рассмотреть в свете ОВР и ТЭД (где это имеет место).
Приложение 7. продолжение.3Задание 2 Дать полную характеристику реакции и рассмотреть условия смещения равновесия вправо:
Вариант 1: N2 + 3H2 = 2NH3 + Q
Вариант 2: 2NO + O2 = 2NO2 + Q
Вариант 3: CO2 + Cтв. = 2CO
Вариант 4: H2O(пар) + CO = H2 + CO2
Задание 3 Уравнять схему ОВР методом электронного баланса:
1-й уровень – Вариант 1: Cu + HNO3(разб.) – Cu(NO3)2 + NO + H2O
Вариант 2: Cu + HNO3(конц.) – Cu(NO3)2 + NO2 + H2O В
ариант 3: H2SO4(конц.) + Zn - ZnSO4 + H2S + H2O
Вариант 4: NH3 +CuO - H2O + Cu
2-й уровень - Вариант 1: Cu + HNO3(разб.) – Cu(NO3)2 + _____ + H2O
Вариант 2: Cu + HNO3(конц.) – Cu(NO3)2 + ____ + H2O
Вариант 3: H2SO4(конц.) + Zn - ZnSO4 + _____ + H2O
Вариант 4: NH3 +CuO - ____ + Cu
3-й уровень - Вариант 1: Cu + HNO3(разб.) –
Вариант 2: Cu + HNO3(конц.) –
Вариант 3: H2SO4(конц.) + Zn –
Вариант 4: NH3 +CuO –
Задание 4 (задача на избыток одного из продуктов реакции) 1-й уровень – Для синтеза хлороводорода взяли 200 л. водорода и 250л. хлора. Какие газы и в каком объеме останутся в сосуде после реакции? 2-й уровень - В 730 мл. 20%-ного раствора соляной кислоты растворили 67,2 мл. аммиака. Сколько миллиграммов хлорида аммония образовалось при этом? 3-й уровень - Какой объем углекислого газа образуется
Приложение 7. продолжение.4при взаимодействии 1260 кг. 30%-ного раствора азотной кислоты с 250 кг. известняка, содержащего 20% примесей, если выход углекислого газа, составляет 75 % от теоретически возможного?
Контрольная работа по теме: «Металлы» 9класс
Задание 1 Запишите уравнения реакций, характеризующих свойства:
Вариант 1: Na Вариант 2: Ca Вариант 3: Al Вариант 4: Fe
1-й уровень Написать уравнение с неметаллом (галогеном), для щелочного и щелочноземельного металлов - с водой, для Аl и Fe с растворами кислот и солей. Рассмотреть одно уравнение в свете ОВР или в свете ТЭД.
2-й уровень Написать уравнение с кислородом, серой, галогеном, привести уравнения реакции для алюмотермии, для щелочного и щелочноземельного металлов - с водой, для Аl и Fe с растворами кислот и солей. Рассмотреть два уравнение в свете ОВР или в свете ТЭД.
3-й уровень Написать уравнение с кислородом, серой, галогеном, привести уравнения реакции для алюмотермии, для щелочного и щелочноземельного металлов - с водой, для Аl и Fe с растворами кислот и солей. Рассмотреть двсе уравнения реакции в свете ОВР и в свете ТЭД. (для кислот и солей)
Задание 2 Запишите уравнения реакций для переходов:
1-й уровень Вариант 1: Ca - CaO -- Ca(OH)2 -- Ca(NO3)2 -- Ca(PO4)2
Вариант 2: Al -- Al2O3 -- AlCl3 -- Al(OH)3 -- Na3AlO3 -- Al(NO3)3
Вариант 3: Fe -- FeCl2 -- Fe(NO3)2 – Fe(OH)2 – FeO -- Fe
Вариант 4: Fe -- FeCl3 -- Fe(OH)3 – Fe2O3 -- Fe --FeS Рассмотреть по одной реакции в свете ОВР и ТЭД
2-й уровень Вариант 1: Ca - CaO -- ________-- Ca(NO3)2 -- Ca(PO4)2
Вариант 2: Al -- ______ -- AlCl3 -- Al(OH)3 -- Na3AlO3 -- Al(NO3)3
Вариант 3: Fe -- FeCl2 -- Fe(NO3)2 –______– FeO -- Fe
Приложение 7. продолжение.5
Вариант 4: Fe -- FeCl3 --________– Fe2O3 -- Fe --FeS Рассмотреть по две реакции в свете ОВР и ТЭД
3-й уровень Вариант 1: Ca - CaO -- _______-- Ca(NO3)2 -- Ca(PO4)2
Вариант 2: Al -- ______ -- AlCl3 -- Al(OH)3 -- Na3AlO3 -- Al(NO3)3
Вариант 3: Fe -- FeCl2 -- Fe(NO3)2 –______– FeO – Fe
Вариант 4: Fe -- FeCl3 --________– Fe2O3 -- Fe --FeS Рассмотреть все возможные реакции в свете ОВР и ТЭД.
Задание 3 (задача на выход продукта реакции)
1-й уровень – Вариант 1: При взаимодействии 23 г натрия с водой было получено 10 л водорода. Сколько это составляет процентов от теоретически возможного ?
Вариант 2: Какой объем углекислого газа пропустили через «известковую воду» Если при этом выпало 15 г осадка, что составляет 75% от теоретически возможного.
2-й уровень - Вариант 1: При взаимодействии 23 г натрия с водой было получено 10 л водорода. Сколько это составляет процентов от теоретически возможного ? Какое количество щелочи при этом образовалось?
Вариант 2: Какой объем углекислого газа пропустили через «известковую воду» Если при этом выпало 15 г осадка, что составляет 75% от теоретически возможного. Какое количество гидроксида кальция вступило при этом в реакцию?
3-й уровень - Вариант 1: При взаимодействии 23 г натрия, содержащего 10% примесей с водой было получено 10 л водорода. Сколько это составляет процентов от теоретически возможного ? Какое количество щелочи при этом образовалось?
Вариант 2: Какой объем углекислого газа пропустили через «известковую воду» Если при этом выпало 15 г осадка, что составляет 75% от теоретически возможного. Сколько граммов 2% гидроксида кальция потребовалось для реакции?
Щелочные металлы (9 класс)
1 уровень
1. Щелочные металлы проявляют степень окисления:
а) + 1 б) + 2 в) + 3.
2. В ряду Li → Na →K →Rb →Cs металлические свойства:
а) увеличиваются б) уменьшаются в) не изменяются.
3. В ряду K → Na → Li плотность:
а) уменьшается б) увеличивается в) не изменяется.
4. Щелочные металлы встречаются в природе:
а) в свободном виде б) в составе оксидов в) в составе солей.
5. Щелочными металлами являются:
а) Ca б) К в)Cu г) Li.
2 уровень
6. Атомный радиус у щелочных металлов сверху вниз в группе:
а) увеличивается б) уменьшается в) не изменяется.
7. Электронная формула атома 1s22s22p63s1 соответствует
элементу:
а) Li б) Na в) К.
8. В ряду элементов K → Na → Li электроотрицательность:
а) не изменяется б) увеличивается в) уменьшается.3 уровень
9. Электронной конфигурации иона К+ соответствует формула:
а) 1s22s22p63s1 б) 1s22s22p63s23p64s1 в) 1s22s22p63s23p6.
10. Все элементы семейства щелочных металлов относятся к:
а) р – элементам б) s – элементам в) d – элементам.
Азотная кислота (9 класс)
1 уровень
1. Среди предложенных формула азотной кислоты:
а) HNO2 б) HNO3 в) H2N2O2
2. Степень окисления азота в азотной кислоте:
а) + 3 б) +4 в) + 5
3. В молекуле азотной кислоты присутствует связь:
Приложение 7. продолжение7
а) ковалентная б) ионная в) металлическая
4.При растворении в воде азотная кислота диссоциирует с образованием:
а) Н + б) Н2О в) ОН-
2 уровень
5. Проявляя свойства кислот, азотная кислота может взаимодействовать с:
а) Cu(OH)2 б) CO2 в) K2CO3 г) H2SO4
6. При взаимодействии с неметаллами азотная кислота всегда:
а) восстановитель б) окислитель в) пассивирующее веществ
7. Концентрированная азотная кислота при обычных условиях не реагирует с:
а) Fe б) Ag в) Al г) Сu
3 уровень
8. Взаимодействие медной стружки с разбавленной азотной кислотой приводит к образованию газа:
а) N2O б) NO в) NO2 г) NH3
9. Сырьём для производства азотной кислоты является:
а) азот, полученный перегонкой воздуха б) аммиак в) оксид азота (v)
Домашнее задание (дифференцированное)
1 уровень: Записи в тетрадях повторить. Переписать в тетрадь данные реакции, расставить коэффициенты, указать тип реакций.
1.C + O2 → CO2
2.Fe(OH)3 + HCl → FeCl3 + H2O
3.KMnO4 = K2MnO4 + MnO2 + O2
4.Ca + HCl → CaCl2 + H2
2 уровень: Записи в тетрадях повторить. Проанализировать химические реакции, с которыми мы сталкиваемся в быту (составить уравнения реакций и определить их тип)
3 уровень: Проверим закон сохранения массы веществ После сжигания свечи, уравновешенной на весах, чаша весов со свечой поднимается вверх:
Приложение 7 -продолжение 8
А) можно ли утверждать, что закон сохранения массы нарушен?
Реакции ионного обмена
Составьте ионные уравнения
1 уровень NaOH + HNO3 = NaNO3 + H2O
Ca(OH)2 + 2HCl = CaCl2 +2H2O
KOH + H2SO4 = K2SO4 + 2H2O
2 уровень. Na2CO3 + CaCl2= CaCO3 + NaCl
BaCl2 + K2SO4 = BaSO4 + KCl
Ag2SO4 + Na3PO4 Ag3PO4 + Na2SO4
3 уровень Напишите полные и сокращенные ионные уравнения реакций между растворами :
а) сульфата железа (II) и гидроксида натрия б) фосфата натрия и хлорида кальция; в) сульфата алюминия и гидроксида калия
по теме «Строение электронных оболочек атомов». Химический элемент -_____№_________.
Задания.
1. Запишем знак химического элемента, внизу укажем порядковый номер. ________________________________________________________________________________
2.Как произносится химический символ ______________________________________________
Приложение 7. продолжение.9 3.Определите количество p+________________________________________________________ e-________________________________________________________ по порядковому номеру элемента.
4. Определите число энергетических уровней в электронной оболочке по номеру периода. ________________________________________________________________________
5. Нарисовать рядом со знаком химического элемента столько же дуг.
6. Определим по номеру группы число электронов на внешнем энергетическом уровне, запишем его под последней дугой.
7. Определите число электронов на оставшихся энергетических уровнях, (на 1-м – не более двух, на 2-м – не больше восьми, на третьем не больше -18.) Ставим эти числа под соответствующими дугами.
8.Схема строения атома готова. ________________________________________________________________________________9. Определите количество подуровней на вашем уровне. Подуровни обозначают буквами s, p, d, f.
| Номер энергетического уровня | Подуровни энергии |
| 1 | s (один подуровень) |
| 2 | s, p (два подуровня) |
| 3 | s, p, d (три подуровня) |
| 4 | s, p, d, f (четыре подуровня) |
10. Далее превращаем схему в формулу: каждая дуга-уровень, обозначается большой цифрой 1,2,3,4; подуровни обозначаются буквами s,p,d,f, а число электронов на них верхними индексами (см. таблицу).
11.Внешний уровень можно представить электронно-графической формулой, на которой каждая орбиталь показана клеткой, а электроны – стрелками. На одной орбитали не может находиться более двух электронов, так как они отталкиваются друг от друга.
12. 1. Изобразите строение атома следующего элемента._______________________ (Элемент третье группы)
ЗАДАЧИ
1-уровень
1. Какой объем (н.у.) углекислого газа можно получить из 55, 5 г. мрамора, содержащего 10% некарбонатных примесей?
2.Определите массовую долю 16 г NaOH в 200 г раствора.
2-уровень
1. Мрамор, содержащий 10-% некарбонатных примесей, обработали избытком соляной кислоты. Полученный газ пропустили через известковую воду, при этом образовалось 5 г. осадка. Чему равна масса взятого мрамора?
2. Из 320 5% - ного раствора гидроксида натрия выпарили 120 г воды. Какой стала массовая для гидроксида натрия в растворе?
3 уровень.
2.Из 320 5% - ного раствора гидроксида натрия выпарили 120 г воды. Какой стала массовая для гидроксида натрия в растворе? Сколько молекул воды выпарили?
Приложение 8.
Тест по теме: «Оксиды, кислоты, основания, соли».
(средний уровень)
1. Какое из веществ имеет запах?
а) H2SiO3 в) H3PO4
б) H2SO4 г) HCl
2. Выберите формулу кислоты соответствующей SO2 :
а) H2SO3 в) H2SO4
б) HNO3 г) H2CO3
3. Реакция получения щелочи:
а) железо + вода в) алюминий + вода
б) натрий + вода г) цинк + вода
4. Какая реакция является реакцией нейтрализации:
а) NaCl + H2SO4 в) NaOH + HCl
б) CuO + HNO3 г) Zn + HCl
5. В какой цвет окрашивают кислоты индикатор лакмус:
а) жёлтый в) синий
б) красный г) малиновый
6. Какое вещество взаимодействует с соляной кислотой и в результате выделяется водород:
а) сера в) серебро
б) кремний г) магний
Приложение №8 продолжение 1
7. Что такое силикаты?
а) соли кремниевой кислоты в) соединения кремния с кислородом
б) соли угольной кислоты г) соединения кремния с углеродом
8. В какой цвет окрашивает лакмус в растворе щелочи:
а) малиновый в) синий
б) не меняется г) красный
9. Какой гидроксид является щелочью:
а) гидроксид меди в) гидроксид кальция
б) гидроксид цинка г) гидроксид железа
10. Какое вещество может реагировать с раствором гидроксида кальция:
а) сульфат бария в) оксид цинка
б) углекислый газ г) хлорид натрия
11. Вещество, существующее в природе в трёх агрегатных состояниях:
а) поваренная соль в) вода
б) песок г) сахар
Приложение 8, продолжение2
Тест по теме: «Оксиды, кислоты, основания, соли».
(высокий уровень)
1. Какой газ обладает наименьшей молекулярной массой?
а) кислород в) хлор
б) азот г) водород
2. Какой газ выделяется при взаимодействии активных металлов с обычными кислотами?
а) водород в) сероводород
б) кислород г) хлор
3. Какой оксид не взаимодействует с водой?
а) оксид фосфора в) оксид меди
б) оксид бария г) оксид кальция
4. Водород, как простое вещество при обычных условиях представляет собой:
а) газ в) плазму
б) жидкость г) кристаллы
5, Какое вещество не взаимодействует с соляной кислотой?
а) Cu(OH)2 в) CuO
б) Cu г) CaCO3
6. Как называются нормальные (средние) соли серной кислоты?
а) сульфиды в) сульфаты
б) сульфиты г) гидросульфаты
7. Что образуется при взаимодействии алюминия с хлором?
а) AlCl2 в) AlCl3
б) Al(OH)3 г) Al2O3
8. Какая схема уравнения реакции неосуществима?
а) водород + кислород в) водород + сера
б) водород + хлор г) водород + вода
Приложение №8 продолжение3
9. Как называется реакция 2KOH + H2SO4 K2SO4 + 2H2O
а) окисления в) замещения
б) нейтрализации г) соединения
10. Реакция получения щёлочи:
а) Al + H2O в) Mg + HCl
б) Fe + H2O г) Na + H2O
11. Какое вещество является основанием:
а) CuO в) Fe(OH)2
б) HNO3 г) P2O5
12. Гидроксид калия можно получить по реакции:
а) K2O + H2O в) K2SO4 + H2O
б) K + HCl г) Cu(OH)2 + KCl
13. Какой из гидроксидов растворим в воде?
а) Cu(OH)2 в) Ca(OH)2
б) Zn(OH)2 г) Fe(OH)2
14. При нагревании легко разлагается:
а) гидроксид калия в) гидроксид натрия
б) гидроксид кальция г) гидроксид меди
15. Какое вещество реагирует с Cu(OH)2
а) NaOH в) NaCl
б) HCl г) KOH
16. Какой металл взаимодействует с соляной кислотой и выделяется водород?
а) медь в) золото
б) цинк г) серебро
Приложение №8 продолжение4
(У учащихся на столах листочки с заданием, они выполняют работу в парах).
Определите, в главных подгруппах каких групп периодической системы находятся химические элементы, электронные схемы атомов которых приведены в первом столбце таблицы. Буквы, соответствующие правильным ответам, дадут название стране.
| Электронные схемы | Группы | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 2е 4е | Щ | Ж | Э | Х | А | Б | У |
| 2е 8е 2е | В | И | К | М | Н | О | П |
| 2е 1е | М | С | Ы | Ф | Ю | А | Я |
| 2е 8е 5е | Р | Б | Т | В | И | Е | Г |
| 2е 8е 1е | Ч | Д | Ж | И | К | З | М |
| 2е 8е 7е | Л | О | В | Н | У | П | Е |
| 2е 8е 3е | Р | Т | С | Х | Ц | Ч | Ф |
| 2е 3е | Щ | Ы | К | Э | М | Н | К |
| 2е 8е 6е | О | Я | А | В | С | И | О |
| 2е 5е | Ю | П | Р | М | Й | В | Х |
Игра.
Лишнее вещество.
а) SO3, HNO3, FeO, K2O, CO2, CuO.
(лишнее HNO3, т.к. оксиды)
б) HNO3, H2SO4, Al(OH)3, HCl, H3PO4, H2CO3.
(лишнее Al(OH)3, т.к. кислоты)
в) Zn(OH)2, KOH, Fe(OH)2, Ba, NaOH, Ba(OH)2.
(лишнее Ba, т.к. основания)
г) KNO3, FeSO4, NaCl, Al2S3, BaO, CaCO3
(лишнее BaO, т.к. соли)
Сколько нас? И как нас зовут?
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 1 | N | B | Br | Na | K | P | Mg | Hg | C | Au |
| 2 | Zn | Na | O | H | O | Hg | C | Ag | Na | Fe |
| 3 | F | Cl | S | C | Au | P | Hg | Ba | H | P |
| 4 | Al | B | P | Br | Hg | I | C | K | Na | Ca |
| 5 | O | Si | C | Mg | Mn | Na | Cu | Hg | P | Pb |
| 6 | S | Na | F | Zn | Hg | Fe | Al | C | P | Ba |
Приложение 9 -продолжение 1
Учащиеся должны найти элементы с указанными номерами в таблице и записать в пустые клетки под цифрами первые буквы из названий.
Для команды 8 класса.
| 24 | 49 | 12 | 49 |
| 63 | 16 | 19 | 49 | 63 |
| 88 | 63 | 18 | 19 | 52 | 49 | 74 |
|
| 11 | 18 |
|
|
|
|
| ч |
|
|
|
|
|
|
|
|
|
|
|
|
| ы |
|
|
|
Для команды 9 класса.
| 74 | 19 |
| 16 |
| 84 | 88 | 76 | 5 | 76 | 74 | 18 | 52 |
|
| 11 | 63 | 3 |
| 79 |
|
|
|
|
| у |
|
|
|
|
|
|
|
|
|
| ь |
|
|
|
| ь |
| я | ! |
Правильный ответ: ХИМИЧЕСКИЕ РЕАКТИВЫ НА ВКУС ПРОБОВАТЬ НЕЛЬЗЯ!
Номинация "А вам слабо"
1 - Назовите химическое вещество, которое может впитывать в себя любую энергию и в последствии её передавать живым объектам (вода)
2 - Известный русский химик, создавший закон сохранения массы веществ (М.В.Ломоносов)
3 - В 1901 году он стал первым лауреатом Нобелевской премии, создав правило для контроля за химическим равновесием (ЛеШателье)
4 - В 1903 году Нобелевская премия присуждена итальянскому химику, создавшему теорию электролитической диссоциации (Аррениус)
5 - Выдающийся русский химик - создатель учебника "Основы химии" (Д,И,Менделеев)
Номинация "Лечебные элементы"
1 - Необходим в составе костей скелета (кальций)
2 - Дезинфектор ран (йод)
3 - Избыток ионов этого элемента может вызвать жажду и даже обезвоживание организма (натрий)
4 - Он необходим для сохранения в норме эмали зубов человека (фтор)
5 - Входит в состав известного витамина, необходимого в весеннее время (углерод)
Приложение 9 -продолжение 2
Кто быстрей найдет соответствие
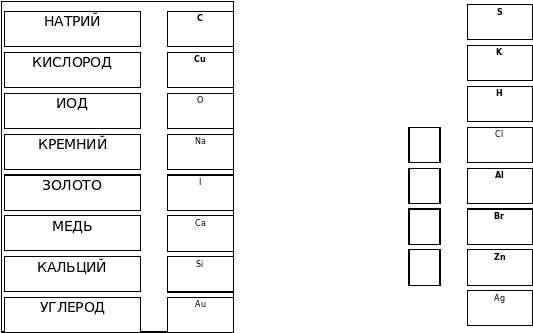
Определить, о каком простом веществе идет речь:
а) Иду на мелкую монету,
В колокола люблю звенеть,
Мне ставят памятник за это
И знают имя моё - …………(медь)
б) Предупреждаю я заранее,
Что не пригоден для дыхания!
А все как будто бы не слышат
И постоянно мною дышат.
Я главный в воздухе, так вот
Легко назвать меня?..................(азот)
в) Я- светоносный элемент
Я спичку вам зажгу в момент,
Сгореть смогу и под водой,
Оксид в ней станет кислотой. (фосфор)
г) Корабли меня обходят
Знает лоцман наизусть
Если Л на Д заменят
То металлом окажусь. (мель-медь)
Я известная отрава,
Даже имя говорит,
Что я страшно ядовит! (бром)
стихи Степана Щипачёва
«… Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Всё – от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой,
Строй менделеевской системы строгий.
Вокруг тебя творится мир живой.
Входи в него, вдыхай, руками трогай».
Брюсова «Мир электрона» :
Быть может, эти электроны — Миры, где пять материков.
Искусства, званья, воины, троны И тпамять сорока веков.
Еще, быть может, каждый атом —
Вселенная, где сто планет; Там все, что здесь, в объеме сжатом,
Но также то, чего здесь нет.
Приложение 11
ПРОЕКТИРОВАНИЕ урока химии в соответствии с ФГОС
1. Общая информация
| 1.1. Ф.И.О. учителя Щенникова Светлана Викторовна | |||
| 1.2. Дата: (ДД/ММ/ГГ | |||
| 1.3. Продолжительность урока (в минутах): 45 | |||
| 1.4. Ступень / Класс: 8 | |||
| 1.5. Предмет / Курс: Химия | |||
| 1.6. Место (а) проведения урока 1 | |||
| 1 Обычная классная комната Классный кабинет 2 Компьютерная лаборатория | 3 Специально оборудованный кабинет по предмету 4 Другое (уточните): | ||
| 1.7. Количество уч-ся: – 9 | 1.9. Количество мальчиков: – 6 | 1.10. Количество девочек: – 3 | |
| 1.8. Тема / цели / задачи урока: Оксиды (тип урока открытия новых знаний) Цель: обучающие:формирование у обучающихся представления о классе оксидов, имение их называть и классифицировать; развивающие: развитие умения анализировать, сравнивать, обобщать, делать выводы, развивать внимание; воспитывающие: развитие мотивации к предмету химия, воспитание ответственного и бережного отношения к окружающей среде
Задачи: 1. Ввести понятия оксидов, как сложных бинарных соединений; их признаки, классификацию 2.Познакомить с формулами важнейших оксидов. 3. Отрабатывать умения записывать и читать формулы оксидов. 4. Тренироваться в составлении молекулярных формул оксидов. 5. Уметь выделять оксиды среди других классов веществ и выделять оксиды металлов по их признакам. 6. Отрабатывать умения работы по алгоритму, поиска информации с использованием электронных ресурсов: словарей, справочников 7. Формировать учебные навыки систематизации учебного материала через заполнение таблиц, составление схем.
| |||
2. Организация и Структура урока
2.1. Организация рабочего пространства
Опишите кратко, если нужно, сделайте поясняющий рисунок:
Какие зоны, считаете целесообразным выделить в классе? Как расставите столы и рассадите учеников?
| 2.1 Организация рабочего пространства
|
2.2. Организация учебной деятельности на уроке
| Этап урока | Учебная деятельность уч-ся (УД) | Учебно-познавательные и учебно-практические задачи | Деятельность учителя (роль) | ||||||||||||
| Организационный момент | приветствует учеников, определяет готовность к уроку, определяет отсутствующих, позитивный настрой. Выдается инструкция, демонстрирует коллекцию оксидов | | |||||||||||||
| Проверка домашних заданий, опрос, организация обратной связи с темой / проблемой урока | Работа Проверяют в тетрадях домашнюю работу, сверяя с записью на доске, исправляют, задают вопросы. Один ученик отвечает у доски. Виды УД индивидуальная | освоение знаний | приобретение знаний + | разрешение проблем | сотрудничество + | коммуникация + | самоорганизация и саморегуляция | навык рефлексии | ценностно-смысловые установки | ИКТ-компетентность | Контроль и корректировнка домашнего задания | ||||
| Проблематизация, актуализация, мотивация учебной деятельности. | Работа Ссегодня тема нашего урока. А вот это мы узнаем, когда отгадаем кроссворд. (Приложение №1). На эту работу у нас отводится 3 мин. Разгадают кроссворд и правильно впишут названия металлов и неметаллов. Выделяют металлы и неметаллы, заполняют таблицу.Слайд№4 Обсуждают, находят основания для исключения лишнего, исключают лишнее. Дают обоснованный ответ. Формулируют тему урока. Предположительный ответ – оксиды. Виды УД Вы работаете в парах, помогая, друг другу и индивидуально. | познавательные формируем умение самостоятельно выделять и формулировать познавательную цель Коммуникативные формируем умение оформлять свои мысли в устной форме, умение взаимодействовать друг с другом Личностные формируем учебно-познавательный интерес к новому учебному материалу Регулятивные. Уметь самостоятельно обнаруживать и формулировать учебную проблему, определять цель, составлять план решения проблемы. | ИКТ-компетентность Слайд №3 №4 | Предлагает разгадать кроссворд. Дает установку на работу в парах на основе полученной информации предлагает сделать вывод, о каком классе веществ идет речь, таким образом, определяя тему урока.
| |||||||||||
| Первичное ознакомление / освоение / изучение материала | Работа Слушают учителя. Работают по конспекту, дают определения и находят общие признаки оксидов. Учатся читать и называть оксиды. формулируют определение данного класса
Предположительный ответ: оксиды – этосложные вещества, состоящие из двух элементов, одним из которых является кислород со степенью окисления -2.
Заполняют опорный конспект. (приложение) Виды УД индивидуальная Предполагаемый результат Дадут определение и выделят признаки оксидов. Вспомнят, как читаются и называются оксиды. | Познавательные Уметь добывать новые знания: находить ответы на вопросы, используя учебник, свой жизненный опыт и информацию, полученную на уроке. Коммуникативные Уметь оформлятьсвои мысли в устной форме; слушать и понимать речь других (обучение в сотрудничестве). | ИКТ-компетентность слайд №5 №6 | Демонстрирует слайд №5 опорный конспект. Рассказывает, задаёт вопросы. Мы определили класс веществ, с которыми будем работать на сегодняшнем уроке. Давайте попытаемся дать определение оксидам. Проверим себя (слайд 5. | |||||||||||
| Освоение, отработка, закрепление материала Обратная связь
| Работа Для систематизации и обобщения полученных знаний предлагает выполнить задание (слайдов №7-10). Виды УД Работают в группах по два человека Предполагаемый результат Правильно выделят оксиды среди других классов веществ. Демонстрируют умения правильно читать и называть оксиды | коммуникативные формируем умение слушать и понимать других, работать в парах учитывая позицию собеседника Познавательные формируем умение работать с новой информацией по теме (отбирать, выделять, обобщат | ИКТ-компетентность | Организует работу учащихся в парах. Просматривает записи в тетрадях | |||||||||||
| Применение изученного, систематизация, обобщение Подведение итогов Обратная связь | Работа 1. группы участвуют в игре “Крестики нолики”, находят выигрышный путь, объясняя свой выбор.слайд №11 2. группа проходит тестирование на компьютере.Слайд №12 Виды УД групповая индивидуальная | познавательные: общеучебные: умение структурировать знания; оценка процесса и результатов деятельности.
коммуникативные умение выражать свои мысли.
регулятивные: волевая саморегуляция; | ИКТ-компетентность Слайды с №12 | Делит класс на две группы. Даёт задания,слайд №12.Контролирует, корректирует выполнение учащимися задания. Проводит смену заданий. | |||||||||||
| Задание на дом | Записывают задание в дневник.§18 упр. 5, 1 стр. 97 | Записывает домашнее задание на доске, даёт пояснения. | |||||||||||||
| Подведение итогов урока. Рефлексия | Инициировать рефлексию детей по их собственной деятельности и взаимодействия с учителем и другими детьми в классе Подведем итоги нашей работы. Вспомните, какую цель мы поставили в начале урока? Как вы считаете, достигли ли мы целей? А теперь оцените свою деятельность на уроке. Ответьте на предложенные вопросы. Что изучали сегодня на уроке? Кто желает сформулировать определение оксидов. На какие группы делятся оксиды? Коррекция самооценок, самоанализа, выставление оценок. -приложение №2 Проводят рефлексию по алгоритму. Отвечают на вопросы и проводят самооценку по критериям. Сдают учителю. Регулятивные УУД. Уметь оценивать правильность выполнения действия на уровне адекватной ретроспективной оценки. Личностные УУД. Способность к самооценке на основе критерия успешности учебной деятельности. Оценивать жизненные ситуации с точки зрения безопасного образа жизни и сохранения здоровья | Организует рефлексию | |||||||||||||
Приложение 1. Кроссворд
| 1 |
|
|
|
| ||||
| 2 |
|
|
|
|
|
| ||
|
| 3 |
|
|
| ||||
|
| 4 |
|
|
|
| |||
| 5 |
|
|
|
| ||||
1) Воздух состоит из этого Х.Э.
2 )Х.Э входящий в состав сплавов, имеющий в ядре атома 28 протонов 21 нейтронов
3) Электронная конфигурация 2S2 2p6 3S2 3p4 4) Этот Х.Э. Создаёт защитную плёнку для покрытия других металлов.
5) Х.Э первой группы, главной подгруппы который горит в порах серы. 6) Х.Э. латинское название арсениум.
Приложение №2 Инструкция
Ф.И. _________________________
| Основные этапы урока | Время (минуты) | Вид работы | Правила выполнения | Оценка (самооценка) |
| 1. Разгадывание кроссворда | 5 | парная | Используя электронный словарь, П.С.Х.Э. заполните кроссворд |
|
| 2. Заполнение таблицы. | 1 | индивидуальная | Выпишите отдельно в таблицу металлы и неметаллы. |
|
| 3. Изучение нового материала Опорный конспект. | 10 | фронтальная, парная, индивидуальная | Прослушайте. Рассказать напарнику. Записать в тетрадь. |
|
| 4. Определение лишнего вещества | 1 | парная | Исключите лишнее вещество. Обоснуйте ваш выбор |
|
| 5. Нахождение оксидов. | 1 | индивидуальная | Запишите формулы оксидов в тетрадь. Сверьте со слайдом №6. |
|
Тип урока. Изучение и первичное закрепление новых знаний.
Цель урока: обучающие: формирование у обучающихся представления о классе оксидов, имение их называть и классифицировать, формирование понятия оксиды, как бинарных соединений, ; развивающие: развитие умения анализировать, сравнивать, обобщать, делать выводы, развивать внимание; воспитывающие: развитие мотивации к предмету химия, воспитание ответственного и бережного отношения к окружающей среде
Задачи урока:
1. Ввести понятия оксидов, как сложных бинарных соединений; их признаки , классификацию
2.Познакомить с формулами важнейших оксидов.
3. Отрабатывать умения записывать и читать формулы оксидов.
4. Тренироваться в составлении молекулярных формул оксидов.
5.Уметь выделять оксиды среди других классов веществ и выделять оксиды металлов по их признакам.
6.Отрабатывать умения работы по алгоритму, поиска информации с использованием электронных ресурсов: словарей, справочников
7.Формировать учебные навыки систематизации учебного материала через заполнение таблиц, составление схем.
Форма проведения урока: индивидуальная и парная.
Оборудование: Инструкции, учебник, презентация, ПК, карточки, коллекция оксидов.
Ход урока
1). Здравствуйте! Сегодня тема нашего урока.... А вот это мы узнаем, когда отгадаем кроссворд. На эту работу у нас отводится 3 мин. Вы в парах, помогая, друг другу, впишите названия Х.Э. и найдите ключевое слово.
(Приложение 1)
2).Молодцы! Правильно оксиды.
Класс оксидов это да!
Ведь без них мы никуда..
Очень важная вода
Без неё кругом беда!
При строительстве идёт
Глина и песок
Ну а красный железняк
В металлургии мастак!
Загрязняют атмосферу,
Отравляют биосферу
Угарный и сернистый газ,
А винить то надо нас!
Чтоб природу не губить
Надо химию учить.
К концу урока их изучим
Новые сведения получим!
Сегодня к концу урока мы должны знать:
- определение оксидов и их классификацию.
- формулы важнейших оксидов
.
Уметь:
- выделять оксиды среди других классов веществ.
- читать и записывать формулы оксидов.
- составлять молекулярные формулы оксидов.
3). Теперь из этих Х.Э. выделим металлы и неметаллы и заполним таблицу.
Сверяем со слайдом. №4
4). Перед вами задание - на понимание!
Выделите лишнее вещество среди предложенных.
Постарайтесь объяснить свой выбор.
6). А сейчас у нас важный этап
Разобраться что и как...
Вам поможет опорный конспект.
Мы познакомимся с новым материалом. Вам надо прослушать, понять и запомнить так, чтобы смогли рассказать другому.
7). А теперь уберите опорный конспект и воспроизведите его в тетради, так как вам удобно в виде схемы, таблицы или просто словами.
8). Сверим со слайдом №5-6. Поставим себе отметку.
9). Ой, вы, дамы, господа!
Посмотрите все сюда!
Из перечня веществ выпишите в тетрадь оксиды и обоснуйте свой выбор.
10). Сверьте со слайдом №7-8. Поставьте себе оценку.
11). Тренинг "Проверь себя" проведём
Недостатки мы найдём.
Кто выполнит всё безошибочно,
тот ставит себе отлично. Слайд № 10
12). Устали? Отдохнём!
Давайте поиграем,
Металлы и неметаллы повспоминаем.
Я называю, если металл - 1 руку поднимаем. Неметалл - 2.
13). А кто выполнит это задание. Пройдёт и тестовое испытание.
14). Класс делим на 2 группы. 1 - проводит игру "Крестики - нолики"
2 - проходит тестирование. Затем меняются местами.
15). Запишем домашнее задание.
16). Подведем итоги урока. Проверим как заполнены инструкции. (Приложение 2)
На данном уроке используется ИКТ – подготовлена презентация, напечатаны карточки для оценки своих знаний, тесты, кроссворды, дети работают как индивидуально так и в парах.
© 2019, Щенникова Светлана Викторовна 5755 72
Рекомендуем курсы ПК и ППК для учителей
Похожие файлы
Полезное для учителя




















