Просмотр содержимого документа
«Составление электронных формул»
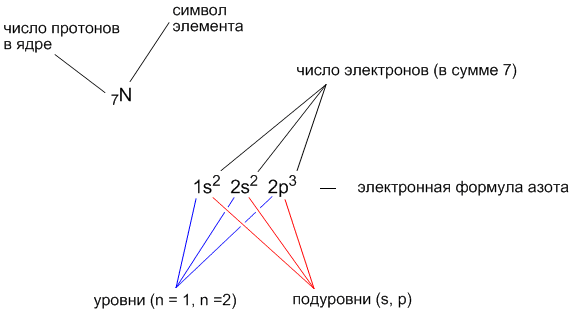
Под электронной оболочкой атомов понимают совокупность всех электронов в атоме. Важнейшей характеристикой электрона является энергия его связи с атомом. Электроны, которые обладают близкими значениями энергии, образуют единый энергетический уровень. Число энергетических уровней в атоме = номеру периода в ПСХЭ, которому принадлежит химический элемент.
-s-орбиталь, максимум на ней находится 2 электрона,
- p-орбиталь, максимум на ней находится 6 электронов,
- d-орбиталь, максимум на ней находится 10 электронов,
- f-орбиталь, максимум на ней находится 14 электронов.
Вот как выглядит порядок заполнения уровней и подуровней в многоэлектронных атомах (это атомы большинства элементов):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7р
Алгоритм составления электронной формулы элемента:
1. Определите число электронов в атоме используя Периодическую таблицу химических элементов Д.И. Менделеева.
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s2, на втором – максимум 8 (два s и шесть р: 2s2 2p6), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
Главное квантовое число n должно быть минимально.
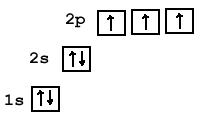
Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
На одной орбитали не может быть больше двух электронов (принцип Паули).