Состав ядра и электронное строение атома
Атом – частица со сложной структурой. В его центре находится положительно заряженное ядро, состоящее из протонов и нейтронов. Принято считать, что:
- масса протона равна 1, m(протона) = 1. Заряд протона равен +1, Z(протона) = +1.
- масса нейтрона равна 1, m(нейтрона) = 1. Заряд нейтрона равен 0, Z(нейтрона) = 0.
(Подсказка: нейтрон = нейтральный, это значит, что его заряд 0).
Обобщаем:
- в ядре находятся протоны и нейтроны,
- ядро заряжено положительно,
- заряд одного протона +1, заряд одного нейтрона 0.
То есть, заряд ядра обусловлен общим зарядом протонов. Каждый химический элемент имеет своё количество протонов. Сколько протонов находится в ядре, можно определить по порядковому номеру элемента в Периодической Системе Химических Элементов Д.И.Менделеева (далее ПСХЭ). Например, атом натрия в ПСХЭ помещён под номером 11. Это значит, что протонов в его ядре 11, а заряд ядра +11.
Краткая запись: Zя(Na) = +11.
Задание №1. Укажите заряды ядер для атомов бора, хлора, азота, тантала.
Вокруг ядра по условным траекториям, которые называют орбитами (или энергетическими уровнями), «вращаются» электроны (рис.1, «Планетарная модель»):

Рис.1 Такая модель называется «Планетарной» или моделью Резерфорда
Движение электронов по орбитам не хаотично, а имеет свой определённый порядок. Этот порядок описывается законами квантовой механики. Каждый электрон характеризуется своей энергией. Какой энергией обладает электрон, зависит от того, насколько далеко он находится от ядра.
Чем дальше электрон от ядра – тем меньше у него энергии.
Представьте себе магнит, вокруг которого расположены металлические стружки. Чем дальше от магнита находятся эти стружки, тем слабее они притягиваются к нему и тем меньшая энергия нужна, чтобы удалить их от магнита.
Электроны, имеющие одинаковую энергию, принадлежат одному и тому же энергетическому уровню. Сколько электронов максимально («лимит» уровня) может быть на одном уровне, рассчитывают по формуле:
N = 2n2, (1)
N – число электронов,
n – номер энергетического уровня.
На первом уровне (n = 1) может быть N = 2×12 = 2 электрона.
Вообще, на первом уровне может располагаться и один электрон, но лишь в том случае, когда он у атома всего один. Так, например, выглядит строение атома водорода:

Рис. 2. Строение атома водорода
На втором (n = 2): N = 2×22 = 8 электронов.
Так, восемь электронов на втором уровне – это предел уровня. Больше электронов, чем восемь, на этом уровне быть не может. Меньше – пожалуйста. Пример – атом фтора:
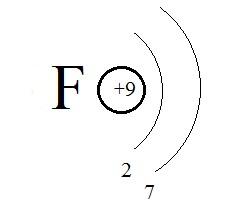
Рис. 3. Строение атома фтора
На третьем (n = 3): N = 2×32 = 18 электронов.
На четвёртом (n = 4): N = 2×42 = 32 электрона.
На пятом (n = 5): N = 2×52 = 50 электронов.
И так далее.
Чтобы определить, сколько энергетических уровней в конкретном атоме, необходимо посмотреть, в каком периоде ПСХЭ находится элемент.
Например, атом хлора расположен в третьем периоде ПСХЭ, поэтому он имеет три энергетических уровня, на которых в сумме расположено 17 электронов.
Задание №2. С помощью ПСХЭ определите заряд ядра, количество протонов, электронов и энергетических уровней для элементов с номерами 28, 56, 3, 1, 37.
Форму записи, указанную на рисунках 2 и 3, можно представить в более простом виде:
H (+1), 1e-. (Рис. 2)
F (+9), 2e-, 7e-. (Рис. 3)
У нас получится записать в подобном виде строения атомов с порядковыми номерами от первого, водорода, до восемнадцатого, аргона:
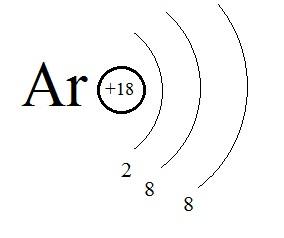
Рис. 4. Строение атома аргона
Казалось бы, записать строение атома калия должно быть проще простого: K (+19), 2e-, 8e-, 9e-. Но вот недоразумение! Калий находится в четвёртом периоде, следовательно, у него должен заполнятся уже четвёртый уровень, но остаётся место ещё на третьем! Как быть?
На самом деле, всё достаточно просто. Как уже было сказано, электроны одного уровня имеют одинаковую энергию. Эта энергия определяется усилием (энергетическим), которое нужно приложить, чтобы электрон с уровня «выбить». В пределах одного уровня величина этой энергии тоже может колебаться. По таким колебаниям уровень разделяют на подуровни. Известно, что:
Первый уровень, самый близкий к ядру, включает в себя только один подуровень. Он называется 1s. «1» означает номер уровня, s – первая буква слова «sharp», что в переводе с английского означает «резкий, острый». Такое названия подуровень получил в ходе физико-химических исследований. Каждый подуровень состоит из нескольких орбиталей – мест, где нахождение электрона максимально вероятно. Кстати, нельзя определить его точное местонахождение (об этом сказал Вернер Карл Гейзенберг, немецкий физик-теоретик в 1927 году).
1s-подуровень может вместить всего два электрона. Запись выглядит так: 1s2. Как можно догадаться, раз у атома водорода всего один-единственный электрон, то и запись для него будет несколько другая: 1s1.
Чуть выше мы говорили о том, что электроны, подобно планетам, вращаются вокруг ядра. Безусловно, эта модель довольно приблизительно описывает поведение электронов в атоме. Вспомним также, что планеты (= электроны) не только двигаются вокруг Солнца (= ядро), но ещё имеют собственную ось вращения. Так и электроны – способны «вращаться» вокруг своей оси, причём в двух направлениях – по часовой стрелке и против неё. Природа такого поведения объясняется законами квантовой механики, а собственный момент вращения электрона был назван спином (от английского spin – «вращение», «вращать»). Поскольку направлений движения два, то говорят, что электрон имеет полуцелый спин (1/2).
Вернёмся к 1s-подуровню. Два его электрона должны иметь разные спины, то есть, если один «вращается» по часовой стрелке, то другой – обязательно против. Этот принцип был сформулирован в 1925 году швейцарским учёным Вольфгангом Паули и носит его имя (принцип Паули, рис.5). Балее строгая формулировка этого принципа такова: на каждой орбитали могут находиться не более двух электронов с противоположными спинами.

Рис.5. Распределение электронов на 1s-подуровне в соответствии с принципом Паули
Второй уровень содержит два подуровня: 2s и 2p. 2s-подуровень отличается по энергии от 1s-подуровня, он ведь дальше от ядра. Стоит запомнить, что лимит любого s-подуровня – 2 электрона. Больше двух такой подуровень вместить не может.
Название p-подуровня происходит от английского слова «principal», то есть «главный». Лимит p-подуровня – уже 6 электронов. На этом подуровне может быть и меньшее количество электронов, в том случае, когда в самом атоме их немного; но шести быть не может точно. Однако, когда электронов на p-подуровне меньше, чем 6, они будут распределяться в соответствии с правилом, сформулированным немецким учёным Фридрихом Хундом в 1925 году: в пределах одного подуровня электроны распределяются так, чтобы их суммарный спин был максимален.
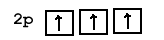
Рис. 6а. Правильное распределение трёх электронов на 2p-подуровне. Каждый спин электрона 1/2, суммарный: 3/2.
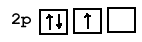
Рис.6б. Неправильное распределение трёх электронов на 2p-подуровне. Спины двух электронов равны 1/2, а спин одного электрона: -1/2, суммарный спин: 1/2.
Правило Хунда и принцип Паули выполняются для всех уровней и подуровней.
Третий уровень вмещает в себя три подуровня: 3s, 3p и 3d. «d» произошло от слова «diffuse» - «расплывчатый». Его лимит – 10 электронов.
И, наконец, четвёртый уровень содержит уже четыре подуровня: 4s, 4p, 4d и 4f. f произошло от слова «fundamental» - «фундаментальный». Вместимость 4f-подуровня – 14 электронов.
Если говорить о пятом уровне и следующих за ним, то там будут и другие подуровни. В их изучении пока нет необходимости.
Подуровни отличаются друг от друга по энергиям:
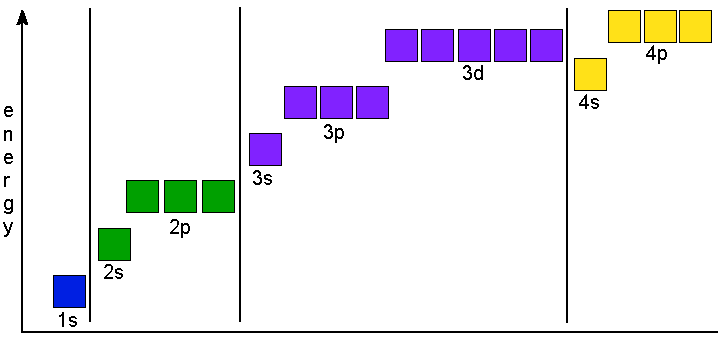
Рис. 7. Относительное энергетическое расположение подуровней. Здесь каждый квадрат – ячейка, в которой могут расположиться два электрона.
4s-подуровень (рис.5) обладает энергией, более низкой, чем 3d-подуровень. То есть, 4s-подуровень будет заполнен раньше, чем 3d. Поэтому электроны калия выстраиваются в следующем порядке:
1s2 2s2 2p6 3s2 3p6 4s1.
Или: K (+19), 2e-, 8e-, 8e-, 1e-.
Или:
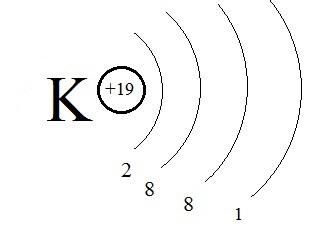
Рис. 8. Строение атома калия
Задание №3. Запишите строение атомов кальция, скандия и алюминия тремя разными способами, как это написано для калия выше.

Шпаргалка.
Приложение. Тест «Строение атома. Электронная оболочка атома»
1. Элемент третьего периода I группы главной подгруппы ПСХЭ – это:
1) натрий 2) калий 3) кальций 4) углерод
2. Элемент второго периода II группы главной подгруппы ПСХЭ – это:
1) рубидий 2) кальций 3) бериллий 4) ксенон
3. Верны ли следующие высказывания?
А. Ядро атома состоит из протонов и электронов.
Б. Заряд ядра атома равен порядковому номеру элемента в периодической системе химических элементов Д.И.Менделеева.
1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны
4. Соотнесите:
Атомы химических элементов
А) Al Б) Br В) Fe Г) Se
Число протонов в ядре атома
1) 34 2) 56 3) 13 4) 35 5) 27 6) 26
5. Соотнесите:
Химический элемент
А) магний Б) водород В) сера Г) натрий
Обозначение химического элемента
1) 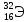 2)
2)  3)
3)  4)
4)  5)
5)  6)
6) 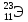
6. Соотнесите:
Химический элемент
А) бром Б) кислород В) марганец Г) хром
Количество электронов в атоме.
1) 25 2) 8 3) 35 4) 24 5) 80 6) 16
7. Число энергетических уровней (электронных слоев) в электронной оболочке атома равно
1) номеру группы 2) номеру периода 3) заряду ядра 4) порядковому номеру
8. В электронной оболочке атома магния число энергетических уровней равно:
1) 1 2) 2 3) 3 4) 4
9. Атому фосфора соответствует электронная схема:
1) 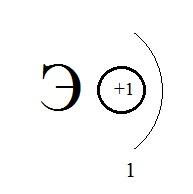 2)
2)  3)
3) 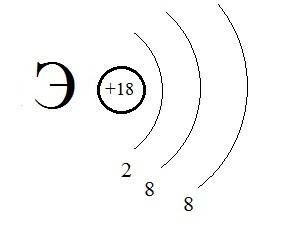 4)
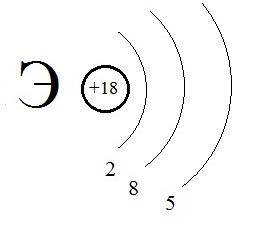
4) 
10. Одинаковое число электронов на внешнем уровне имеют атомы:
1) F и Br 3) Se и P
2) S и Cl 4) K и Ca















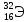 2)
2)  3)
3)  4)
4)  5)
5)  6)
6) 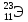
 2)
2)  3)
3)  4)
4) 


















