
соединения АЗОТА
Материал для повторения и подготовки к ГИА
Учитель химии МОУ «Гимназия №1»г. Саратова
Шишкина И.Ю.

2. Расположите соединения азота в порядке возрастания степеней окисления
II вариант
I вариант
N 2 , NH 3 , KNO 3 , NO, HNO 2
NO 2 , N 2 O, HNO 3 , NH 4 Cl, N 2 O 3
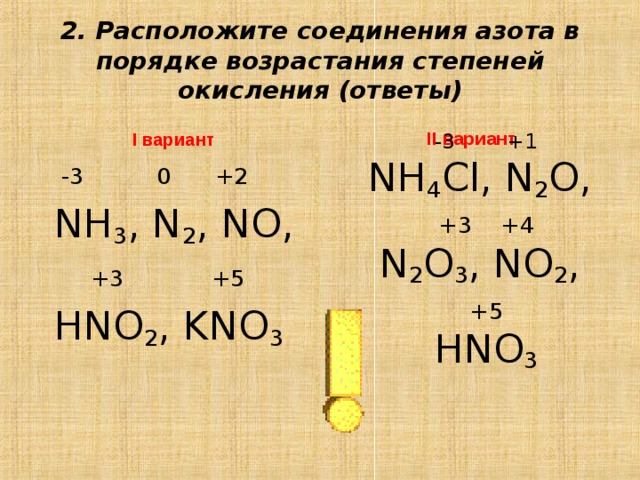
2. Расположите соединения азота в порядке возрастания степеней окисления (ответы)
II вариант
-3 +1
NH 4 Cl, N 2 O,
+ 3 + 4
N 2 O 3 , NO 2 ,
+5
HNO 3
I вариант
-3 0 +2
NH 3 , N 2 , NO,
+3 +5
HNO 2 , KNO 3
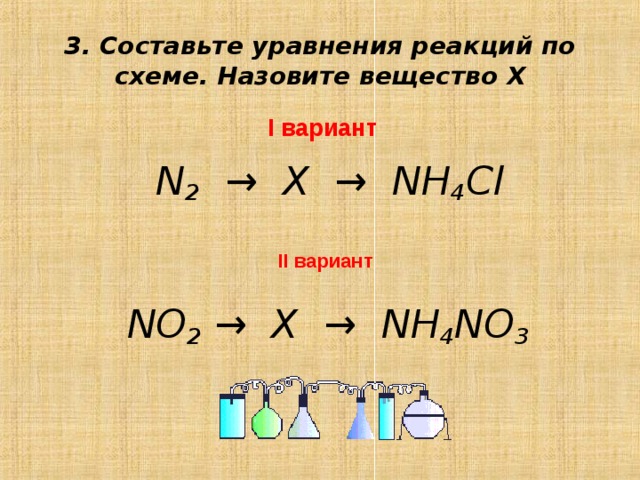
3. Составьте уравнения реакций по схеме. Назовите вещество Х
I вариант
N 2 → X → NH 4 Cl
II вариант
NO 2 → X → NH 4 NO 3

3. Составьте уравнения реакций по схеме. Назовите вещество Х (ответы)
I вариант
X – NH 3 ( аммиак )
1. N 2 + 3H 2 =2NH 3
2. NH 3 + HCl = NH 4 Cl
II вариант
X – HNO 3 ( азотная кислота )
1. 4NO 2 +2H 2 O+O 2 =4HNO 3
2. HNO 3 + NH 3 =NH 4 NO 3
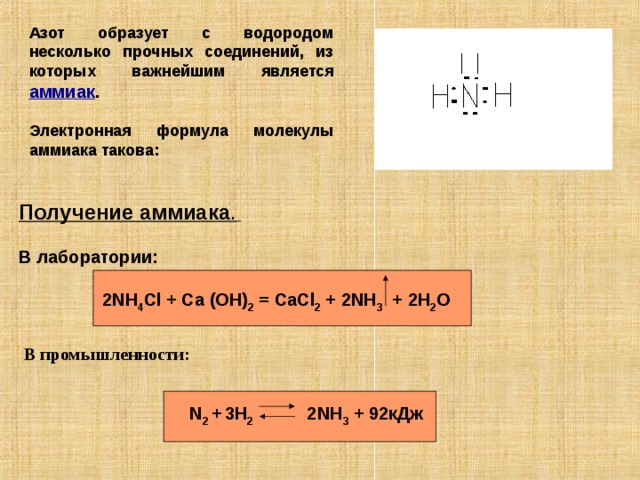
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак .
Электронная формула молекулы аммиака такова:
Получение аммиака .
В лаборатории:
2NH 4 Cl + Ca (OH) 2 = CaCl 2 + 2NH 3 + 2H 2 O
В промышленности:
N 2 + 3 H 2 2 NH 3 + 92кДж
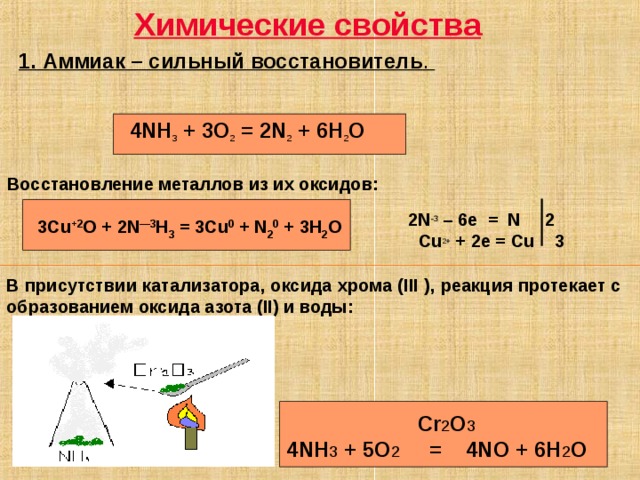
Химические свойства
1. Аммиак – сильный восстановитель .
4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O
Восстановление металлов из их оксидов:
2N - 3 – 6e = N 2
Cu 2+ + 2e = Cu 3
3Cu +2 O + 2N —3 H 3 = 3Cu 0 + N 2 0 + 3H 2 O
В присутствии катализатора, оксида хрома ( III ), реакция протекает с образованием оксида азота ( II ) и воды:
Cr 2 O 3
4NH 3 + 5O 2 = 4NO + 6H 2 O
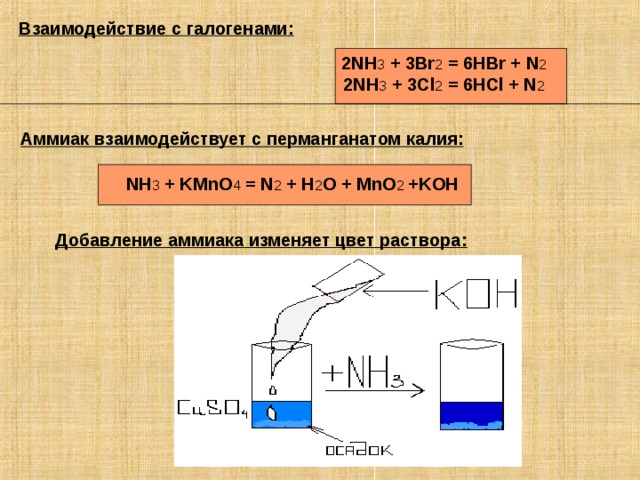
Взаимодействие с галогенами:
2NH 3 + 3Br 2 = 6HBr + N 2
2NH 3 + 3Cl 2 = 6HCl + N 2
Аммиак взаимодействует с перманганатом калия :
NH 3 + KMnO 4 = N 2 + H 2 O + MnO 2 +KOH
Добавление аммиака изменяет цвет раствора:
![2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH 3 + H 2 O NH 3 . H 2 O NH 4 + + OH - NH 4 OH NH 4 + + OH — Н NH 3 + H + Cl - [ H N H ] + Cl - H](https://fsd.multiurok.ru/html/2018/01/23/s_5a671be95c1bb/img8.jpg)
2. образование солей аммония.
Реакции с образованием донорно – акцепторной связи.
NH 3 + H 2 O NH 3 . H 2 O NH 4 + + OH -
NH 4 OH NH 4 + + OH —
Н
NH 3 + H + Cl - [ H N H ] + Cl -
H
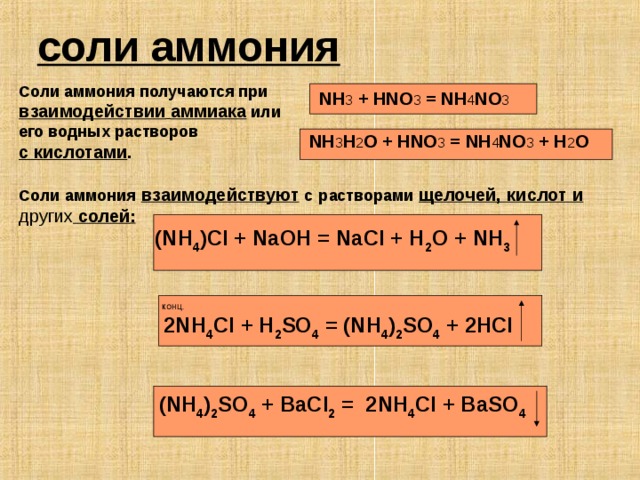
соли аммония
Соли аммония получаются при взаимодействии аммиака или
его водных растворов
с кислотами .
NH 3 + HNO 3 = NH 4 NO 3
NH 3 H 2 O + HNO 3 = NH 4 NO 3 + H 2 O
Соли аммония взаимодействуют с растворами щелочей, кислот и других солей :
(NH 4 )Cl + NaOH = NaCl + H 2 O + NH 3
КОНЦ .
2NH 4 Cl + H 2 SO 4 = (NH 4 ) 2 SO 4 + 2HCl
(NH 4 ) 2 SO 4 + BaCl 2 = 2NH 4 Cl + BaSO 4
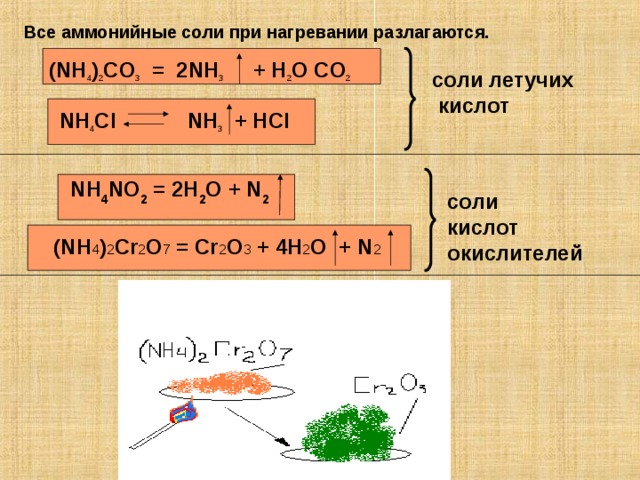
Все аммонийные соли при нагревании разлагаются.
(NH 4 ) 2 CO 3 = 2NH 3 + H 2 O CO 2
соли летучих
кислот
NH 4 Cl NH 3 + HCl
NH 4 NO 2 = 2H 2 O + N 2
соли
кислот
окислителей
(NH 4 ) 2 Cr 2 O 7 = Cr 2 O 3 + 4H 2 O + N 2
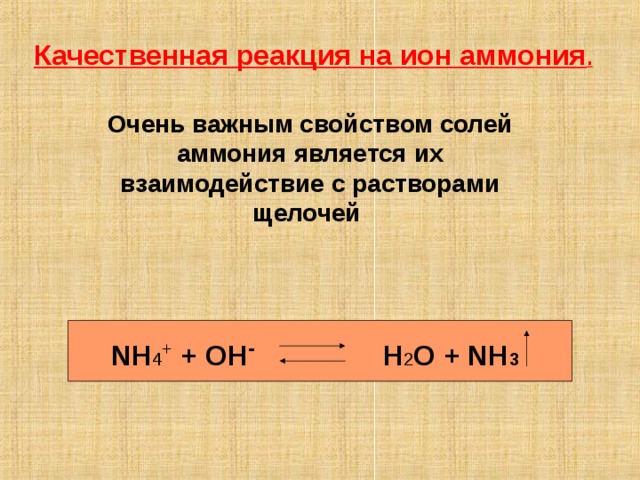
Качественная реакция на ион аммония .
Очень важным свойством солей аммония является их взаимодействие с растворами щелочей
NH 4 + + OH - H 2 O + NH 3

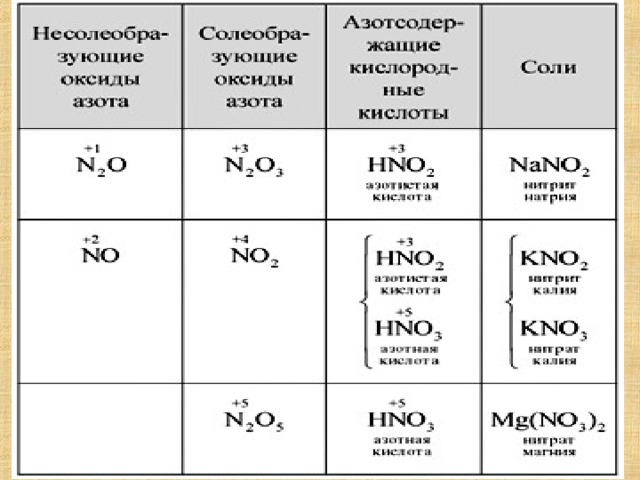
Оксиды азота.
Азот образует шесть кислородных соединений.
степени окисления + 1 N 2 O
+ 2 NO
+ 3 N 2 O 3
+ 4 NO 2 , N 2 O 4
+ 5 N 2 O 5

N 2 O Получение:
NH 4 NO = N 2 O +2H 2 O
+1
Химические свойства:
1. разложение при нагревании
2 N 2 +1 O = 2 N 2 0 + O 2
2. с водородом
N 2 +1 O + H 2 = N 2 0 + H 2 O
несолеобразующий

NO
+2
Получение:
1. В природе:
N 2 + O 2 = 2NO
2. В промышленности:
4 NH 3 + 5O 2 = 4NO +6H 2 O
Химические свойства:
2 N +2 O + O 2 = 2N +4 O 2
1. легко окисляется:
2. окислитель:
2 N +2 O + 2SO 2 = 2SO 3 +N 2 0
несолеобразующий

N 2 O 3
+3
Получение:
NO 2 + NO N 2 O 3
Химические свойства:
ВСЕ свойства кислотных оксидов.
кислотный оксид
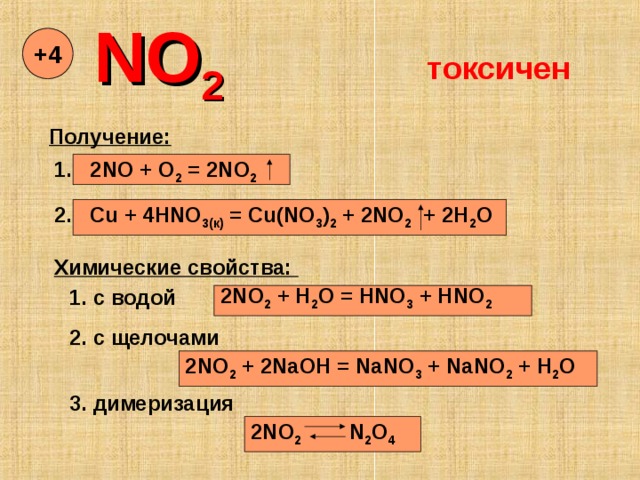
NO 2
+ 4
токсичен
Получение:
1. 2 NO + O 2 = 2NO 2
2. Cu + 4HNO 3( к ) = Cu(NO 3 ) 2 + 2NO 2 + 2H 2 O
Химические свойства:
2 NO 2 + H 2 O = HNO 3 + HNO 2
1. с водой
2. с щелочами
2NO 2 + 2NaOH = NaNO 3 + NaNO 2 + H 2 O
3. димеризация
2NO 2 N 2 O 4
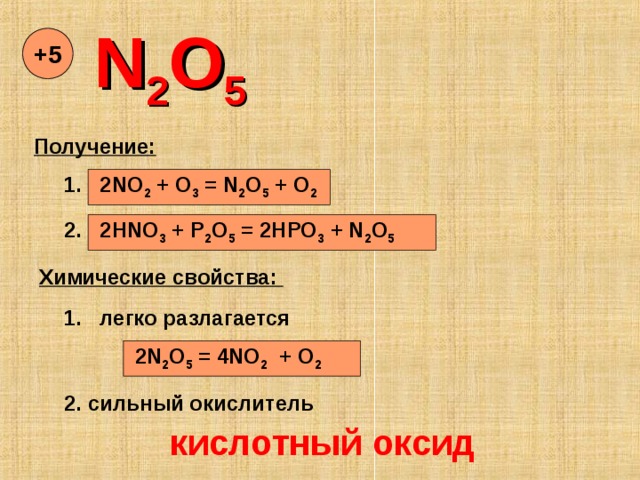
N 2 O 5
+ 5
Получение:
1. 2NO 2 + O 3 = N 2 O 5 + O 2
2. 2HNO 3 + P 2 O 5 = 2HPO 3 + N 2 O 5
Химические свойства:
1. легко разлагается
2N 2 O 5 = 4NO 2 + O 2
2. сильный окислитель
кислотный оксид

I. Физические свойства азотной кислоты
- Агрегатное состояние – жидкость ;
- Цвет – отсутствует;
- Запах – едкий, кислотный;
- Растворимость в воде – хорошая;
при хранении на свету разлагается , приобретая желтоватый оттенок:
4HNO 3 =4NO 2 ↑ + O 2 ↑ + 2H 2 O

II. Характеристика HNO 3
одноосновная
2. По содержанию «О»:
кислородсодержащая
3. По растворимости в воде:
растворимая
4. По стабильности:
нестабильная
5. По летучести:
летучая
6. По степени диссоциации:
сильная

III. Химические свойства HNO 3
- Свойства HNO 3 как электролита
Диссоциация: HNO 3 = H + + NO 3 –
Взаимодействует
А) с оксидами металлов:
CuO + 2 HNO 3 = Cu(NO 3 ) 2 + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
Б) с основаниями:
Cu(OH) 2 + 2 HNO 3 = Cu(NO 3 ) 2 + 2 H 2 O
Cu(OH) 2 + 2H + = Cu 2+ + 2H 2 O
В) с солями:
Na 2 CO 3 + 2 HNO 3 = 2 NaNO 3 + CO 2 ↑ + H 2 O
CO 3 2- + 2H + = CO 2 + H 2 O
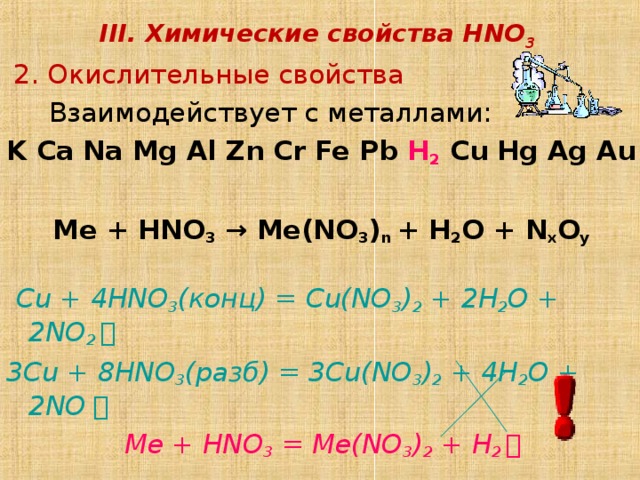
III. Химические свойства HNO 3
2 . Окислительные свойства
Взаимодействует с металлами:
K Ca Na Mg Al Zn Cr Fe Pb H 2 Cu Hg Ag Au
Ме + HNO 3 → Me(NO 3 ) n + H 2 O + N x O y
Cu + 4HNO 3 ( конц) = Cu(NO 3 ) 2 + 2H 2 O + 2NO 2 ↑
3 Cu + 8 HNO 3 ( разб) = 3 Cu(NO 3 ) 2 + 4 H 2 O + 2NO ↑
Me + HNO 3 = Me(NO 3 ) 2 + H 2 ↑

III. Химические свойства HNO 3
2 . Окислительные свойства
Взаимодействует с неметаллами:
(S, P, C)
C + 4HNO 3 → CO 2 + 2H 2 O + 4NO 2
Взаимодействует с органическими веществами (скипидар)
 60% HNO 3 от 30 % до 60% NO 2 , N 2 N 2 O Cr - Sn Не реагируют (пассивируют) Очень разбавленная кислота Малоактивные HNO 3 NO 2 N Н 3 NO , NO 2 Благородные Pb - Ag - Au , Pt NO , NO 2 NO N 2 O , N Н 3 Соли аммония - N 2 O , N Н 3 - - " width="640"
60% HNO 3 от 30 % до 60% NO 2 , N 2 N 2 O Cr - Sn Не реагируют (пассивируют) Очень разбавленная кислота Малоактивные HNO 3 NO 2 N Н 3 NO , NO 2 Благородные Pb - Ag - Au , Pt NO , NO 2 NO N 2 O , N Н 3 Соли аммония - N 2 O , N Н 3 - - " width="640"
II. C пецифические: с металлами
!
ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ
Металлы
Активные
Концентрированная кислота
NO , NO 2
Li - Zn
Средней активности
Разбавленная кислота
HNO 3 60%
HNO 3 от 30 % до 60%
NO 2 , N 2
N 2 O
Cr - Sn
Не реагируют (пассивируют)
Очень разбавленная кислота
Малоактивные
HNO 3
NO 2
N Н 3
NO , NO 2
Благородные
Pb - Ag
-
Au , Pt
NO , NO 2
NO
N 2 O , N Н 3
Соли аммония
-
N 2 O , N Н 3
-
-
 60%) до Fe Разбавлен ная (5-60%) Pb - Ag NO Очень разбавлен ная ( NO, N 2 O, N 2 NO 2 не действует NH 3 (NH 4 NO 3 ) NO Fe, Cr, Al, Au, Pt , Ir , Ta (на холоде) с Al при t 0 → NO NO Fe, Cr, Al, Au, Pt , Ir , Ta " width="640"
60%) до Fe Разбавлен ная (5-60%) Pb - Ag NO Очень разбавлен ная ( NO, N 2 O, N 2 NO 2 не действует NH 3 (NH 4 NO 3 ) NO Fe, Cr, Al, Au, Pt , Ir , Ta (на холоде) с Al при t 0 → NO NO Fe, Cr, Al, Au, Pt , Ir , Ta " width="640"
Металл
Концентри
рованная
( 60%)
до Fe
Разбавлен
ная
(5-60%)
Pb - Ag
NO
Очень разбавлен
ная (
NO,
N 2 O, N 2
NO 2
не действует
NH 3
(NH 4 NO 3 )
NO
Fe, Cr, Al, Au,
Pt , Ir , Ta (на холоде)
с Al при t 0 → NO
NO
Fe, Cr, Al, Au,
Pt , Ir , Ta

Схема уравнения
Ме + HNO3 = соль + вода + оксиды азота
(нитрат Ме) (аммиак,
соли аммония)
Cu + HNO 3 ( конц) = Cu(NO 3 ) 2 + NO 2 ↑ + 2 H 2 O
Cu + 4HNO 3 ( конц) = Cu(NO 3 ) 2 + 2 NO 2 ↑ + 2H 2 O
Zn + HNO 3 ( разб ) = Zn(NO 3 ) 2 + NH 4 NO 3 + H 2 O
4Zn + 10HNO 3 ( разб ) = 4 Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O

4Zn + 10HNO 3 ( разбавл .) = 4Zn(NO 3 ) 2 + N 2 O + 5H 2 O
Ag + 2HNO 3 ( конц .) = AgNO 3 + NO 2 + H 2 O
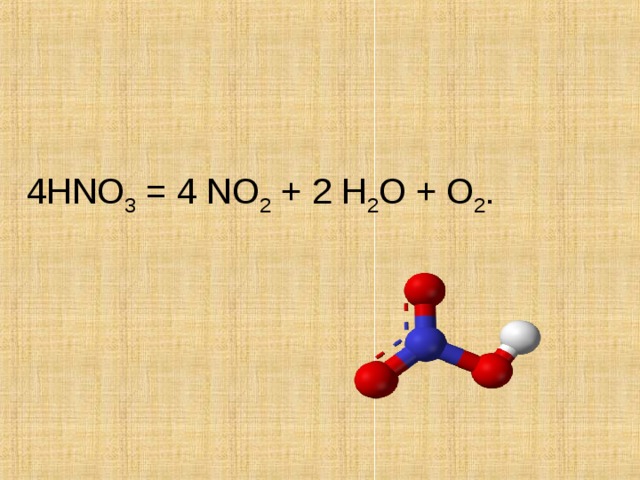
4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2 .

ГЛАУБЕР Иоганн Рудольф (1604-1670),
немецкий химик и врач. Получил
чистую азотную кислоту в 1650 году .
Получение
?
Действием конц. серной
кислоты на нитрат натрия
( Лаборатория)
(Промышленность )
?
NaNO 3 + H 2 SO 4 = NaHSO 4 + HNO 3
Завод азотной кислоты
30

Промышленный способ получения азотной кислоты
1 . Схема последовательного получения азотной кислоты:
3
2
1
N О 2
N О
NH 3
Н N О 3
2. Химические реакции:
- 4 NH 3 + 5О 2 = 4 NO + 6Н 2 О + Q
- 2NO + O 2 = 2NO 2 + Q
- NO 2 + H 2 O = 2HNO 3 + NO ↑ + Q
IV . Применение азотной кислоты
HNO 3

Азотная кислота.
Получение азотной кислоты:
В лаборатории ,
при слабом нагревании:
KNO 3 + H 2 SO 4 = HNO 3 + KHSO 4
В промышленности
процесс получения азотной кислоты можно разбить на три этапа:
1.Окисление аммиака на платиновом катализаторе до NO :
- 1.Окисление аммиака на платиновом катализаторе до NO :
- 1.Окисление аммиака на платиновом катализаторе до NO :
- 1.Окисление аммиака на платиновом катализаторе до NO :
- 1.Окисление аммиака на платиновом катализаторе до NO :
4 NH 3 + 5 O 2 = 4 NO +6 H 2 O
2.Окисление кислородом воздуха NO до NO 2 :
2NO + O 2 =2NO 2
3.Поглощение NO 2 водой в присутствии избытка кислорода:
4NO 2 + 2H 2 O + O 2 = 4HNO 3
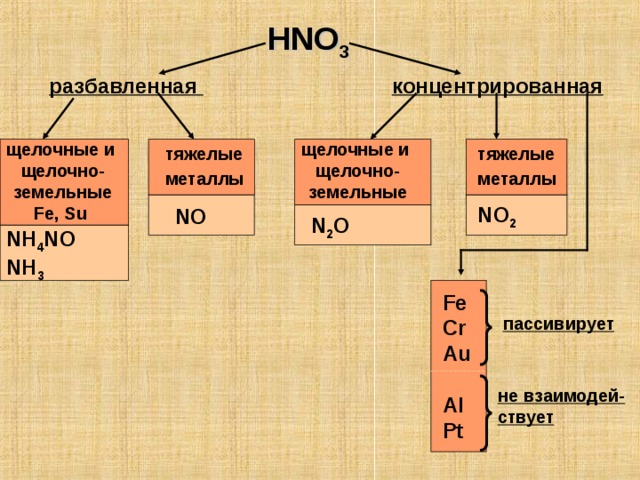
HNO 3
разбавленная
концентрированная
щелочные и
щелочно-земельные
Fe, Su
щелочные и
щелочно-земельные
тяжелые
металлы
тяжелые
металлы
NO 2
NO
N 2 O
NH 4 NO
NH 3
Fe
Cr
Au
Al
Pt
пассивирует
не взаимодей-
ствует
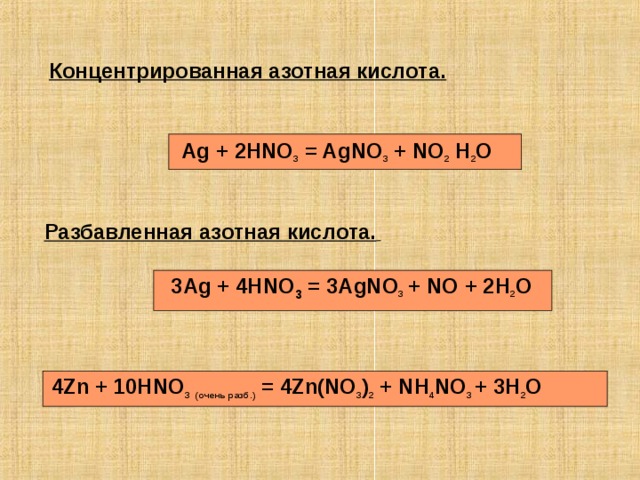
Концентрированная азотная кислота.
Ag + 2HNO 3 = AgNO 3 + NO 2 H 2 O
Разбавленная азотная кислота.
3Ag + 4HNO 3 = 3AgNO 3 + NO + 2H 2 O
4Zn + 10HNO 3 ( очень разб .) = 4Zn(NO 3 ) 2 + NH 4 NO 3 + 3H 2 O
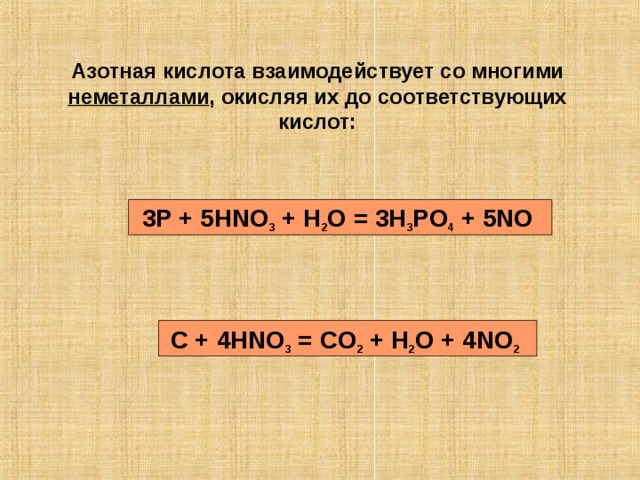
Азотная кислота взаимодействует со многими неметаллами , окисляя их до соответствующих кислот:
3P + 5HNO 3 + H 2 O = 3H 3 PO 4 + 5NO
C + 4HNO 3 = CO 2 + H 2 O + 4NO 2

Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды.
Свойства : ВСЕ растворимы в воде.
Селитры – соли азотной кислоты и щелочных металлов.
NaNO 3 – натриевая селитра
KNO 3 – калийная селитра
NH 4 NO 3 – аммиачная селитра
Ca ( NO 3 ) 2 – кальциевая селитра
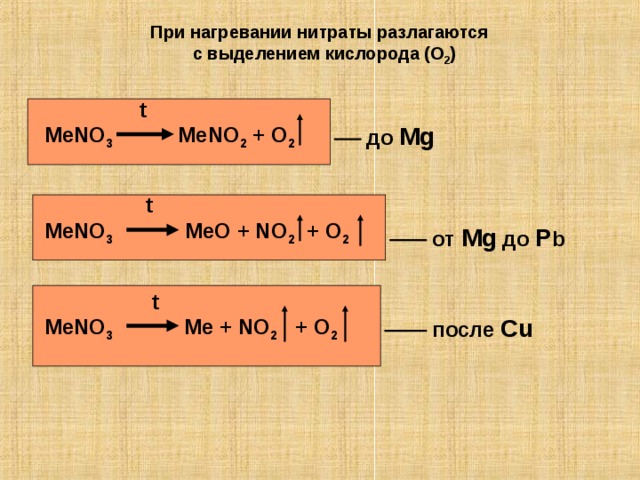
При нагревании нитраты разлагаются
с выделением кислорода ( O 2 )
t
MeNO 3 MeNO 2 + O 2
до Mg
t
MeNO 3 MeO + NO 2 + O 2
от Mg до P b
t
MeNO 3 Me + NO 2 + O 2
после Cu
Селитры используются как удобрения.
KNO 3 применяется для приготовления черного пороха.
Тесты:
I вариант
5 Коэффициент перед формулой соли в уравнении реакции
Mg +HNO 3 NO + … + H 2 O равен …
1)3 2)4 3)6 4)8
1 Аммиак при нормальных условиях – это…
1) бесцветный газ без запаха
2) бурый, остро пахнущий газ
3) бесцветный, остро пахнущий газ
4) бесцветная жидкость
6 При добавлении нитрата серебра к расствору некоторого минерального удобрения выпал белый осадок. Это удобрение…
1)нитрат кальция
2)нитрат калия
3)нитрат аммония
4)сильвинит
2 С концентрированной азотной кислотой не взаимодействует…
1) Hg 2) Al 3) Cu 4) Zn
3 В промышленности азотную кислоту получают по реакции:
1) NaNO 3(K) + H 2 SO 4(K) = NaHSO 4 + HNO 3
2) Ba(NO 3 ) 2 + H 2 SO 4 = BaSO 4 + 2HNO 3
3) 4NO 2 + O 2 + 2H 2 O = 4HNO 3
4) N 2 O 5 + H 2 O = 2HNO 3
7 самая слабая из кислот, формула которых
- HNO 3 2) H 2 SiO 3
- 3) H 2 SO 3 4) H 3 PO 4
8 азотной кислоте соответствует оксид…
1) N 2 O 2) NO 3) NO 2 4) N 2 O 5
4 Соли аммония реагируют с щелочами, так как при этом…
1)образуется слабое основание гидроксид аммония
2)выделяется газ аммиак
3)образуется новая соль
4)образуется слабое основание и выделяется газ
9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает:
1) Be 2)B 3) S 4)N
10 дополните фразу « селитры – это …»

II вариант
1 азотная кислота – это сильная кислота, так как она…
1)полностью диссоциирована в водном растворе
2)растворяет даже серебро
3)сильный окилитель
4)хорошо растворима в воде
6 Плохо растворяется а воде минеральное удобрение…
1)хлорид аммония
2)нитрат клия
3)сильвинит
4)суперфосфат
2 минимальная степень олисления азота соединении…
1) N2 2) NO 3) NO2 4) HNO3
7 самая слабая из кислот, формула которых
3) H2CO3 4) H3SiO3
3 аммиак в промышленности получают…
1) N 2 + 3 H 2 2 NH 3
2) 4NO 2 + O 2 + 2H 2 O = 4HNO 3
3) N 2 O 5 + H 2 O = 2HNO 3
4) NaNO 3(K) + H 2 SO 4(K) = NaHSO 4 + HNO 3
8 азотной кислоте соответствует оксид…
1) N 2 O 2) NO 3) NO 2 4) N 2 O 5
9 из перечисленных химических элементов наибольшей электроотрицательностью в соединениях обладает:
1) B 2)P 3)N 4)F
4 соли аммони по по отношению к воде…
1)хорошо растворимы
2)плохо растворимы
3)нерастворимы
4)есть растворимые и нерастворимые
5 коэффициент перед формулой восстановителя в уравнении реакции
Zn + HNO 3 N 2 O +… + H 2 O равен
1) 1 2) 2 3) 3 4) 4
10 дополните фразу «нитраты – это …»
Задачи:
1. Рассчитайте массу аммиака, который требуется для получения 200 кг азотной кислоты с массовой долей HNO3 60 % . При расчёте учтите, что массовая доля выхода конечного продукта при синтезе составляет 80 %.
2. При нагревании нитрата натрия образовался кислород объемом 280 мл (нормальные условия). Какая масса соли подверглась разложению.
3. Рассчитайте массу гидроксида кальция( II ), который можно нейтрализовать с помощью 630 г раствора азотной кислоты, в которой массовая доля HNO 3 равна 20%
4.При пропускании избытка аммиака через раствор массой 600 г с массовой долей азотной кислоты 42% получили нитрат аммония массой 300 г. Определите массовую долю выхода нитрата аммония.
5. На смесь меди и оксида меди ( II ) массой 75 г подействовали избытком HNO 3 (концентрированная). При этом образовался газ объемом 26,88 л (нормальные условия). Определите массовую долю оксида меди( II ) в исходной смеси.
6.Аммиак объемом 7,84 л (нормальные условия) подвергли каталитическому окислению и дальнейшему превращению в азотную кислоту. В результате получили раствор массой 200г. Считая выход HNO 3 равным 40%, определите массовую долю её в полученном растворе.














![2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH 3 + H 2 O NH 3 . H 2 O NH 4 + + OH - NH 4 OH NH 4 + + OH — Н NH 3 + H + Cl - [ H N H ] + Cl - H](https://fsd.multiurok.ru/html/2018/01/23/s_5a671be95c1bb/img8.jpg)















 60% HNO 3 от 30 % до 60% NO 2 , N 2 N 2 O Cr - Sn Не реагируют (пассивируют) Очень разбавленная кислота Малоактивные HNO 3 NO 2 N Н 3 NO , NO 2 Благородные Pb - Ag - Au , Pt NO , NO 2 NO N 2 O , N Н 3 Соли аммония - N 2 O , N Н 3 - - " width="640"
60% HNO 3 от 30 % до 60% NO 2 , N 2 N 2 O Cr - Sn Не реагируют (пассивируют) Очень разбавленная кислота Малоактивные HNO 3 NO 2 N Н 3 NO , NO 2 Благородные Pb - Ag - Au , Pt NO , NO 2 NO N 2 O , N Н 3 Соли аммония - N 2 O , N Н 3 - - " width="640"
 60%) до Fe Разбавлен ная (5-60%) Pb - Ag NO Очень разбавлен ная ( NO, N 2 O, N 2 NO 2 не действует NH 3 (NH 4 NO 3 ) NO Fe, Cr, Al, Au, Pt , Ir , Ta (на холоде) с Al при t 0 → NO NO Fe, Cr, Al, Au, Pt , Ir , Ta " width="640"
60%) до Fe Разбавлен ная (5-60%) Pb - Ag NO Очень разбавлен ная ( NO, N 2 O, N 2 NO 2 не действует NH 3 (NH 4 NO 3 ) NO Fe, Cr, Al, Au, Pt , Ir , Ta (на холоде) с Al при t 0 → NO NO Fe, Cr, Al, Au, Pt , Ir , Ta " width="640"































