СОДЕРЖАНИЕ ВНЕАУДИТОРНОЙ САМОСТОЯТЕЛЬНОЙ РАБОТЫ ПО РАЗДЕЛУ «НЕОРГАНИЧЕСКАЯ ХИМИЯ» ДЛЯ ОБУЧАЮЩИХСЯ УЧРЕЖДЕНИЙ СПО, ТЕХНИЧЕСКИЙ ПРОФИЛЬ Внеаудиторная самостоятельная работа №1
Тема: Основные понятия химии. Химический элемент. Качественный и количественный состав химических элементов.
Количество часов: 1.
Цель: Выучить формулировки основных понятий химии.
Общие указания к выполнению работы:
Выучить понятия: вещество, атом, молекула, химический элемент, аллотропия.
Решить следующие задачи:
1. Найдите относительные молекулярные массы веществ, состав которых описывается формулами: О3, H2SO4, Ca3(PO4)2, Cu(OH)2.
2. Рассчитайте относительные молекулярные массы медного купороса CuSO45H2O и кристаллической соды Na2CO310H2O.
3. Чем отличается относительная молекулярная масса вещества от молярной массы? Найдите молярную массу азотной кислоты, гидроксида натрия, сульфата алюминия.
5. Сколько молекул содержится в 32 г сернистого газа SO2?
6. Какова масса 1,2 1023 молекул аммиака NH3?
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №2
Тема: Основные законы химии.
Количество часов: 4.
Цель: Выучить формулировки основных законов химии.
Общие указания к выполнению работы:
Выучить законы: Стехиометрия. Закон сохранения массы веществ. Закон постоянства состава веществ молекулярной структуры. Закон Авогадро и следствия из него.
Подготовить реферат и электронную презентацию на одну из тем:
1. Закон сохранения массы веществ и его значение в науке.
2. Закон постоянства состава веществ молекулярной структуры и его значение в науке.
3. Закон Авогадро, следствия из него и значение в науке.
Форма контроля: реферат, электронная презентация.
Внеаудиторная самостоятельная работа №3
Тема: Виды химической связи.
Количество часов: 1.
Цель: закрепить представление о химической связи, изучить виды химической связи, приобрести навыки составления схем образования химической связи.
Общие указания к выполнению работы:
Подберите 5 примеров соединений с различными типами химической связи и запишите схемы их образования.
Запишите 3 возможных уравнения реакции с любыми из этих веществ.
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №4
Тема: Типы кристаллических решеток. Структурные формулы веществ.
Количество часов: 2.
Цель: закрепить представление о типах кристаллических решеток. Приобрести навыки составления структурных формул веществ.
Общие указания к выполнению работы:
Подготовить реферат и презентацию на одну из тем:
1. Ионная кристаллическая решетка.
2. Молекулярная кристаллическая решетка.
3. Атомная кристаллическая решетка.
4. Кристаллическая решетка в металлах.
Форма контроля: реферат.
Внеаудиторная самостоятельная работа №5
Тема: Агрегатное состояние вещества. Смеси.
Количество часов: 1.
Цель: закрепить представление об агрегатном состоянии вещества, смесях и их типах.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Какой объем кислорода содержится в 500 м3 (н.у.) воздуха?
2. В природном газе некоторого месторождения объемные доли предельных углеводородов составляют: метана ‒ 85 %, этана ‒ 10 %, пропана ‒ 4 %, бутана ‒ 1 %. Сколько литров каждого из газов может быть получено из 125 л природного газа (н.у.)?
3. Минерал пиролюзит содержит 45 % оксида марганца (IV). Сколько килограммов марганца можно получить из 1 т пиролюзита?
4. В состав сухой цементной смеси для штукатурных работ входит 25 % цемента и 75 % песка. Сколько килограммов каждого компонента нужно взять для приготовления 150 кг такой смеси?
5. Сколько граммов хлорида натрия и сколько миллилитров воды необходимо взять для приготовления 600 г физиологического раствора, массовая доля соли в котором составляет 0,9 %?
6. Золото пробы 585 содержит 58,5 % этого металла, остальное -медь. Какое количество вещества и сколько граммов золота содержит кольцо из металла этой пробы массой 4,7 г?
7. В 250 мл воды растворили 67,2 л (н.у.) хлороводорода. Какова массовая доля соляной кислоты в полученном растворе?
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №6
Тема: Дисперсные системы. Коллоидные растворы.
Количество часов: 1.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык составления электронной презентации по теме.
Общие указания к выполнению работы:
Подготовить электронную презентацию на одну из тем по выбору:
1. Значение природных дисперсных систем.
2. Дисперсные системы вокруг человека.
3. Грубодисперсные системы, их классификация и использование в профессиональной деятельности.
4. Косметические гели.
5. Применение суспензий и эмульсий в строительстве.
6. Коагуляция и ее значение.
Форма контроля: электронная презентация.
Внеаудиторная самостоятельная работа №7
Тема: Вода. Растворы. Растворение. Массовая доля растворенного вещества.
Количество часов: 1.
Цель: закрепить навык решения расчетных задач на концентрацию вещества в растворе.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Определите массу соли и массу воды в 750 кг медного купороса.
2. Сколько килограммов воды потребуется для превращения 1,2 т алебастра в гипс?
3. В 80 мл воды растворили 20 г хлорида натрия. Рассчитайте массовую долю соли в растворе.
4. При выпаривании 160 г раствора карбоната натрия получили 8 г твердой соли. Рассчитайте ее массовую долю в исходном растворе.
5. Сколько граммов сахара и сколько литров воды необходимо взять для приготовления 2 кг 30 %-го сахарного сиропа?
6. К 50 г 30 %-го раствора пероксида водорода добавили 100 г воды. Рассчитайте массовую долю вещества в полученном растворе.
7. В 100 г воды растворили 22,4 л хлороводорода (н.у.). Определите массовую долю НС1 в полученной соляной кислоте.
8. В 150 мл 10 %-го раствора гидроксида натрия (плотность 1,1 г/мл) растворили 10 г NaOH. Какой стала концентрация щелочи в растворе?
9. Смешали 130 г 20 %-го и 120 г 5 %-го растворов хлорида бария. Определите массовую долю вещества в полученном растворе.
10. Массовая доля соли в рассоле составляла 6 %. При упаривании 500 г такого рассола его масса уменьшилась на 100 г. Рассчитайте массовую долю соли в полученном растворе.
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №8
Тема: Теория электролитической диссоциации. Электролиты, неэлектролиты.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык публичного сообщения.
Общие указания к выполнению работы:
Подготовить сообщение на одну из тем по выбору:
1. Развитие представлений о растворах.
2. Кислоты в свете теории электролитической диссоциации.
3. Соли в свете теории электролитической диссоциации.
4. Основания в свете теории электролитической диссоциации.
5. Использование электролитов в технике.
Форма контроля: устное сообщение.
Внеаудиторная самостоятельная работа №9
Тема: Механизм диссоциации веществ с различным типом химической связи.
Количество часов: 2.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык подготовки электронной презентации и публичного сообщения.
Общие указания к выполнению работы:
Подготовить реферат и электронную презентацию на одну из тем по выбору:
1. Жизнь и деятельность С. Аррениуса.
2. Значение теории электролитической диссоциации.
3. Вклад отечественных ученых в развитие теории электролитической диссоциации.
4. Электролиты.
5. Неэлектролиты.
6. Степень электролитической диссоциации.
Форма контроля: реферат, электронная презентация.
Внеаудиторная самостоятельная работа №10
Тема: Кислоты, основания, соли в свете теории электролитической диссоциации.
Количество часов: 1.
Цель: закрепить навык решения задач на составление уравнений реакции по цепочке превращения.
Общие указания к выполнению работы:
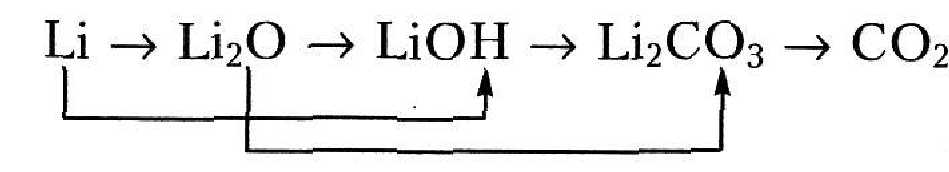
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
1. 
2. 
3. 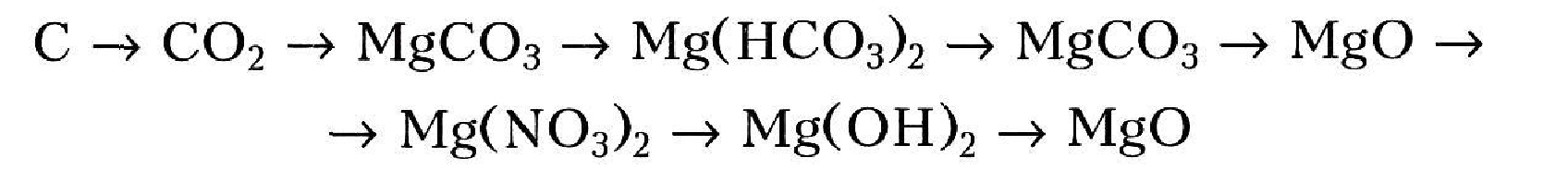
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №11
Тема: Кислоты в свете теории электролитической диссоциации, их свойства.
Количество часов: 1.
Цель: закрепить знания о классах веществ с точки зрения теории электролитической диссоциации.
Общие указания к выполнению работы:
Решить следующие задачи:
1. На полную нейтрализацию 110 г раствора серной кислоты потребовалось 80 г 10 %-го раствора гидроксида натрия. Рассчитайте массовую долю кислоты в исходном растворе.
2. Выведите формулу кислоты, если известно, что в ее состав входит 2,13 % водорода, 29,79 % азота и 68,08 % кислорода.
3. К 980 мл 40 %-го раствора серной кислоты (плотность 1,3 г/мл) добавили 120 мл воды. Найдите массовую долю кислоты в полученном растворе.
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №12
Тема: Основания в свете теории электролитической диссоциации, их свойства.
Количество часов: 1.
Цель: закрепить знания о классах веществ с точки зрения теории электролитической диссоциации.
Общие указания к выполнению работы:
Решить следующие задачи:
1. В 120 мл воды растворили 48 г гидроксида натрия, содержащего 5 % примесей. Найдите массовую долю щелочи в полученном растворе.
2. При взаимодействии 585 г 20 %-го раствора хлорида аммония с необходимым количеством гидроксида кальция было получено 33,6 л аммиака (н.у.). Рассчитайте выход продукта реакции в процентах от теоретически возможного.
3. В любой домашней аптечке обязательно имеется пузырек или ампула с нашатырным спиртом ‒ 10 %-м раствором аммиака в воде. Сколько миллилитров газообразного аммиака (н.у.) и граммов воды содержится в одной ампуле, масса раствора в которой 2 г?
4. Найдите массу осадка, выпавшего при добавлении к 160 г
2 %-го раствора сульфата меди (II) необходимого количества раствора гидроксида натрия. Какое количество вещества гидроксида натрия вступило в реакцию?
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №13
Тема: Соли в свете теории электролитической диссоциации, их свойства. Гидролиз солей.
Количество часов: 1.
Цель: закрепить знания о классах веществ с точки зрения теории электролитической диссоциации и гидролизе солей.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Сколько граммов гидрокарбоната натрия (разрыхлителя теста) потребуется для получения 9 л газов (н.у.), включая водяные пары?
2. Напишите уравнения гидролиза по первой ступени следующих солей и укажите среду раствора: Cu(NО3)2, FeSО4, ZnCl2, K2S, Na2SiО3, NH4CI, A1(NО3)3.
3. Допишите левые части уравнений реакций:
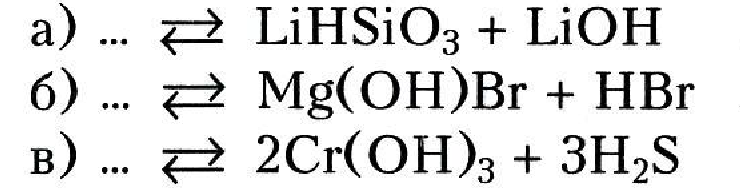
4. Смешали растворы карбоната натрия и сульфата алюминия. При этом выделился газ и выпал осадок. Напишите уравнение реакции.
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №14
Тема: Оксиды в свете теории электролитической диссоциации, их свойства.
Количество часов: 2.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык подготовки электронной презентации и публичного сообщения.
Общие указания к выполнению работы:
Подготовить реферат и электронную презентацию на одну из тем по выбору:
1. Классификация оксидов.
2. Химические свойства оксидов.
3. Основные способы получения оксидов.
4. Отдельные представители оксидов.
5. Оксиды как строительные материалы.
Форма контроля: реферат, электронная презентация.
Внеаудиторная самостоятельная работа №15
Тема: Классификация химических реакций. Каталитические реакции. Тепловой эффект. Термохимические уравнения.
Количество часов: 1.
Цель: обобщить знания о типах химических реакций, закрепить навык решения задач на тепловой эффект.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Какое количество теплоты потребуется для разложения 1,5 т карбоната кальция в соответствии с термохимическим уравнением реакции:
СаСО3 = СаО + Н2О - 187 кДж
2. Какое количество вещества железа образуется в результате взаимодействия 640 г оксида железа (III), содержащего 5 % примесей, с избытком алюминия?
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №16
Тема: Окислительно-восстановительные реакции. Метод электронного баланса.
Количество часов: 1.
Цель: закрепить знания о степень окисления химических элементов в соединении, научиться расставлять коэффициенты методом электронного баланса в уравнении реакции.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Определите степени окисления элементов в соединениях, имеющих формулы: Са3Р2, Р2О5, Н3РО4, Са3(РО4)2, Н4Р2О7.
2. Азотная кислота любой концентрации восстанавливается металлами не до водорода, а, например, до оксида азота (II). Расставьте коэффициенты методом электронного баланса в уравнении реакции азотной кислоты с медью:
Сu + HNO3 Cu(NO3)2 + NO + H2O
3. Химические свойства металлов характеризуются одним словом ‒ восстановители. Напишите уравнения реакций алюминия: а) с соляной кислотой; б) хлоридом меди (II); в) кислородом; г) серой. Рассмотрите окислительно-восстановительные процессы.
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №17
Тема: Скорость химических реакций. Факторы, влияющие на скорость химических реакций.
Количество часов: 1.
Цель: обобщить знания о скорости химических реакций, закрепить навык решения задач на определение скорости химической реакции.
Общие указания к выполнению работы:
Решить следующие задачи:
1. За 12 мин концентрация одного из реагентов изменилась от 0,44 до 0,20 моль/л. Рассчитайте среднюю скорость реакции за данный промежуток времени.
2. Во сколько раз возрастает скорость реакции при увеличении температуры от 10 до 40С, если температурный коэффициент равен 2?
3. При понижении температуры реакции от 100 до 70С скорость реакции уменьшилась в 27 раз. Рассчитайте температурный коэффициент.
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №18
Тема: Обратимость химических реакций. Химическое равновесие.
Количество часов: 2.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык подготовки электронной презентации и публичного сообщения.
Общие указания к выполнению работы:
Подготовить реферат и электронную презентацию на одну из тем по выбору:
1. Факторы, влияющие на скорость химической реакции.
2. Химическая кинетика и ее значение.
3. Влияние концентрации на скорость реакции.
4. Влияние природы реагирующих веществ на скорость реакции.
5. Влияние катализаторов и ингибиторов на скорость химической реакции.
6. Химическое равновесие и способы его смещения.
Форма контроля: реферат, составление электронной презентации.
Внеаудиторная самостоятельная работа №19
Тема: Металлы. Положение их в периодической системе. Свойства металлов.
Количество часов: 1.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык подготовки электронной презентации и публичного сообщения.
Общие указания к выполнению работы:
Ответьте письменно на следующие вопросы:
1. К способам термической обработки металлов относятся отжиг, нормализация, закалка, отпуск. Где используют эти способы термической обработки металлов.
2. К способам химико-термической обработки металлов относятся цементация, азотирование, цианирование и диффузная металлизация. Где используют эти способы химико-термической обработки металлов.
Форма контоля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №20
Тема: Электрохимический ряд напряжения металлов.
Количество часов: 1.
Цель: обобщить знания о металлах, их положении в периодической системе и свойствах.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Сколько литров воздуха (н.у.) потребуется для сжигания 36 г магния, содержащего 2,5 % примеси оксида этого металла? (Напоминаем, что объемная доля кислорода в воздухе составляет 0,21).
2. Сколько миллилитров водорода (н.у.) может быть получено при растворении в воде 120 мг кальция, если выход газа составляет 80 % от теоретически возможного?
3. Определите коэффициенты в следующем уравнении реакции, используя метод электронного баланса:
Са + HNО3 Ca(NО3)2 + N2О + H2О
Какой ион проявляет в этой реакции окислительные свойства?
Форма контроля: сдача результатов работы в письменном виде.
Внеаудиторная самостоятельная работа №21
Тема: Способы получения металлов. Металлургия. Сплавы. Металлы главных подгрупп. Металлы побочных подгрупп.
Количество часов: 1.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык подготовки публичного сообщения.
Общие указания к выполнению работы:
Подготовить реферат на одну из тем по выбору:
1. Способы получения металлов.
2. Практическое применение электролиза: рафинирование, гальванопластика, гальваностегия.
3. История получения и производства алюминия.
4. Электролитическое получение и рафинирование меди.
5. Развитие металлургии в РФ.
6. Восстановительные свойства металлов.
7. Использование металлов в промышленности.
8. Использование металлов в повседневной жизни.
9. Роль металлов в истории человеческой цивилизации. 10. История отечественной черной металлургии.
11. Современное металлургическое производство.
12. История отечественной цветной металлургии. Роль металлов и сплавов в научно-техническом прогрессе.
13. Коррозия металлов и способы защиты от коррозии.
Форма контроля: реферат.
Внеаудиторная самостоятельная работа №22
Тема: Неметаллы, положение их в периодической системе, свойства.
Количество часов: 1.
Цель: научиться осуществлять подбор необходимой литературы, вычленять из нее главное, систематизировать имеющийся материал, развивать навык подготовки электронной презентации и публичного сообщения.
Общие указания к выполнению работы:
Подготовить электронную презентацию на одну из тем по выбору:
1. Назовите области применения серы, фосфора, хлора, углерода, азота.
2. Работа кислородного цеха или завода вашего региона. Где используется продукция этого предприятия?
3. Серная кислота «хлеб химической промышленности».
4. Использование минеральных кислот на предприятиях различного профиля.
5. Принцип действия свинцового аккумулятора.
Форма контроля: создание электронных презентаций по теме.
Внеаудиторная самостоятельная работа №23
Тема: Окислительные и восстановительные свойства неметаллов. Галогены, их свойства.
Количество часов: 1.
Цель: обобщить знания о неметаллах, их окислительно-восстановительных свойствах.
Общие указания к выполнению работы:
Решить следующие задачи:
1. Сколько тонн 98 %-й серной кислоты можно получить из 2,5 т серы, содержащей 8 % примесей?
2. Сколько тонн воды необходимо добавить к 1,5 т 20 %-го олеума, чтобы получить 98 %-ю серную кислоту?
3. Как, используя один реактив, распознать растворы сульфида, сульфита и сульфата натрия? Напишите уравнения реакций в молекулярной и ионной формах.
Форма контроля: сдача результатов работы в письменном виде.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ И ИНТЕРНЕТ-РЕСУРСОВ
Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник / О.С. Габриелян, И.Г. Остроумов. М.: Академия, 2015. 256 с.
Габриелян О.С., Лысова Г.Г. Химия. Тесты, задачи и упражнения: учеб. пособие для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО.– М., 2017.
Ерохин Ю.М. Сборник тестовых заданий по химии: учеб. пособие для студ. учреждений сред. проф. образования. М., 2014.
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического профиля. Электронный учебно-методический комплекс. М., 2014.
Сладков С. А., Остроумов И.Г., Габриелян О.С., Лукьянова Н.Н. Химия для профессий и специальностей технического профиля. Электронное приложение (электронное учебное издание) для студ. учреждений сред. проф. образования. М., 2014.
www.hemi.wallst.ru (Образовательный сайт для школьников «Химия»).
www.alhimikov.net (Образовательный сайт для школьников).
www.chem.msu.su (Электронная библиотека по химии).
www.enauki.ru (интернет-издание для учителей «Естественные науки»).
www.1september.ru (методическая газета «Первое сентября»).
www.hvsh.ru (журнал «Химия в школе»).
www.hij.ru (журнал «Химия и жизнь»).
www.chemistry-chemists.com (электронный журнал «Химики и химия»).
10























