Просмотр содержимого документа
«Разработка урока в 11-м классе "Зависимость скорости реакции от различных факторов."»
11 класс ХИМИЯ Урок № 25
Тема: Зависимость скорости реакции от различных факторов.
Цель: дать понятие о законе действующих масс; рассмотреть факторы, влияющие на скорость химической реакции; научить решать задачи с использованием температурного коэффициента; развивать умения решать задачи; воспитывать чувство коллективизма и ответственности перед товарищами.
Тип урока: комбинированный.
Оборудование: раздаточный материал.
ХОД УРОКА
I Организация класса.
II Проверка домашнего задания.
(Рассказ учащихся, решение задачи у доски).
III Актуализация опорных знаний.
(Беседа).
IV Сообщение темы, цели и задач урока, мотивация учебной деятельности.
V Изучение нового материала.
Факторы, влияющие на скорость химической реакции. (Работа с учебником в группах по заданиям).
Закон действующих масс. (Рассказ учителя).
В 1865 г. профессор Н. Н. Бекетов впервые высказал гипотезу о количественной взаимосвязи между массами реагентов и временем течения реакции: «... притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действия масс, который был установлен в 1867 г. двумя норвежскими химиками К. М. Гульдбергом и П. Вааге. Современная формулировка закона действия масс такова: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степе нях, равных стехиометрическим коэффициентам в уравненш реакции.
Для реакции аА + bВ = тМ + nN кинетическое уравнение за-кона действия масс имеет вид:
 , (3.5)
, (3.5)
где  - скорость реакции;
- скорость реакции;
k - коэффициент пропорциональности, называемый константой скорости химической реакции (при  = 1 моль/дм3 k численно равна
= 1 моль/дм3 k численно равна  );
); 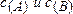 - концентрации реагентов, участвующих в реакции.
- концентрации реагентов, участвующих в реакции.
Константа скорости химической реакции не зависит от концентрации реагентов, а определяется природой реагирующих веществ и условиями протекания реакций (температурой, наличием катализатора). Для конкретной реакции, протекающей при данных условиях, константа скорости есть величина постоянная.
Пример 3. Написать кинетическое уравнение закона действия масс для реакции:
2NO (г) + С12 (г) = 2NOCl (г).
Решение. Уравнение (3.5) для данной химической реакции имеет :ледующий вид:
 .
.
Для гетерогенных химических реакций в уравнение закона действующих масс входят концентрации только тех веществ, которые находятся в газовой или жидкой фазах. Концентрация вещества, находящегося в твердой фазе, обычно постоянна и входит в константу скорости.
Пример 4. Написать кинетическое уравнение закона действия масс для реакций:
a)4Fe(т) + 3O2(г) = 2Fe2O3(т);
б) СаСОз (т) = СаО (т) + СО2 (г).
Решение. Уравнение (3.5) для данных реакций будет иметь следующий вид:
a) 6)
6)
Поскольку карбонат кальция - твердое вещество, концентрация которого не изменяется в ходе реакции, т. е. в данном случае скорость реакции при определенной температуре постоянна.
Зависимость скорости реакции от изменения температуры. (Рассказ учителя).
VI Закрепление изученного, выработка умений и навыков.
Решение задач. (Работа учащихся с карточками в парах).
VII Итог урока, задание на дом: выучить §12, с. 53-55, решить задачу 2, с. 63.
























