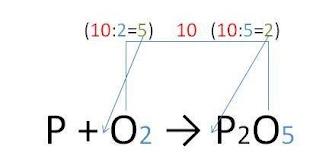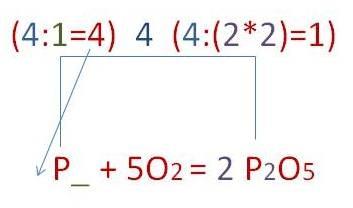| Д авайте вспомним с чего начинают изучать иностранный язык. На доске выстраивается следующая схема: авайте вспомним с чего начинают изучать иностранный язык. На доске выстраивается следующая схема: АЛФАВИТ
СЛОГИ 
ПРЕДЛОЖЕНИЯ В химии мы сначала изучаем ХИМИЧЕСКИЕ ЗНАКИ 
ХИМИЧЕСКИЕ ФОРМУЛЫ 
ХИМИЧЕСКИЕ УРАВНЕНИЯ На доске формулы, их нужно назвать и определить класс веществ P2O5, Cu(OH)2,NO2, Zn(OH)2 , HCl, AgNO3, Fe2(SO4)3, CaS, H2SO4, AlBr3 Демонстрация опыта: взаимодействие цинка с соляной кислотой. Данную реакцию можно записать с помощью химического уравнения: Zn + 2HCL = ZnCL2 + H2. Реагенты – вещества, которые вступают в реакцию. Продукты реакции – вещества, которые получились в результате реакции. Закон сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ. С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка. Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки. Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым. Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции. Закон сохранения массы веществ применяется при составлении уравнений химических реакций. Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов. Алгоритм составления уравнения химической реакции Составим уравнение химической реакции взаимодействия фосфора и кислорода 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → 2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции. Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше. В данном случае это атомы кислорода. Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10: 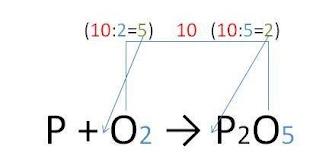
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции: 
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом: 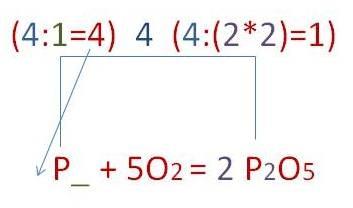
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен: 4P + 5O2 = 2P2O5 | 






 авайте вспомним с чего начинают изучать иностранный язык. На доске выстраивается следующая схема:
авайте вспомним с чего начинают изучать иностранный язык. На доске выстраивается следующая схема: