Урок химии по теме "Фенолы"
Цель урока: формирование представлений о фенолах: классификации и особенностях строения молекулы, физических и химических свойствах, областях применения.
Задачи:
– обучающие: сформировать у учащихся знания о феноле, его строении, свойствах, применять знания о феноле и его свойствах;
– развивающие: формировать умение устанавливать взаимосвязь между составом, строением и свойствами веществ; продолжить формирование информационных умений через организацию работы с текстом учебника, с инструментами.
– воспитательные: формировать эмоционально-ценностное отношение к учебной проблеме и качества, необходимые для адаптации в современном информационном обществе.
- Деятельностные: формировать коммуникативные качества учащихся через организацию их работы в парах и группах, создать условия для развития познавательного интереса к предмету через использование медиа ресурсов на уроке.
Тип урока: урок получения новых знаний.
Планируемый результат:
Личностные умения:
Метапредметные умения:
Познавательные умения:
Регулятивные умения:
выполнять учебное задание в соответствии с целью;
соотносить учебные действия с известными правилами;
выполнять учебное действие в соответствии с планом.
Коммуникативные умения:
формулировать высказывание;
согласовывать позиции и находить общее решение;
адекватно использовать речевые средства и символы для представления результата.
Предметные умения:
Организация образовательного пространства:
Ресурсы:
Форма работы: индивидуальная, групповая, парная.
Ход урока
1. Организационный момент
Приветствие учащихся.
Этап I. Актуализация знаний
Учитель. Здравствуйте ребята! Сегодня начать урок я предлагаю с просмотра видеоролика. Каждый из нас хотя бы раз в жизни пробовал рисовать разными красками – акварелью, гуашью. Я приглашаю вас в мастерскую художника, где за 3 минуты он нас научит рисовать гуашевыми красками (видеоролик). https://www.youtube.com/watch?v=8hZZJC0Pq1Q
А из чего же делают гуашевые краски? В интернете я нашла состав гуашевой краски, фрагмент его я вам зачитаю: Клей (вишневый или гуммиарабик ) - 20 Вода - 70-100 Бычья желчь – 2-3 Фенол или тимол - 0,5-0,7 Как вы думаете, как связаны картины и гуашевые краски с темой нашего урока?
Ученики. В составе красок есть вещество - фенол.
Учитель Как вы думаете, о каком веществе мы будем говорить на уроке?
Ученики. О феноле
Учитель. Вещество было открыто в 1771 году. Было отмечено, что оно обладает красящими свойствами и поэтому его стали использовать в качестве красителя. В 1834 году немецкий химик Фридлиб Рунге обнаружил в продуктах перегонки каменноугольной смолы белое кристаллическое вещество с характерным запахом. В 1841 году французский химик-органик Огюст Лоран установил состав этого красителя. Он выяснил, что открытое Ф. Рюнге вещество обладает выраженными кислотными свойствами и является производным бензола. Годом позже его друг и коллега Шарль Фредерик Жерар назвал это вещество фенолом.
Сегодня мы изучим его состав, строение, свойства и применение.
Этап II. Изучение нового материала
1. Определение и классификация.
Учитель. Давайте посмотрим на структурные формулы представителей класса фенолов и найдем их общий признак.
Классификация фенолов
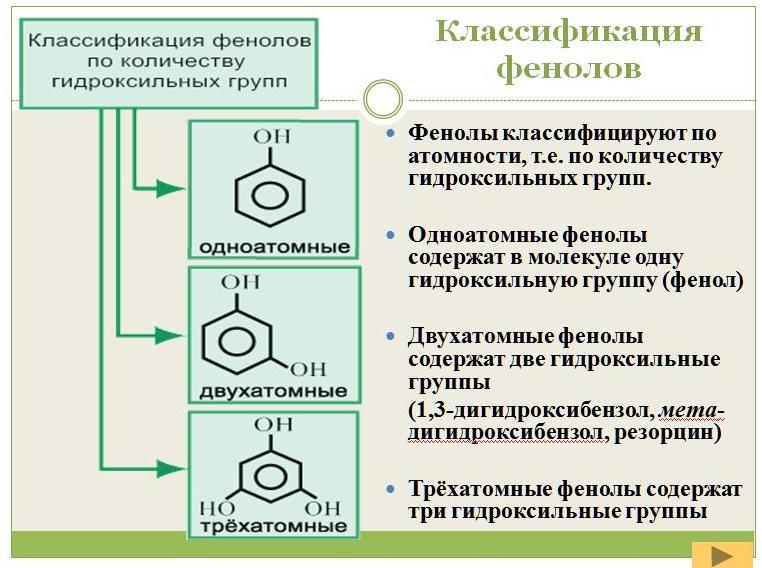
Рисунок 1. Классификация фенолов
Учитель. В чем сходство этих веществ?
Ученики. Наличие бензольного кольца.
Учитель. В чем отличие этих веществ?
Ученики. Разное число гидроксогрупп.
Учитель. В зависимости от числа гидроксогрупп различают одно-, двух-, трехатомные фенолы.
Учитель. Какое бы вы дали определение классу фенолов, используя данные об их общих признаках?
Ученики. Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильная группа (-ОН) непосредственно связана с атомами углерода в бензольном кольце. У фенолов атомы углерода в бензольном кольце принято обозначать цифрами от 1 до 6, начиная с атома углерода, связанного с ОН группой.
2. Гомология, изомерия и номенклатура фенолов
Учитель. Составим гомологический ряд фенолов. Как вы считаете куда будет встраиваться гомологическая разница –СН2-? Может ли изменяться число атомов углерода в бензольном кольце?
Ученики. Так как в бензольном кольце может быть только 6 атомов углерода, следовательно, у гомологов будут радикалы, присоединенные к атомам углерода в бензольном ядре.
Учитель. В связи с особенностями строения у фенолов возможны 2 типа изомерии: изомерия положения заместителей в бензольном кольце и изомерия боковой цепи (строения алкильного радикала и числа радикалов). Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета– и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
Родственник фенола – крезол – это смесь трех метильных производных фенола (о-крезол, м-крезол, п-крезол)
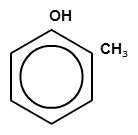
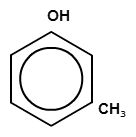

Рисунок 2. Виды крезолов
Сегодня мы с вами подробно изучим строение и свойства простейшего представителя – фенол.
Физические свойства
Учитель. Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления
Простейший представитель – фенол или карболовая кислота — бесцветное кристаллическое вещество, которое на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворяется в воде, выше 66 °C смешивается с водой в любых соотношениях.
Фенол обладает и другими свойствами. Вот как их описывает А.Чехов в произведении “Враги”: “… По случаю дифтерита вся прислуга еще с утра была выслана из дому. Кирилов, как был, без сюртука, в расстегнутой жилетке, не вытирая мокрого лица и рук, обожженных карболкой, пошел сам отворять дверь…”
О каких свойствах идет речь?
Ученики. Фенол способен вызывать ожоги и является антисептиком.
Учитель. В рассказе “Письмо” А.Чехов пишет такие строки: “ … Вчера я так увлекся книгой, что даже не обрадовался приезду Травникова, которого я люблю. Он приехал ко мне с головной болью и не в духе. После больших операций у него всегда болит голова — отравляется парами карболовой кислоты….”
О чем здесь идет речь?
Ученики. Фенол – токсичное вещество.
Учитель. Действительно, фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу. Попадая в организм, он быстро всасывается даже через неповрежденные участки кожи и уже через несколько минут начинает воздействовать на ткани головного мозга. Сначала возникает кратковременное возбуждение, а потом и паралич дыхательного центра. Даже при воздействии минимальных доз фенола наблюдается чихание, кашель, головная боль, головокружение, бледность, тошнота, упадок сил. Тяжелые случаи отравления характеризуются бессознательным состоянием, синюхой, затруднением дыхания, нечувствительностью роговицы, скорым, едва ощутимым пульсом, холодным потом, нередко судорогами.
5. Химические свойства
Учитель. Как вы думаете, какими свойствами может обладать фенол?
Ученики. Свойства могут быть обусловлены наличием гидроксогруппы, бензольного кольца.
Учитель. Рассмотрим свойства обусловленные наличием гидроксогруппы С активными металлами (просмотр видео) http://files.school-collection.edu.ru/dlrstore/2902f1c7-622b-d84b-fce5-f652d1cc81f7/0062.wmv
2C6H5-OH + 2Na – 2C6H5-ONa + H2
C6H5-OH + NaOH (водн. р-р) C6H5-ONa + H2O
Учитель. Взаимодействие фенолов с металлами и щелочами свидетельствует о проявлении ими каких свойств?
Ученики. Фенолы проявляют кислотные свойства.
Учитель. Кислотные свойства у фенолов выражены ярче, чем у предельных спиртов. По кислотным свойствам фенол превосходит этанол в 106 раз. При этом во столько же раз уступает уксусной кислоте.
Рассмотрим свойства фенола за счет бензольного кольца. Взаимное влияние атомов в молекуле фенола проявляется в большей реакционной способности бензольного ядра. Гидроксогруппа повышает электронную плотность в бензольном кольце в орто– и пара-положениях, поэтому фенол значительно активнее бензола вступает в реакции замещения в бензольном ядре.
Учитель. Фенол можно распознать с помощью качественных реакций
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (просмотр видео). http://files.school-collection.edu.ru/dlrstore/93fcbfc1-6dcb-1649-d4d9-7f5f264e89eb/47.wmv
6C6H5-OH + FeCl3 – [Fe(C6H5-OH)3](C6H5O)3 + 3HCl
Учитель. Делимся на 3 группы. На столе у каждой группы лежит листок с заданием. «В пронумерованных пробирках находятся водный раствор фенола, глицерин, этанол. А также реактивы: хлорид железа (III), сульфат меди (II) и гидроксид натрия. Предложите план распознавания этих веществ и распознайте их». На учительском столе стоит штатив с пронумерованными пробирками в которых находятся водный раствор фенола, глицерин, этанол. А также реактивы: хлорид железа (III), сульфат меди (II) и гидроксид натрия.
Ученики обсуждают в группе и вырабатывают план распознавания. От каждой группы представитель выходит к столу и практически осуществляет 1 из этапов плана.(2мин.) Не забываем про технику безопасности при работе с фенолом и щелочами. План распознавания веществ. 1. В пробу предполагаемого фенола добавим хлорид железа (III), наблюдаем фиолетовое окрашивание. Значит, исследуемое вещество-фенол.(1 ученик) 2. Приготовим гидроксид меди (II): CuSO4+2NaOH---Na2SO4+Cu(OH)2, наблюдаем образование голубого осадка. Прильем пробу предполагаемого глицерина. Наблюдаем ярко-синее окрашивание. Значит, исследуемое вещество-глицерин.(2 ученик) 3. В оставшейся пробирке находится этанол.(3 ученик)
6. Получение фенола
Кумольный способ получения фенола был разработан советскими учеными Сергеевым П.Г., Удрисом Р.Ю., Кружаловым Б.Д. в1949 г. Преимуществом этого метода является безотходная технология, так как выход полезных продуктов составляет 99% и экономичность. Сегодня кумольный способ используется как основной в мировом производстве фенола.
Из каменноугольной смолы
Из галогенбензолов

C6H5-SO3Na + NaOH – С6H5 – OH + Na2SO3
7. Применение фенолов
Фенолы применяются в производстве синтетических смол, пластмасс, полиамидов, лекарственных препаратов, красителей, поверхностно-активных веществ, антиоксидантов, антисептиков и взрывчатых веществ.
Этап III. Рефлексивная деятельность
Самоанализ и самооценка ученика:
Задание 1 (самоанализ). Закончите предложения.
Чтобы дать характеристику фенолам, нужно ................................................................
Чтобы правильно предположить свойства фенола надо ………… …………...
Задание 2 (самооценка). Закончите предложения.
Я доволен(льна) тем, что сегодня самостоятельно смог(ла) …………………
Я не доволен(льна) тем, что сегодня …………………………
Результаты деятельности вносятся учителем после освоения темы учащимися в портфель личных достижений.
Этап IV. Информация о домашнем задании
Параграф 10
Упражнение 1-4(устно)
Выполнить письменно в тетради задание по выбору:
(работа с дополнительными источниками).
Подведение итогов урока
Литература и сайты
Химия. 10 класс. Базовый уровень. Габриелян О.С.,М.:Дрофа,2013. 192с.
https://www.youtube.com/watch?v=8hZZJC0Pq1Q
http://ru.wikipedia.org/wiki/%D4%E5%ED%EE%EB – фенол
http://ru.wikisource.org/wiki/Враги_(Чехов) – Чехов А.П. Враги.
http://feb-web.ru/feb/chekhov/texts/sp0/sp7/sp7-511-.htm – Чехов А.П. Повести и рассказы (Письмо)
http://files.school-collection.edu.ru/dlrstore/2902f1c7-622b-d84b-fce5-f652d1cc81f7/0062.wmv – взаимодействие фенола с натрием
http://files.school-collection.edu.ru/dlrstore/0caf7a8d-7397-1c33-1bd0-904de4c907dc/46.wmv – взаимодействие фенола с гидроксидом натрия
http://files.school-collection.edu.ru/dlrstore/93fcbfc1-6dcb-1649-d4d9-7f5f264e89eb/47.wmv – взаимодействие фенола с бромной водой
http://school-collection.edu.ru/catalog/res/d7779891-8cff-11db-b606-0800200c9a66/view/ – качественная реакция на фенол


























