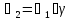СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 06.03.2024 13:30
Талицких Марина Владимировна
учитель химии, биологии
58 лет
Местоположение
Россия, Моздок
Специализация
Разработка урока по химии в 9 классе: "Скорость химической реакции"
Категория:
Химия
09.10.2018 19:01



 ) определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени.
) определяется изменением концентрации одного из реагирующих веществ или одного из продуктов реакции в единицу времени. = ±
= ± 
 Закон действующих масс:
Закон действующих масс:

 - коэффициент пропорциональности
- коэффициент пропорциональности