
Разбор заданий ОГЭ по химии (методические рекомендации)
09.11.2023

ОГЭ по химии, продолжительность 180 минут

Алгоритм подготовки к заданию №1
Атомы и молекулы. Химический элемент. Простые и сложные вещества
Пример 1:
Выберите два высказывания, в которых говорится о железе как химическом элементе.
1) Железо реагирует с хлором.
2) Железо быстро ржавеет во влажном воздухе.
3) Пирит является сырьём для получения железа.
4) Гемоглобин, содержащий железо, переносит кислород.
5) В состав ржавчины входит железо.
Химический элемент
- Относительная атомная масса элемента равна …
Простое вещество
2. Элемент входит в состав…
1. Простое вещество имеет
3. Элемент имеет изотопы
физические свойства
4. Вещество состоит из химического элемента
2. Простое вещество имеет
5. Элемент содержится в природе, в организме, в продуктах питания, в лекарствах
химические свойства
3. Что-то является сырьем для получения простого вещества
4. Простое вещество имеет молекулярную массу
Рекомендации
! Внимательно прочитать и анализировать задание

Алгоритм подготовки к заданию №2
Строение атома. Строение электронных оболочек атомов
! ПРАВИЛА
1.Число электронов в атоме равно порядковому номеру элемента в Периодической системе
2. A= Z+N, где
A – атомная масса элемента (сумма количества протонов и нейтронов)
Z –заряд ядра, порядковый номер, количество протонов и также электронов элемента
N – количество нейтронов
3. Число электронов на последнем (внешнем) слое определяется по номеру группы химического элемента.
4. Число электронных слоев (энергетических уровней) в атоме равно номеру периода.
5. Изотопы –имеют одинаковый заряд ядра, но разную атомную массу (разное количество нейтронов).
На данном рисунке изображена модель атома
1.Хлора
2. Азота
3. Магния
4. Фтора
Ответ 4
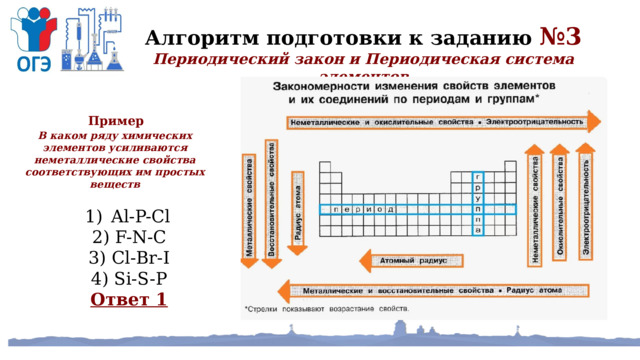
Алгоритм подготовки к заданию №3
Периодический закон и Периодическая система элементов
Пример В каком ряду химических элементов усиливаются неметаллические свойства соответствующих им простых веществ
2) F-N-C
3) Cl-Br-I
4) Si-S-P
Ответ 1
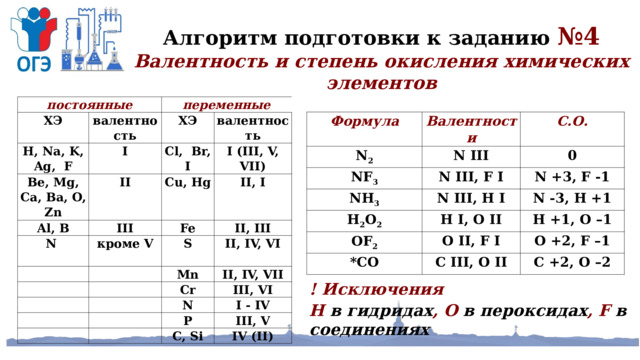
Алгоритм подготовки к заданию №4
Валентность и степень окисления химических элементов
постоянные
ХЭ
переменные
H, Na, K, Ag, F
валентность
Be, Mg, Ca, Ba, O, Zn
I
ХЭ
Al, В
Cl, Br, I
II
валентность
I (III, V, VII)
Cu, Hg
III
N
II, I
Fe
кроме V
II, III
S
Mn
II, IV, VI
II, IV, VII
Cr
III, VI
N
I - IV
P
III, V
C, Si
IV (II)
Формула
N 2
Валентности
N III
NF 3
С.О.
NH 3
0
N III, F I
H 2 O 2
N +3, F -1
N III, Н I
OF 2
Н I, О II
N -3, Н +1
Н +1, О –1
О II, F I
*СО
О +2, F –1
С III, О II
С +2, О –2
! Исключения
H в гидридах , О в пероксидах , F в соединениях

Алгоритм подготовки к заданию №4
Валентность и степень окисления химических элементов
ПРИМЕР
Установите соответствие между формулой соединения и степенью окисления фосфора в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА СОЕДИНЕНИЯ
А)
СТЕПЕНЬ ОКИСЛЕНИЯ ФОСФОРА
Б) H 4 P 2 O 7
В)
1) –3
2) +1
3) +3
4) +5
441
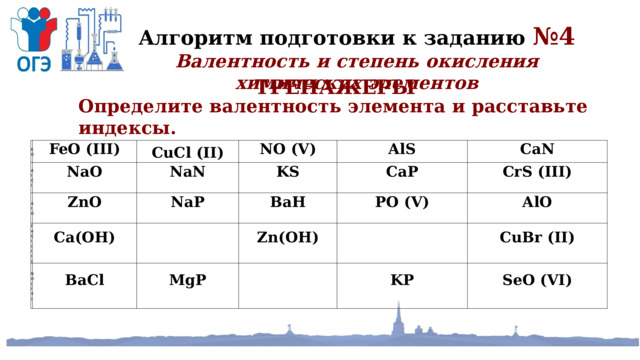
Алгоритм подготовки к заданию №4
Валентность и степень окисления химических элементов
ТРЕНАЖЕРЫ
Определите валентность элемента и расставьте индексы.
KO
AlCl
AlO
NaO
FeO (III)
FeCl (II)
ZnO
NaN
NO(IV)
KS
NaP
NO (V)
CuCl (II)
Ca(OH)
BaH
CaP
BaCl
ZnSO 4
AlS
PO (V)
CrS (III)
Zn(OH)
MgP
CaN
AlO
AgNO 3
NH 4 N
KP
CuBr (II)
SeO (VI)
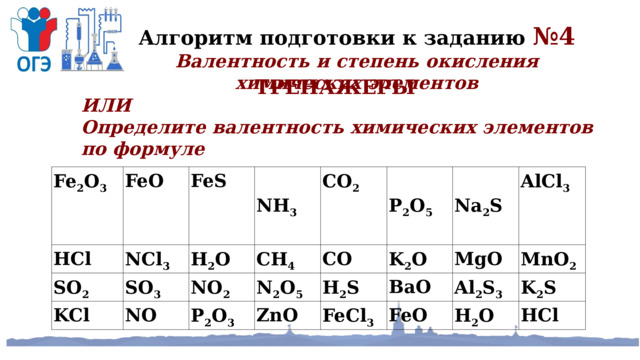
Алгоритм подготовки к заданию №4
Валентность и степень окисления химических элементов
ТРЕНАЖЕРЫ
ИЛИ
Определите валентность химических элементов по формуле
Fe 2 O 3
HCl
FeO
FeS
SO 2
NCl 3
SO 3
H 2 O
NH 3
KCl
NO 2
NO
CO 2
CH 4
P 2 O 3
N 2 O 5
CO
P 2 O 5
K 2 O
H 2 S
Na 2 S
ZnO
MgO
BaO
AlCl 3
FeCl 3
MnO 2
Al 2 S 3
FeO
K 2 S
H 2 O
HCl
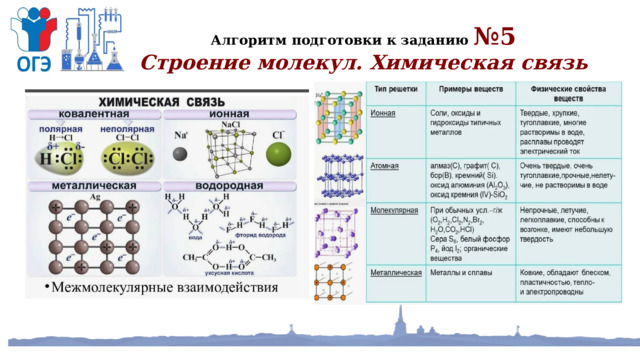
Алгоритм подготовки к заданию №5
Строение молекул. Химическая связь

Алгоритм подготовки к заданию №5
Строение молекул. Химическая связь
ПРИМЕР
Из предложенного перечня выберите два вещества немолекулярного строения, которые имеют ковалентную полярную химическую связь.
1) хлорид фосфора (III)
2) бромид кальция
3) нитрат магния
4) пероксид водорода
5) оксид кремния (IV)
35

Алгоритм подготовки к заданию №5
Строение молекул. Химическая связь
Дидактическая карточка (заполни таблицу )
Распределите вещества по типу кристаллической решетки и химической связи между элементами: S 8 , C 6 H 12 O 6 , NH 4 Cl, CaCO 3 , Fe 2 O 3 , I 2 , (NH 3 ) n , CO, HCl, NH 3 , (NH 4 ) 2 S, графит, кварц, этиловый спирт, Cr, F 2 , алмаз, бор, Ba 3 (PO 4 ) 2 , (HF) n , крахмал, фторид натрия, (H 2 O) n , CsCl, CH 3 COOH, CaSiO 3 , веселящий газ, бурый газ, сталь, карборунд
Ковалентно-неполярная связь,
молекулярная решетка
Ковалентно-полярная связь, молекулярная решетка
Ковалентно-неполярная связь, атомная решетка
Ионная связь,
Металлическая связь, металлическая решетка
ионная решетка
Водородная связь, молекулярная решетка

Алгоритм подготовки к заданию №6
Строение электронных оболочек атомов. Закономерности изменения свойств элементов
Характеристика
Заряд ядра
По периоду
Радиусы атомов
Возрастает
Число электронных слоев (номер периода)
По группе
(слева направо →)
Число валентных электронов (номер группы)
Возрастает
Электроотрицательность
(сверху вниз ↓)
Не изменяется
Металлические свойства
Энергия ионизации
Восстановительные свойства
Возрастает
Возрастает
Основные свойства оксидов и гидроксидов
Не изменяется
Неметаллические свойства
Убывают
Возрастают
Окислительные свойства
Возрастают
Убывают
Кислотные свойства оксидов и гидроксидов

Алгоритм подготовки к заданию №6
Строение электронных оболочек атомов. Закономерности изменения свойств элементов
ПРИМЕР
Какие два утверждения верны для характеристики как мышьяка, так и брома?
1) Химический элемент является p-элементом
2) Простое вещество, образуемое химическим элементом, при н. у. является газом
3) Химический элемент образует высший оксид общей формулой
4) Электроотрицательность химического элемента выше, чем у селена
5) Электроны в атоме расположены на четырех электронных слоях. (15)

Алгоритм подготовки к заданию №7
Простые и сложные вещества. Неорганические вещества
1 вариант
1
2
Na 3 PO 4
3
2 вариант
H 2 SO 4
1
4
2
NaCl
P
1
CuCl 2
3 вариант
5
Fe
3
4
Al 2 O 3
2
6
Na
SO 3
7
3
4 вариант
N 2 O 5
HCl
1
5
CO 2
8
4
Mg(OH) 2
SO 2
6
HNO 3
MgO
2
9
Ca
3
5
Al 2 (SO 4 ) 3
7
Cа(OH) 2
H 2 CO 3
4
8
Cu(OH) 2
10
FeO
6
H 2
NaOH
7
11
Na 2 O
S
Fe(OH) 3
CaO
5
9
8
12
10
H 2 S
H 2 SiO 3
Na 2 CO 3
6
KOH
Mg(NO 3 ) 2
7
9
11
P 2 O 5
N 2
FeS
8
H 3 PO 4
CaCO 3
10
12
CuSO 4
11
Mg
C
9
K 2 SO 4
10
Na 2 SiO 3
H 2 SO 3
12
O 2
11
K 2 S
HF
12
CuO
Определить классы соединений
! Примеры карточек с заданиями

Алгоритм подготовки к заданию №7
Простые и сложные неорганические вещества.
ПРИМЕР
Гидроксид стронция и фосфат аммония соответственно являются
1) амфотерным гидроксидом и средней солью
2) основанием и средней солью
3) оснόвным оксидом и кислотой
4) основанием и оснόвным оксидом (2)

Алгоритм подготовки к заданию №8
Химические свойства простых веществ. Химические свойства оксидов
Металлы реагируют с:
- водой (щелочные и щелочноземельные металлы реагируют с водой с образованием щелочи и H 2 , металлы средней активности – с образованием оксида и H 2 , металлы правее H не реагируют);
- неметаллами
- кислотами (с окислительными кислотами реагируют все металлы, кроме Au и Pt; с неокислительными кислотами только металлы левее Н);
- соединениями менее активных металлов (более активные металлы, начиная с Mg, вытесняют менее активные);
- Al и Zn (амфотерные) – со щелочами
Неметаллы реагируют с:
- металлами;
- неметаллами (неметалл, ближе к F становится с отриц. зарядом, дальше от F – с положит.);
- галогены – с солями менее активных галогенов (например, Cl 2 + CaBr 2 = CaCl 2 + Br 2 );
- водород H 2 и углерод C – с соединениями металлов
Нр: C+2FeO=Fe+CO 2 CuO +H 2 = Cu + H 2 O

Алгоритм подготовки к заданию №8
Химические свойства простых веществ. Химические свойства оксидов
Fe до степени окисления +3 могут окислить только галогены (F 2 , Cl 2 , Br 2 I 2 ) и окислительные кислоты (HNO 3 и H 2 SO 4(конц.) ). Остальные вещества могут окислять железо до +2. Кислород окисляет Fe 0 в Fe +2 и Fe +3 одновременно
Галогены (F 2 , Cl 2 , Br 2 , I 2 ) не реагируют с кислородом O 2 ; водород и азот не реагируют с фосфором
Азот N 2 - неактивное вещество, реагирует с кислородом, но только при температуре 2000-3000 0 С
Na и K при реакции с O 2 превращаются в пероксиды Na 2 O 2 , K 2 O 2 ; другие металлы - в оксиды Li 2 O, CaO и т.д.
Большинство реакций простых веществ протекают при нагревании .
Без нагревания способны вступать в реакции щелочные металлы и галогены.
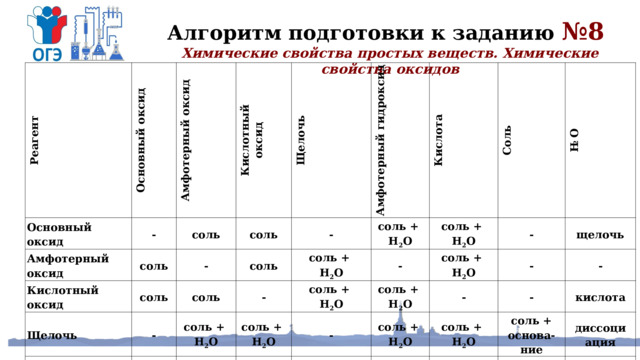
Алгоритм подготовки к заданию №8
Химические свойства простых веществ. Химические свойства оксидов
Реагент
Основный оксид
Основный оксид
Амфотерный оксид
Амфотерный оксид
-
Кислотный
соль
Кислотный
соль
оксид
Щелочь
Щелочь
оксид
соль
соль
-
-
Амфотерный гидроксид
соль
соль
-
Амфотерный гидроксид
-
соль +
Кислота
соль +
соль +
Кислота
соль +
H 2 O
H 2 O
соль +
H 2 O
-
соль +
H 2 O
Соль
соль +
Соль
соль +
-
H 2 O
H 2 O
соль +
H 2 O
соль +
соль +
H 2 O
-
H 2 O
-
-
соль +
H 2 O
соль +
H 2 O
-
H 2 O
-
H 2 O
-
соль +
-
щелочь
H 2 O
-
соль +
-
-
соль +
H 2 O
-
соль + основа-
H 2 O
H 2 O
соль +
кислота
соль +
соль + основа-
H 2 O
ние
-
-
ние
диссоци
-
H 2 O
соль + кислота
ация
-
соль + кислота
диссоци
соль + соль
ация
гидролиз

Алгоритм подготовки к заданию №8
Химические свойства простых веществ. Химические свойства оксидов
ПРИМЕР
Какие два из перечисленных веществ вступают в реакцию?
1) оксид цинка и оксид лития
2) оксид кальция и оксид магния
3) оксид углерода(IV) и оксид серы(IV)
4) оксид лития и оксид серы(IV)
5) оксид железа(III) и оксид алюминия (14)

Алгоритм подготовки к заданию №9
Химические свойства простых и сложных неорганических веществ
Генетическая связь веществ
Металл- основной оксид- основание- соль (Na -Na 2 O –NaOH – Na 2 SO 3 )
Неметалл – кислотный оксид – кислота –соль ( S – SO 2 – H 2 SO 3 -Na 2 SO 3 )
312

Алгоритм подготовки к заданию №10
Химические свойства простых и сложных веществ
142
Алгоритм подготовки к заданию №11
Химические реакции и уравнения
! Тренажеры, задания на карточках

Алгоритм подготовки к заданию №11
Химические реакции и уравнения
ПРИМЕР
Какие из приведённых реакций разложения не являются окислительно - восстановительными?
1)
2) NH 4 Cl =NH 3 +HCl
3) 3Fe(OH) 3 = Fe 2 O 3 +3H 2 O
4)
5)
! Тренажеры, задания на карточках
(23)
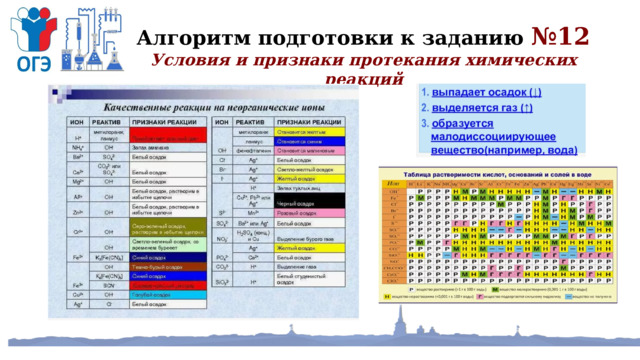
Алгоритм подготовки к заданию №12
Условия и признаки протекания химических реакций

Алгоритм подготовки к заданию №12
Условия и признаки протекания химических реакций
ПРИМЕР
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
РЕАГИРУЮЩИЕ ВЕЩЕСТВА
А) карбонат натрия и хлорид кальция
ПРИЗНАК РЕАКЦИИ
Б) хлорид алюминия и гидроксид кальция
В) сульфат аммония и гидроксид лития
1) выпадение белого осадка
2) выпадение чёрного осадка
3) выпадение голубого осадка
4) выделение бесцветного газа с резким запахом
(114)

Алгоритм подготовки к заданию №13
Электролиты и неэлектролиты. Катионы и анионы

Алгоритм подготовки к заданию №13
Электролиты и неэлектролиты. Катионы и анионы. Примеры карточек
1 . Впишите вместо пробелов необходимые слова.
Вещества - электролиты, которые при диссоциации в растворе образуют катионы водорода, называются _______, гидроксид анионы __________, катионы металла и анионы ________. Сильными называются электролиты, которые в растворе распадаются на ионы более чем на __%, слабыми ___%.
2. Запишите полные и сокращенные ионные уравнения для следующих реакций. Назовите все вещества:
а) BaCl 2 + AgNO 3 → NaNO 3 + AgCl; б) K 2 CO 3 + HBr → KBr + H 2 O + CO 2 ↑
в) Са(ОН) 2 + HNО 3 → Сa(NO 3 ) 2 + H 2 O г) BaS + NiCl 2 → BaCl 2 + NiS;
3. К сокращенному ионному уравнению подберите полное ионное и молекулярное уравнение. Назовите вещества:
а) Fe 3+ + 3OH — → Fe(OH) 3 ↓ б)2H + + CO 3 2— → CO 2 ↑ + H 2 O в)2Ag + + CO 3 2— → Ag 2 CO 3 ↓

Алгоритм подготовки к заданию №14
Реакции ионного обмена и условия их осуществления
ПРИМЕР

Алгоритм подготовки к заданию №15
Окислительно-восстановительные реакции
Окислительно - восстановительные реакции (ОВР), в процессе которых происходит изменение степеней окисления химических элементов.
ПАМЯТКА - ПОДСКАЗКА
-Если в реакции участвует простое вещество – это всегда ОВР!!!
-Реакции замещения – это всегда ОВР!!!
-Реакции обмена всегда не ОВР!!!

Алгоритм подготовки к заданию №15
Окислительно-восстановительные реакции
1.Окислитель принимает электроны, происходит процесс восстановления. С.О. элемента при этом уменьшается.
2.Восстановитель отдает электроны, происходит процесс окисления. С.О. элемента возрастает.
3. Атомы с минимальными значениями степени окисления могут быть только восстановителями.
4. Атомы с максимальными значениями степени окисления могут быть только окислителями.
5. Атомы с промежуточными значениями степени окисления могут быть и окислителями, и восстановителями.
Важнейшие восстановители : металлы; водород H 2 ; уголь C; оксид углерода(II) CO; сероводород H 2 S, сульфиды K 2 S; галогеноводороды HI, HBr; аммиак NH 3 .
Важнейшие окислители : галогены F 2 , Cl 2 ; кислород O 2 , озон O 3 ; соединения марганца KMnO 4 ; азотная кислота HNO 3 и её соли KNO 3 ; концентрированная серная кислота H 2 SO 4 ; ионы металлов.
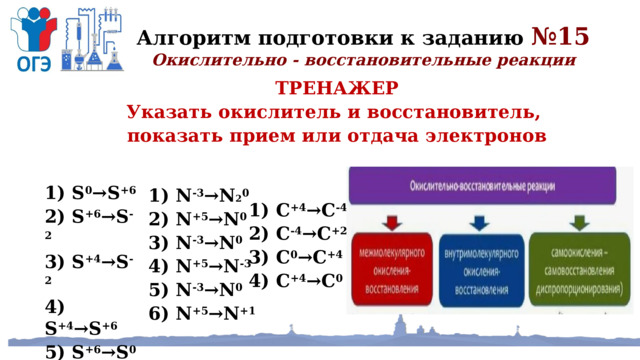
Алгоритм подготовки к заданию №15
Окислительно - восстановительные реакции
ТРЕНАЖЕР
Указать окислитель и восстановитель,
показать прием или отдача электронов
1) S 0 →S +6
2) S +6 →S -2
3) S +4 →S -2
4) S +4 →S +6
5) S +6 →S 0
6) S -2 →S +4
1) N -3 →N 2 0
2) N +5 →N 0
3) N -3 →N 0
4) N +5 →N -3
5) N -3 →N 0
6) N +5 →N +1
1) С +4 →С -4
2) С -4 →С +2
3) С 0 →С +4
4) С +4 →С 0

Алгоритм подготовки к заданию №15
Окислительно - восстановительные реакции
ПРИМЕР
Установите соответствие между схемой процесса, происходящего в окислительно - восстановительной реакции и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ПРОЦЕССА
НАЗВАНИЕ ПРОЦЕССА
А)
Б)
1) окисление
В)
2) Восстановление (112)

Алгоритм подготовки к заданию №16
Безопасность в лаборатории. Смеси. Химическое загрязнение

Алгоритм подготовки к заданию №16
Безопасность в лаборатории. Смеси. Химическое загрязнение
ПРИМЕР
1) Принимать пищу в лаборатории можно, но только в отведенном для этого месте.
2) При ознакомлении с запахом вещества открытую пробирку или колбу аккуратно подносят к носу и глубоко вдыхают пары.
3) Намагничивание относят к физическим способам разделения смеси.
4) Смесь воды и бензина нельзя разделить с помощью делительной воронки.
Запишите в поле ответа номер(а) верного (-ых) суждения (-й). (34)
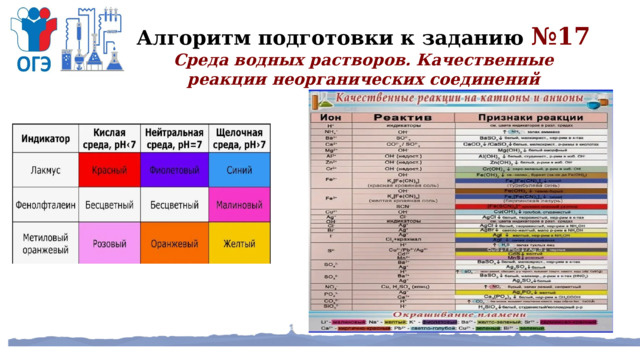
Алгоритм подготовки к заданию №17
Среда водных растворов. Качественные реакции неорганических соединений

Алгоритм подготовки к заданию №17
Среда водных растворов. Качественные реакции неорганических соединений
ПРИМЕР
(234)

Алгоритм подготовки к заданию №18
Вычисление массовой доли химического элемента в веществе
ПРИМЕР
Вычислите в процентах массовую водорода в дигидрофосфате кальция. Запишите число с точностью до целых.
РАСЧЕТЫ
M (Ca(H 2 PO 4 ) 2 ) = 234 г/моль
W (H) = 4/234•100% = 1.7%
ОТВЕТ: 2

Алгоритм подготовки к заданию №19
Вычисления массы элемента по его массовой доле в веществе
ПРИМЕР
Для подкормки растений в почву вносят 6 г фосфора на один квадратный метр. Какую массу (в граммах) простого суперфосфата Ca(H 2 PO 4 ) 2 нужно взять для подкормки 200 м 2 почвы? Запишите число с точностью до целых.
на 1 м 2 - 6 г фосфора
200 м 2 – X
m (P) =1200 г
Ca(H 2 PO 4 ) 2 -2P
234г/моль - 62г
X - 1200г
m (Ca(H 2 PO 4 ) 2 ) =4529 г
ОТВЕТ: 4529

Алгоритм подготовки к заданию №20
Окислительно-восстановительные реакции
ПРИМЕР
Используя метод электронного баланса, составьте уравнение реакции
MnSO 4 +KMnO 4 +H 2 O MnO 2 +K 2 SO 4 +H 2 SO 4
Определите окислитель и восстановитель.

Алгоритм подготовки к заданию №20
Окислительно-восстановительные реакции
КРИТЕРИИ ОЦЕНИВАНИЯ
Содержание верного ответа и указания по оцениванию
Элементы ответа:
(допускаются иные формулировки ответа, не искажающие его смысла)
Баллы
Ответ правильный и полный, включает все названные выше элементы
- Составлен электронный баланс:
2| Mn +7 + 3ē → Mn +4
3
Правильно записаны два элемента ответа
Правильно записан один элемент ответа
3| Mn +2 - 2ē → Mn +4
2
Все элементы ответа записаны неверно или отсутствуют
- Расставлены коэффициенты в уравнении реакции:
1
Максимальный балл
0
3MnSO 4 +2KMnO 4 + 2H 2 O = 5MnO 2 + K 2 SO 4 +2H 2 SO 4
3
3) Указано, что KMnO 4 (или марганец в степени окисления +7) является окислителем, а MnSO 4 (или марганец в степени окисления +2) – восстановителем

Алгоритм подготовки к заданию №20
Окислительно-восстановительные реакции
ТРЕНАЖЕР
1) Cr 2 (SO 4 ) 3 +H 2 O 2 +NaOH=Na 2 CrO 4 +Na 2 SO 4 +H 2 O
2) СuSO4+NaI=CuI+Na 2 SO4+I 2
3) FeSO 4 +KClO 3 +KOH=K 2 FeO 4 +KCl+K 2 SO 4 +H 2 O
4) KMnO 4 +HCl =MnCl 2 +Cl 2 +KCl+H 2 O
5) Ca(ClO) 2 +Na 2 S+H 2 O=CaCl 2 +S+NaOH
6) NH 3 +CuO=Cu+N 2 +H 2 O
7) Сu+HNO 3 (разб.)=Сu(NO 3 ) 2 +NO+H 2 O
8) KMnO 4 +H 2 SO 4 +FeSO 4 =MnSO 4 +S+Fe 2 (SO 4 ) 3 +K 2 SO 4 +H 2 O
9) Cr 2 O 3 +KNO 3 +KOH=K 2 CrO 4 +KNO 2 +H 2 O
10) СuS+HNO 3 (конц.)=СuSO 4 +NO 2 +H 2 O

Алгоритм подготовки к заданию №21
Химические свойства простых и сложных веществ
ПРИМЕР
![Алгоритм подготовки к заданию №21 Химические свойства простых и сложных веществ Критерии оценивания Содержание верного ответа и указания по оцениванию Элементы ответа: (допускаются иные формулировки ответа, не искажающие его смысла) Баллы Ответ правильный и полный, включает все названные выше элементы Написаны уравнения реакций, соответствующие схеме превращений: 1) Al 2 O 3 +6HBr = 2AlBr 3 + 3 H 2 O Правильно записаны три уравнения реакций 4 Правильно записаны два уравнения реакций 2) AlBr 3 + 3NaOH = Al(OH) 3 + 3NaBr 3 Правильно записано одно уравнение реакций 3) Al(OH) 3 + NaOH= Na[Al(OH) 4 ] 2 Все уравнения реакций записаны неверно или отсутствуют 1 Составлено сокращенное ионное уравнение второго превращения: 4) Al 3+- + 3OH - = Al(OH) 3 Максимальный балл 0 4](https://fsd.multiurok.ru/html/2024/03/28/s_6605a11b65b55/img43.jpg)
Алгоритм подготовки к заданию №21
Химические свойства простых и сложных веществ
Критерии оценивания
Содержание верного ответа и указания по оцениванию
Элементы ответа:
(допускаются иные формулировки ответа, не искажающие его смысла)
Баллы
Ответ правильный и полный, включает все названные выше элементы
Написаны уравнения реакций, соответствующие схеме превращений:
1) Al 2 O 3 +6HBr = 2AlBr 3 + 3 H 2 O
Правильно записаны три уравнения реакций
4
Правильно записаны два уравнения реакций
2) AlBr 3 + 3NaOH = Al(OH) 3 + 3NaBr
3
Правильно записано одно уравнение реакций
3) Al(OH) 3 + NaOH= Na[Al(OH) 4 ]
2
Все уравнения реакций записаны неверно или отсутствуют
1
Составлено сокращенное ионное уравнение второго превращения:
4) Al 3+- + 3OH - = Al(OH) 3
Максимальный балл
0
4

Алгоритм подготовки к заданию №22
Вычисление массовой доли растворенного вещества
ПРИМЕР
После пропускания через раствор гидроксида калия 0,896 л сероводорода (н. у.) получили 440 г раствора сульфида калия. Вычислите массовую долю соли в полученном растворе.

Алгоритм подготовки к заданию №22
Вычисление массовой доли растворенного вещества
КРИТЕРИИ ОЦЕНИВАНИЯ
Содержание верного ответа и указания по оцениванию
Элементы ответа:
(допускаются иные формулировки ответа, не искажающие его смысла)
Баллы
Ответ правильный и полный, включает все названные выше элементы
Составлено уравнение реакции:
1) H 2 S +2KOH = K 2 S + H 2 O
3
Правильно записаны два из названных выше элементов
2) Рассчитано количество вещества сульфида калия, полученного в результате реакции: n(H 2 S) = V(H 2 S ):V m = 0,896:22,4 = 0,04моль
Правильно записан один из названных выше элементов
2
по уравнению реакции n(K 2 S )= n(H 2 S)= 0,04моль
Все уравнения реакций записаны неверно или отсутствуют
1
Максимальный балл
3) Определена массовая доля сульфида калия в растворе:
0
m(K 2 S )= n(K 2 S ). M(K 2 S ) = 0,04.110= 4,4 г
3
w(K 2 S )= m( K 2 S) .100: m (раствора) = 4,4.100:440 = 1 %

Алгоритм подготовки к заданиям №23, 24
Экспериментальная задача, лабораторная работа
ПРИМЕР

Алгоритм подготовки к заданиям №23, 24
Экспериментальная задача, лабораторная работа
КРИТЕРИИ ОЦЕНИВАНИЯ
Содержание верного ответа и указания по оцениванию
Элементы ответа:
(допускаются иные формулировки ответа, не искажающие его смысла)
Баллы
Ответ правильный и полный, содержит все названные элементы
Составлены уравнения двух реакций, характеризующих химические свойства силиката калия, и указаны признаки их протекания:
1) K 2 SiO 3 +2HCl= H 2 SiO 3 +2KCl
Правильно записаны три элемента ответа
4
Правильно записаны два элемента ответа
2) выпадение прозрачного студенистого осадка
3
3) K 2 SiO 3 + Ca(NO 3 ) 2 = CaSiO 3 +2KNO 3
Правильно записан один элемент ответа
2
Все элементы ответа записаны неверно или отсутствуют
4) выпадение белого осадка
1
Максимальный балл
0
4

Спасибо за внимание!



















































![Алгоритм подготовки к заданию №21 Химические свойства простых и сложных веществ Критерии оценивания Содержание верного ответа и указания по оцениванию Элементы ответа: (допускаются иные формулировки ответа, не искажающие его смысла) Баллы Ответ правильный и полный, включает все названные выше элементы Написаны уравнения реакций, соответствующие схеме превращений: 1) Al 2 O 3 +6HBr = 2AlBr 3 + 3 H 2 O Правильно записаны три уравнения реакций 4 Правильно записаны два уравнения реакций 2) AlBr 3 + 3NaOH = Al(OH) 3 + 3NaBr 3 Правильно записано одно уравнение реакций 3) Al(OH) 3 + NaOH= Na[Al(OH) 4 ] 2 Все уравнения реакций записаны неверно или отсутствуют 1 Составлено сокращенное ионное уравнение второго превращения: 4) Al 3+- + 3OH - = Al(OH) 3 Максимальный балл 0 4](https://fsd.multiurok.ru/html/2024/03/28/s_6605a11b65b55/img43.jpg)
























