Разработка урока по теме
«Гидролиз солей».
9 класс
«Покажи мне и я забуду,
Скажи и я запомню,
Дай мне действовать и я научусь…»
китайская мудрость
Цели урока:
Сформировать у учащихся понятие о гидролизе.
Развивать у учащихся умение на основе наблюдений делать теоретические выводы и, наоборот, на основе теоретических знаний предсказывать результаты протекающих явлений.
Отрабатывать навыки самостоятельной работы с помощью "опоры".
Достигать значительного повышения доли активности самостоятельности учащихся при повышении мотивации за счет использования ИКТ.
Задачи урока:
Научить учащихся определять тип соли;
Научить составлять ионные уравнения гидролиза в молекулярном и ионном виде;
Научить распознавать растворы солей с помощью индикаторов;
Показать практическое значение гидролиза.
Метод: проблемно – поисковый.
Форма работы учащихся: работа в группах.
В ходе урока «Гидролиз солей» целенаправленно формируются универсальные учебные действия (УУД).
Личностные УУД:
Положительное отношение к учению; чувство необходимости учения;
Способность адекватно судить о причинах своих успехов/неуспехов в учении, связывая успех с усилиями, трудолюбием и старанием;
Сформированность учебных мотивов, стремление к самоизменению – приобретению новых знаний и умений;
Установление связи между учением и практической деятельностью.
Познавательные УУД:
Построение логической цепи рассуждений;
Выдвижение гипотез и их обоснование;
Как и где находить и выделять необходимую информацию; применение методов информационного поиска;
Умение осознанно строить речевое высказывание в устной и письменной форме;
Регулятивные УУД:
Умение контролировать процесс и результаты своей деятельности, включая сотрудничество с учителем и сверстниками;
Умение адекватно воспринимать оценки и отметки;
Умение осуществлять итоговый и пошаговый контроль;
Умение действовать по плану и планировать свою деятельность.
Коммуникативные УУД:
Умение аргументировать своё предложение, убеждать и уступать;
Способность сохранять доброжелательное отношение друг к другу в ситуации конфликта интересов;
Взаимоконтроль и взаимопомощь по уходу выполнения задания;
Умение с помощью вопросов получать необходимые сведения от партнёра по деятельности.
Оборудование: реактивы:в пробирках растворы солей карбоната натрия Na2CО3, хлорида алюминия АICI3, нитрата натрия NaСI, индикаторы: лакмусовый универсальный, фенолфталеин, метиловый оранжевый; мыло, силикатный клей, питьевая сода, растворы хлорида железа (III), карбоната натрия соляной кислоты, пробирки.
Ход урока.
Ориентировочно-мотивационный этап.
Перед тем как объявить тему урока, я хочу вам предложить литературный сюжет. Как известно, Шерлок Холмс (слайд) был не только знаменитым сыщиком, но и химиком-любителем со своей химической лабораторией. Причём последнее его хобби очень помогало ему в расследовании многих громких преступлений.
Я расскажу вам об одном из них. Из британского музея была похищена знаменитая алмазная корона, о чём немедленно было сообщено Шерлоку Холмсу. А спустя некоторое время этот ценный экспонат неизвестными похитителями был подброшен в музей. Работники музея усомнились в его подлинности.
Шерлок Холмс в начале своего расследования решил проверить подлинность алмазов. Для этого он (демонстрация опыта) один из камней растёр в ступке в порошок, затем добавил воды, фенолфталеин и пронаблюдал. Раствор приобрёл светло-малиновую окраску.
-Это подделка! Это стекло! – воскликнул он.
Посмотрите на формулу и строение алмаза, стекла (слайд). Ответить на вопрос, почему сыщик сделал такой вывод о подлинности алмазов, нам поможет тема урока «Гидролиз солей».
Китайская мудрость гласит: «Покажи мне и я забуду,
Скажи и я запомню,
Дай мне действовать и я научусь…»
Это эпиграф к нашему уроку, и я призываю вас сегодня действовать и самим активно искать ответ на этот вопрос, а я вам помогу.
Итак, тема нашего урока «Гидролиз солей» (от греч. hydro –вода,
lisis – разложение, распад).
Актуализация опорных знаний.
Если вы читали описанные Конан Дойлом приключения Шерлока Холмса, то, наверное, помните, что человеческий мозг он сравнивал с чердаком, в котором, по его мнению, не должно быть лишнего хлама. Кстати, знания по химии он хламом не считал.
Я призываю вас сегодня мыслить, думать, творить.
Итак, в путь. Первая остановка называется «Интеллектуальная разминка».
Перед вами перечень вопросов, на которые вы должны дать сейчас мне ответ. Работают теоретики, остальная часть группы им помогает.
Что такое электролиты? Электролитическая диссоциация?
Какие по силе бывают электролиты?
Приведите примеры сильных и слабых электролитов.
Перечислите сильные и слабые кислоты.
Какие основания являются сильными электролитами? Слабыми электролитами?
К какому типу электролитов относится вода? Как будет выглядеть уравнение диссоциации воды?
Дайте определение реакции нейтрализации.
Соль нитрат натрия NaСI можно получить в результате реакции нейтрализации между основанием … и кислотой … Какие по силе эти основания и кислота? Соль образована … основанием … и кислотой. Запишите уравнение диссоциации этой соли.
Соль карбонат натрия Na2CО3 можно получить в результате реакции нейтрализации между основанием … и кислотой … Какие по силе эти основания и кислота? Соль образована … основанием … и кислотой. Запишите уравнение диссоциации этой соли.
Соль хлорид алюминия АICI3 можно получить в результате реакции нейтрализации между основанием … и кислотой … Какие по силе эти основания и кислота? Соль образована … основанием … и кислотой. Запишите уравнение диссоциации этой соли.
Каким основанием и кислотой образована соль сульфид алюминия
АI2S3?
Какие ионы в растворе обуславливают кислую среду? Щелочную среду?
Какую реакцию среды будет иметь вода.
Катионы – это… Анионы –это…
Информационно- поисковый этап.
А теперь ознакомьтесь с заданием1 в рабочей тетради и выполните его в группах.
Работа в группах.
Задание 1.
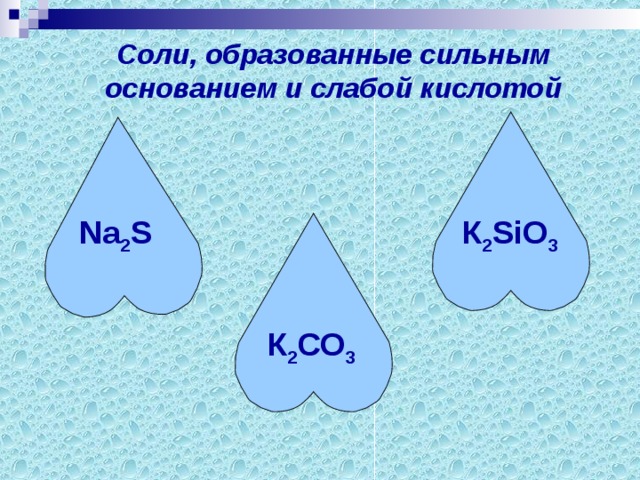
Группа1. Из перечня веществ выберите соли, образованные сильным основанием и слабой кислотой.
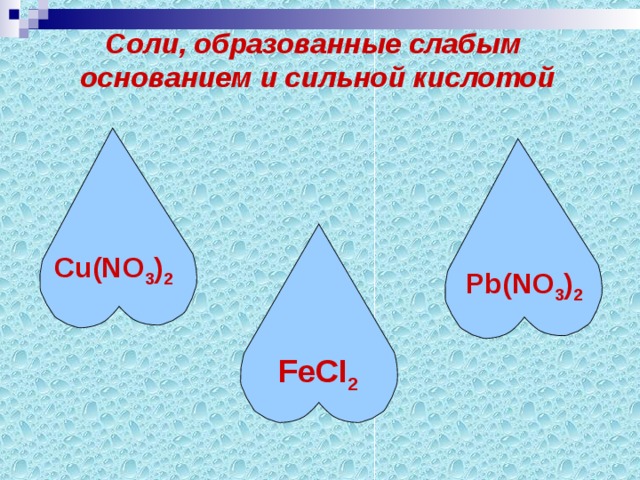
Группа2. Из перечня веществ выберите соли, образованные слабым основанием и сильной кислотой.
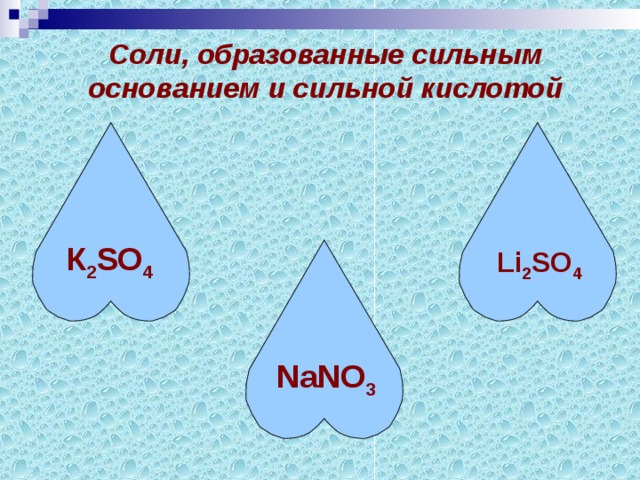
Группа3. Из перечня веществ выберите соли, образованные сильным основанием и сильной кислотой.
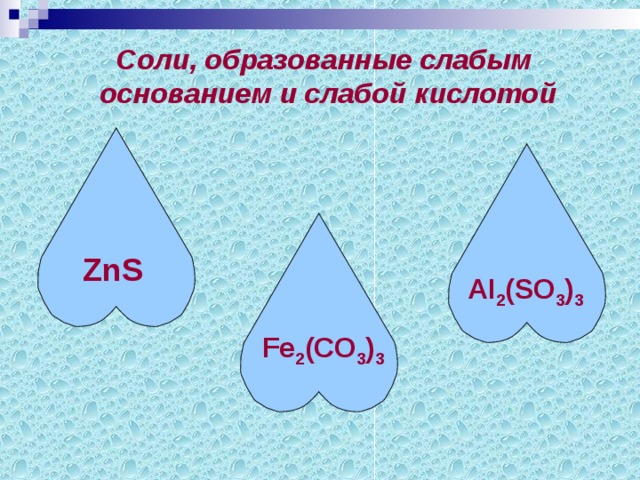
Группа4. Из перечня веществ выберите соли, образованные слабым основанием и слабой кислотой.
К2SO4, Cu(NO3)2, Na2S, ZnS, К2СО3, Fe2(СО3)3, К2SiO3, NaNO3, FeСI2,
Li2 SO4, АI2(SO3)3, Pb(NO3)2.
Проверка (слайды).
Вторая остановка - Экспериментально- теоретическая.
Ознакомьтесь с инструктивной картой. Прочитайте девиз. Проделайте в группах предложенный вам эксперимент.
Инструктивная карта.
«Опыт никогда не ошибается, ошибаются ваши суждения».
Леонардо до Винчи.
Лабораторный опыт 1.
Соблюдайте правила по технике безопасности.
Цель: изучить действие некоторых солей на индикаторы.
Реактивы: растворы солей карбоната натрия Na2CО3, хлорида алюминия АICI3, нитрата натрия NaСI, индикаторы: лакмусовый универсальный, фенолфталеин, метиловый оранжевый.
I группа
В пробирки с растворами веществ Na2CО3 поместите индикаторы: лакмусовый универсальный, фенолфталеин, метиловый оранжевый.
Что наблюдаете?
Опишите свои наблюдения.
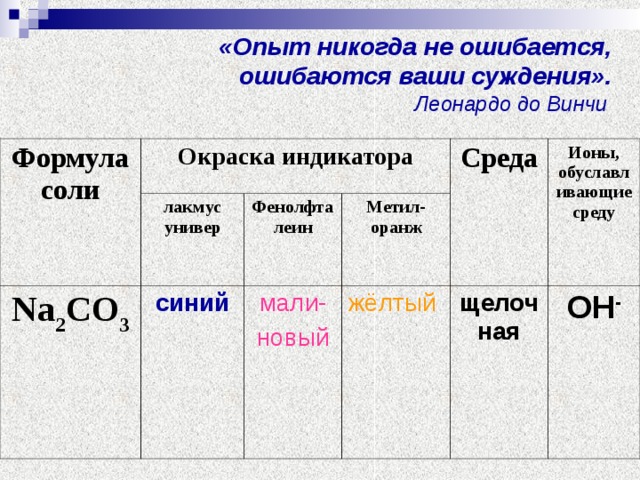
Результаты опыта запишите в таблицу:
| Формула соли | Окраска индикатора | Среда | Ионы, обуславливающие среду |
| лакмус универ | Фенолфта-леин | метилоранж |
| Na2CО3 |
|
|
|
|
|
Прокомментируйте свои наблюдения.
То, что увидели участники этой группы я предлагаю всем посмотреть на видеослайде.
II группа
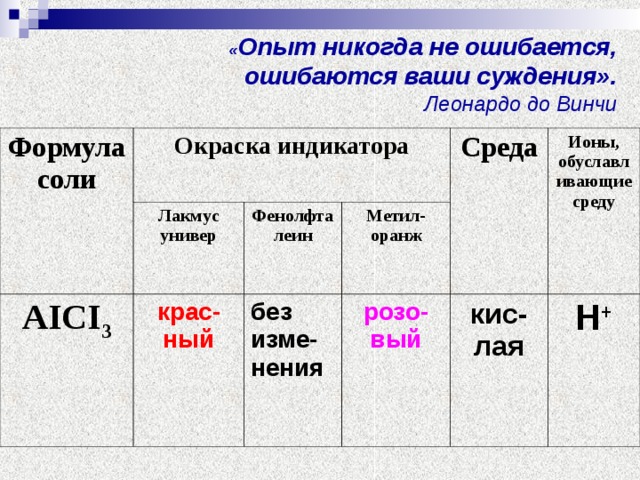
В пробирки с растворами веществ АICI3 поместите те же индикаторы.
Попробуйте вы прокомментировать происходящие процессы.
Что наблюдаете?
Опишите свои наблюдения.
Результаты опыта запишите в таблицу.
| Формула соли | Окраска индикатора | Среда | Ионы, обуславливающие среду |
| лакмус универ | Фенолфта-леин | метилоранж |
| АICI3 |
|
|
|
|
|
Внимание! Видеослайд.
IIIгруппа
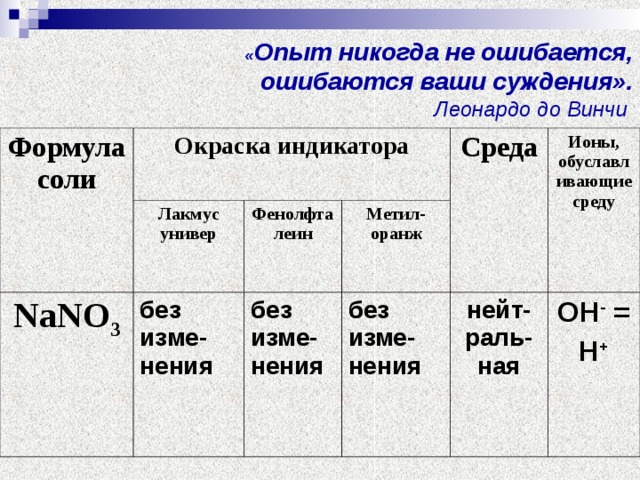
в) В пробирки с растворами веществ NаNO3 поместите те же индикаторы.
Попробуйте вы прокомментировать происходящие процессы.
Что наблюдаете?
Опишите свои наблюдения.
Результаты опыта запишите в таблицу.
| Формула соли | Окраска индикатора | Среда | Ионы, обуславливающие среду |
| лакмус универ | Фенолфта-леин | метилоранж |
| NаNO3 |
|
|
|
|
|
IV группа.
К раствору хлорида железа (III) прилейте раствор карбоната натрия.
Что наблюдаете? Попробуйте составить уравнение реакции между предложенными солями.
Опишите свои наблюдения.
Каким основанием и какой кислотой образована данная соль?
Проблема. Как же можно объяснить тот факт, что в растворе некоторых солей индикатор универсальный изменил свою окраску.
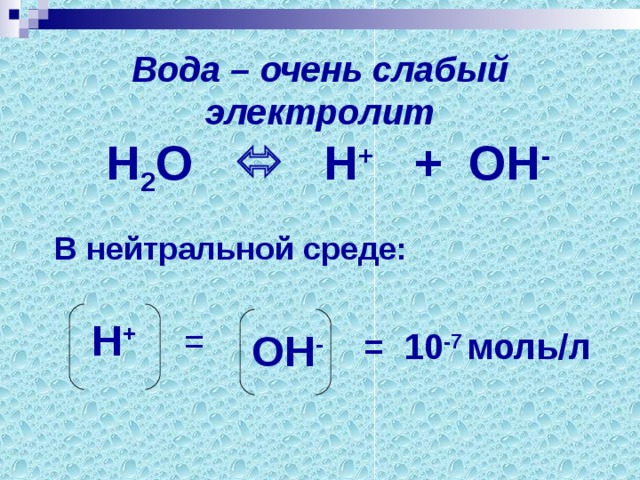
А дело в том, что в растворе, происходит химическая реакция соли с водой. Что представляет собой вода как электролит?
Вода – очень слабый электролит.
Н2О = Н+ + ОН-
В нейтральной среде: концентрации ионов Н+ и ОН- равны.
Рассмотрим каждый случай в отдельности.
(Слайд)
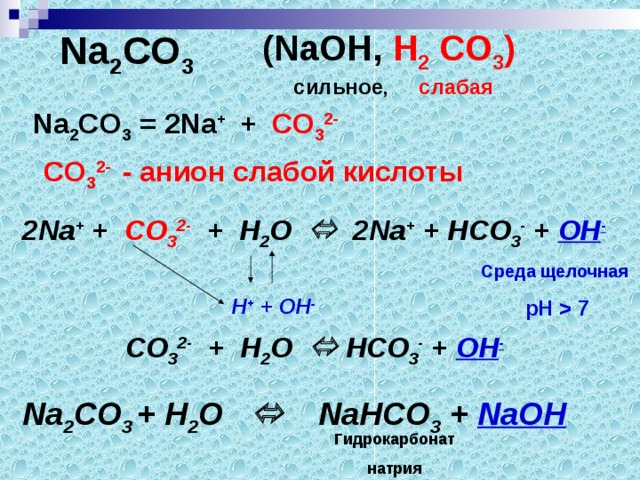
Запишем формулу карбоната натрия и укажем, каким основанием и какой кислотой образована эта соль, отметим силу электролитов.
Na2CО3 (NaОН, Н2 CО3)
сильное, слабая
В виде каких ионов данная соль находится в растворе?
2 Na+ + CО32-
Так как мы имеем дело с раствором соли, в реакции участвуют молекулы воды, которая в свою очередь является слабым электролитом. Связывающими ионами являются ионы слабого электролита (слабые ионы).
В нашем случае – это анион CО32-, значит гидролиз соли будет происходить по аниону.
2 Na+ + CО32- +Н2О Na+ + НCО3- + ОН-


Н+ + ОН-
Так выглядит полное ионное уравнение. Какие ионы не участвуют в реакции?
Краткое ионное уравнение выглядит так:
CО32- + Н2О НCО3- + ОН-
Молекулярное уравнение составляем согласно полному ионному:
Na2CО3 +Н2О NaНCО3 + NaОН
Данная реакция носит название – гидролиз – это обменная реакция соли с водой. (слайд)
Высвобождение каких ионов обуславливает среду раствора соли?
Сделайте вывод:
Соль, образованная …………основанием и …………кислотой, гидролизуется по ………..и даёт…………среду раствора.
В пробирки с растворами веществ АICI3 поместите те же индикаторы.
Попробуйте вы прокомментировать происходящие процессы. (Слайд)
Что наблюдаете?
Опишите свои наблюдения.
Результаты опыта запишите в таблицу.
Соль образована…
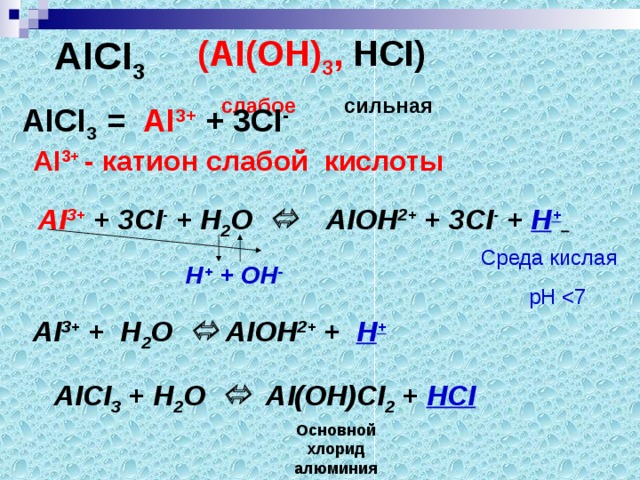
АICI3 (АI(ОН)3, НСI)
слабое сильная
Гидролиз соли будет происходить по …
А
 I3+ + 3CI- + Н2О АIОН2+ + 3CI- + Н+
I3+ + 3CI- + Н2О АIОН2+ + 3CI- + Н+
Н+ + ОН-
Краткое ионное уравнение:
АI3+ + Н2О АIОН2+ + Н+
Молекулярное уравнение:
АICI3 + Н2О АIОНCI2 + НCI
Сделайте вывод:
Соль, образованная …………основанием и …………кислотой, гидролизуется по ………..и даёт…………среду раствора.
Почему же в растворе хлорида натрия индикаторы показали нейтральную среду? (Слайд).
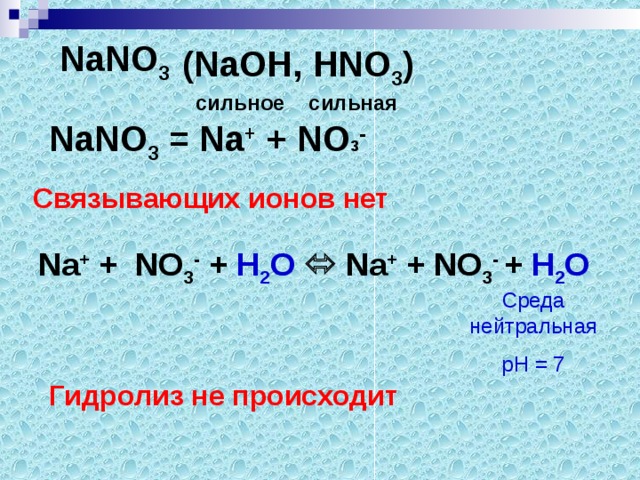
Соль образована…
NaСI (NaОН, НСI)
сильное сильная
Связывающих ионов нет, значит гидролизу соль подвергаться не будет.
Поэтому среда останется нейтральной.
Na+ + NO3- + Н2О Na+ + NO3- + Н2О
Сделайте вывод.
Соль, образованная …………основанием и …………кислотой…, среда раствора…….
Беседа.
Что вы можете сказать о соли карбонат железа (III) Fе2(СО3)3? (Слайд).
Какими по силе основанием и кислотой она образована?
Посмотрите на таблицу растворимости. Что вы видите в клетке, соответствующей этой соли? Почему здесь стоит прочерк?
Посмотрите видеофрагмент «Получение карбоната железа (III) Fе2(СО3)3»
Сделайте вывод.
Соль, образованная …………основанием и …………кислотой…, с образованием соответствующего… и соответствующей … гидролизуется ……
Запишите уравнение соответствующей ркакции.
Сделайте общий вывод о том, какие же соли отвечают гидролизу.
Вы хорошо поработали и заслужили музыкальную паузу отдыха. У нас сегодня водная тема, посмотрите на морские пейзажи, послушайте приятную музыку, расслабьтесь, отдохните.
«Мало знать, надо и применять, мало хотеть, надо и делать» - Гёте.
Последняя остановка – Практическая. Через две минуты вы должны ответить на предложенные вам практические вопросы. Вопросы имеют отношение к теме нашего урока.
Работаем в группах.
Инструктивная карта для группы №1.
На картинах О. Домье и Архипова «Прачки» вы видите женщин, измождённым тяжёлым физическим трудом. Их руки натружены, грубы, кожа рук красная, опухшая. Объясните, что явилось раздражителем для кожи рук прачек, если учесть, что стирали они хозяйственным мылом.
Справка. Мыло – это натриевая соль слабой органической кислоты. Формулу мыла можно записать NaR, где R – кислотный остаток слабой органической кислоты.
Задание.
Испытание мыла индикатором – лакмусом универсальным.
Реактивы: мыло, дистиллированная вода, индикатор лакмусовый универсальный.
Задание. Смочите водой лакмус универсальный, коснитесь им кусочка хозяйственного мыла.
Что наблюдаете? Результаты опыта объясните.
Инструктивная карта для группы №2.
Силикатный клей – это смесь силикатов калия и натрия Na2SiО3 и К2 SiО3 . Почему при попадании раствора данного клея на ткань, на последней остаётся неокрашенное пятно.
Задание.
Испытание раствора клея фенолфталеином.
Реактивы: силикатный клей, дистиллированная вода, фенолфталеин.
В пробирку с силикатным клеем добавьте дистиллированной воды. Капните в полученный раствор фенолфталеин.
Что наблюдаете? Результаты опыта объясните.
Инструктивная карта для группы №3.
«Кровь, надо знать, совсем особый сок». «Фауст», Гёте.
В состав крови входят следующие минеральные соли: NaСI, КСI, СаСI2.
Какова среда крови?
Заменитель крови – физиологический раствор – 0,9%-ный раствор хлорида натрия.
Можно ли использовать в качестве физиологического раствора, например, раствор хлорида железа(III)? Почему?
Задание.
Испытание раствора хлорида железа(III) индикатором лакмусом универсальным.
Реактивы: раствор хлорида железа(III), индикатор лакмус универсальный.
В пробирку с раствором хлорида железа(III) поместите индикатор лакмус универсальный.
Что наблюдаете? Результаты опыта объясните.
Инструктивная карта для группы №4.
Питьевую соду – гидрокарбонат натрия NaНСО3 используют в медицинской практике. Раствор этой соли применяют внутрь при повышенной кислотности желудочного сока, язвенной болезни желудка и двенадцатиперстной кишки, изжоге, подагре, диабете. Наружно употребляют как слабая щёлочь при ожогах, для полосканий, промываний и ингаляций при насморках, коньюктевитах, стоматитах и др.
Объясните такое применение данной соли.
Лабораторный опыт 2.
Реактивы: питьевая сода, вода, фенолфталеин, раствор соляной кислоты.
Задание. В пробирку наберите немного питьевой соды, добавьте воды. Капните несколько капель фенолфталеина. Что наблюдаете? К полученному раствору прилейте немного соляной кислоты. Можно ли данную реакцию отнести к реакции нейтрализации?
А теперь попробуйте ответить мне на вопрос, который я задала вам в начале урока: почему Шерлок Холмс сделал такой вывод о подлинности алмазов.
Домашнее задание:
§19.1, заполнить таблицу, написать уравнения гидролиза в ионном, молекулярном видах.
| Формула соли | Окраска индикатора | Среда | Ионы, обуславливающие среду |
| лакмус универ | Фенолфта-леин | метилоранж |
| K2S
|
|
|
|
|
|
| FeCI3
|
|
|
|
|
|
| Li2SO4
|
|
|
|
|
|
Наш урок близится к концу, и я хочу, чтобы вы его оценили.
Вашему вниманию я хочу предложить рефлексивный тест, поставьте столько плюсов, сколько считаете нужным.
Вы сегодня были деятельны и активны. На поставленные перед вами вопросы самостоятельно находили ответы, а я лишь немного вам помогала. Я надеюсь, что вы не только чему-то научились, но и получили удовольствие и то самого процесса познания, от своего участия в нём.
Закончить урок мне хочется словами выдающегося французского писателя Эмиля Золя: «Деятельность заключает награду в самой себе. Действовать, создавать, вступать в борьбу с обстоятельствами, побеждать их или чувствовать себя побеждённым – вот вся радость, всё человеческое здоровье заключается в этом».
10





















 7 C О 3 2- + Н 2 О Н C О 3 - + ОН - Na 2 C О 3 + Н 2 О Na Н C О 3 + Na ОН Гидрокарбонат натрия" width="640"
7 C О 3 2- + Н 2 О Н C О 3 - + ОН - Na 2 C О 3 + Н 2 О Na Н C О 3 + Na ОН Гидрокарбонат натрия" width="640"