Проверочная работа по химии в формате ОГЭ, вариант 1.
Выберите два высказывания, в которых говорится о хлоре как о простом веществе.
Хлор содержится в составе многих органических растворителей.
Относительная атомная масса хлора равна 35,45.
Хлор чрезвычайно токсичен, поэтому при работе с ним следует соблюдать меры безопасности.
В природе встречаются два изотопа хлора.
Впервые хлор был получен Шееле в 1774 г.
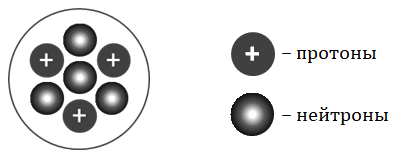
На рисунке изображена модель строения ядра атома некоторого химического элемента.
Запишите в таблицу номер периода (X), в котором данный химический элемент расположен в Периодической системе Д. И. Менделеева, и величину заряда ядра (Y) его атома. (Для записи ответа используйте арабские цифры.)
3. Расположите химические элементы
1) Магний
2) Кремний
3) Алюминий
в порядке увеличения их атомного радиуса.
Запишите указанные номера элементов в соответствующем порядке.
4. Установите соответствие между формулой соединения и степенью окисления железа в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЕДИНЕНИЯ | СТЕПЕНЬ ОКИСЛЕНИЯ ЖЕЛЕЗА |
| А) FeCO3 Б) Fe(NO3)2 В) Fe2O3 | 1) +6 2) +2 3) +3 4) +4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5. Из предложенного перечня выберите два вещества с ковалентной неполярной связью.
Ca
BaCl2
H2О2
S8
Р2O3
6. Какие два утверждения верны для характеристики как кремния, так и кислорода?
Соответствующее простое вещество является неметаллом
На внешнем энергетическом уровне в атоме находится два электрона
Значение электроотрицательности больше, чем у магния
Электроны в атоме расположены на трёх энергетических уровнях
В соединениях элемент проявляет только положительную степень окисления
7. Из предложенного перечня веществ выберите однооснóвную кислоту и основание.
HNO3
ZnO
H2S
Al(OH)3
Fe(OH)2
Запишите в поле ответа сначала номер однооснóвной кислоты, а затем номер основания.
8. Какие два из перечисленных веществ вступают в реакцию с хлором?
H2SO4
SiO2
FeCl2
Cu
Na2O
9. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) S Б) SO3 В) Ba(OH)2 | 1) HCl, CuCl2 2) H2SO4 (р-р), Mg 3) KOH, H2O 4) HNO3, O2 |
10. Из предложенного перечня выберите схемы двух реакций, которые относятся к реакциям разложения.
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Mg(OH)2 + H2SO4 → MgSO4 + H2O
Fe(NO3)3 → Fe2O3 + NO2 + O2
BaCl2 + K2SO4 → KCl + BaSO4
NH4NO3 → H2O + N2
11. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) KI и AgNO3 Б) Al и NaOH (р-р) В) HCl и Na2SO3 | 1) Выделение газа без запаха 2) Выделение газа с запахом 3) Выпадение белого осадка 4) Выпадение жёлтого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
12. Из предложенного перечня веществ выберите два слабых электролита.
SO3
Н2S
HNO2
HCl
СаО
13. Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
3Ba2+ + 2PO43– = Ba3(PO4)2
K3PO4
Ba(OH)2
H3PO4
BaCO3
BaO
BaSO4
14. Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) N+4 → N+3 Б) Al0 → Al+3 В) C–4 → C+4 | 1) Окисление 2) Восстановление |
Запишите в таблицу выбранные цифры под соответствующими буквами.
15. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти два вещества между собой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| А) BaCl2 и LiCl Б) LiCl и HCl В) ZnSO4 и NH4Cl | 1) NaOH 2) Лакмус 3) HNO3 4) K2SO4 |
16. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Cr + O2 + HCl → CrCl3 + H2O
Определите окислитель и восстановитель.
18. Дана схема превращений:
C → Х → Na2CO3 → CaCO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
19. К раствору с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). При этом образовался осадок массой 4,9 г. Определите массу исходного раствора щелочи. В ответе запишите уравнение реакции, о которой идет речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).

























