Федеральное окружное соревнование молодых исследователей центрального федерального округа «Шаг в будущее»
Центральная Россия
Направление — Точные науки
Секция - Нанотехнологии
Изготовление pH индикаторов на растительной основе
Россия, Липецк
Автор:
Малюкова Полина Ивановна
учащаяся 7 класса
МБОУ гимназия №19
Научный руководитель:
Грецкий Олег Владимирович
магистр кафедры химии ЛГТУ.
Оглавление
1.Введение………………………………………………………....................…...........….3
2. Основная часть ...…………………..…………………...............………....................4-6
2.1 Индикаторы....................................................................................................................4
2.2 Пигменты.....................................................................................................................4-6
3.Практическая часть........................................................................................................7-9
3.1 Получение индикатора...................................................................................................7
3.2 Тестирование полученного индикатора на основе антоцианов..............................7-9
3.2.1 Водный раствор индикатора....................................................................................7-8
3.2.2 Спиртовой раствор индикатора..................................................................................8-9
4. Выводы.............................................................................................................................10
5. Список литературы..........................................................................................................11
Изготовление pH индикаторов на растительной основе.
Малюкова Полина Ивановна
Россия, Липецкая область, г. Липецк, МБОУ гимназия №19
Научная статья
1. Введение
Природа разнообразна и загадочна. Нам кажется, что ничего сказочного в ней нет. Однако, каких только невероятных чудес не бывает в природе. В русском устном народном творчестве можно найти рассказы о различных растениях: травах, кустарниках, деревьях, которые обладают чудодейственной силой. Они указывают человеку на различные клады, нужно только уметь слышать и понимать язык растений.
Моя работа посвящена уникальным свойствам растений, которые не перестают удивлять человечество каждый раз.
Цель работы: изготовить и протестировать индикатор на растительной основе.
Гипотеза: индикатор на основе краснокочанной капусты можно использовать в широком диапазоне pH.
Объект исследования : индикатор на растительной основе.
Предмет исследования: антоцианы, содержащиеся содержащиеся в краснокочанной капусте.
Задачи:
Изучить научную литературу по теме исследования.
Изготовить индикатор из краснокочанной капусты.
Провести тестирование полученного индикатор.
Доказать, что индикатор пригоден для распознавания среды в широком диапазоне pH.
Методы исследования:
общелогические (анализ, обобщение)
эмпирические (наблюдение, эксперимент, измерение, описание, сравнение
Новизна работы: изготовить полученный индикатор можно не только в лабораторных условиях, но и в домашних.
2. Основная часть
2.1 Индикаторы
Индикаторы - это вещества, которые изменяют свой цвет в зависимости от среды раствора. Следовательно, в плодах растений, листьях и цветах содержатся природные красители(пигменты), которые под действием щелочных растворов меняют свой цвет на синий или фиолетовый, а под воздействием кислот становятся красными. Возникает вопрос – что это за природные индикаторы, которые содержатся в плодах и ягодах?
В химической энциклопедии рассмотрены индикаторы кислотно-основные, окислительно-восстановительные, комплексонометрические, адсорбционные, изотопные, люминесцентные. Индикаторы всех этих шести групп говорят химикам о том, как далеко зашли изменения в реакционной системе. Некоторые из них даже светятся под действием произошедших в растворе изменений. Индикаторы действуют безотказно и отличаются большой чувствительностью [1].
Вероятнее всего, самым древним кислотно-основным индикатором является лакмус. Лакмус был известен уже в Древнем Египте и Древнем Риме. Лакмус – это красящее вещество, которое добывают из некоторых видов лишайников. Фактически природный лакмус представляет собой сложную смесь. Лакмус в древности использовали в качестве фиолетовой краски, но со временем, рецепт его приготовления был утерян. В 1640 ботаники описали гелиотроп– это душистое растение с темно-лиловыми цветками, из которого было выделено красящее вещество. Этот краситель, так же, как и сок фиалок, стал широко применяться химиками в качестве индикатора. Этот индикатор в кислой среде был красным, а в щелочной – приобретает синий цвет.
В 1667 году знаменитый химик и физик Роберт Бойль предложил пропитывать фильтровальную бумагу отваром тропического лишайника – лакмуса, а также отварами фиалок и васильков, и таким образом положил начало применению индикаторной (лакмусовой) бумаги.
2.2 Пигменты
Цвет растений определяется химическим составом клеточного содержимого каждого растения (пигментом). Значит, индикаторы можно найти и в природе. Пигменты многих растений способны менять цвет в зависимости от кислотности клеточного сока. Поэтому, пигменты являются индикаторами, которые можно применить для исследования кислотности растворов.
Растительные пигменты - это большие органические молекулы сложного строения. Они выполняют важные физиологические функции, например, в процессе фотосинтеза превращают часть световой энергии в энергию химических реакций, регулируют ростовые процессы роста и подготовку растения к фазе покоя. Кроме того, яркая окраска цветов привлекает опыляющих насекомых, а некоторые пигменты токсичны для организмов-паразитов. Пигменты могут присутствовать у растений в различных органах (в стеблях, листьях, корнях, цветках, пыльце) а также в плодах и семенах. При этом они могут постоянно находиться в клетке, либо появляться на время в определенной стадии развития или при некоторых внешних условиях. практически все краски растений — от оранжевой и красной до синей. Особый интерес представляют пигменты третьей группы – антоцианы, которые обладают хорошими индикаторными свойствами.
Чаще всего встречаются зеленые пигменты хлорофиллы, но есть и другие виды хлорофиллов:
• Антоцианы
• Каротиноиды
• Хлорофиллы
• Флафоновые
Антоцианы
Термин антоциан происходит в переводе с греческого - лазоревый, введен в 1835 года немецким ботаником Людвигом Марквартом
Окраску красных, оранжевых, пурпурных, розовых, сиреневых, синих и фиолетовых цветков и плодов определяют - антоцианы. Эта группа пигментов образуется в процессах гидролиза крахмала и по своему происхождению являются безазотистыми соединениями, близким к глюкозидам - соединениям сахара с не углеводной частью. Антоцианы хорошо растворимы в воде и присутствуют в соке вакуолей. Цвета изменяются благодаря наличию в растении всего трёх моделей антоцианов. Эти пигменты в растениях дают разную окраску лепестков. В зависимости от кислотности (рН) среды сока вакуолей, антоциан придаёт ту или иную окраску. В кислой среде он обычно имеет красные тона, например, у герани, гортензии, фиалок. В щелочной среде эти растения приобретают сине-голубые тона. Красная окраска - у маков, роз, герани, синяя - у васильков, голубая - у колокольчиков обусловлена наличием пигмента антоциана. Плоды винограда, слив, тёрна, краснокочанной капусты, свеклы тоже окрашены антоцианом. Считается, что антоциан защищает растения от низких температур, от вредного воздействия солнечного цвета на цитоплазму.
Шкала рН и характер среды.
Для определения характера среды используется рН-шкала. Термин рН– степень и «Н» - символа водорода.
Численное значение водородного показателя (рН) в шкале от 0 до 14 характеризует концентрацию кислоты или щелочи в растворе. Значение 0 указывает на то, что раствор представляет собой сильную кислоту, среднее значение 7 соответствует нейтральному раствору, рН= 14 имеют сильные основания, или щелочи. В нейтральном растворе при 25°С рН = 7. В кислых растворах рН 7, и тем больше, чем больше щёлочность раствора.
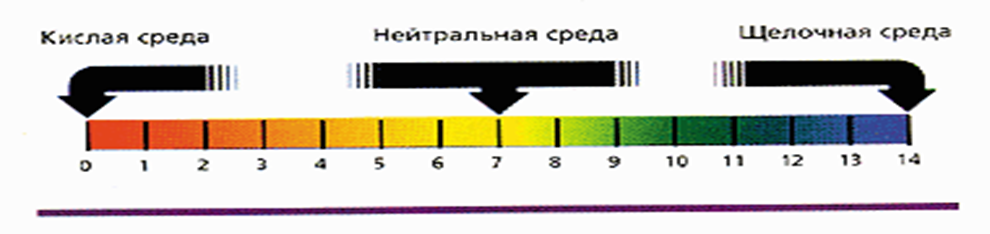
Индикаторы меняют свой цвет в зависимости от значения рН по-разному.
3. Практическая часть
3.1 Получение индикатора
Для приготовления индикатора на растительной основе использовали краснокочанную капусту. Антоцианы, содержащиеся в капусте, выделяли, порезав капусту на маленькие кусочки, поместив ее в химический стакан объемом 800 мл (рис. 3.1а). Затем прибавили 300 мл дистиллированной воды и кипятили в течении 20 минут (рис. 3.1б). Жидкость приобрела фиолетовый цвет (рис. 3.1в).



Рисунок 3.1 –а) измельченная краснокочанная капуста, б) получение индикатора, в) готовый индикатор.
Спиртовой раствор индикатора из краснокочанной капусты готовили из полученного индикатора и этилового спирта в соотношении 1:2.
3.2 Тестирование полученного индикатора на основе антоцианов
3.2.1. Водный раствор индикатора
2 мл водного раствора аммиака налили в пробирку и к нему добавили 2-3 капли полученного индикатора. Раствор поменял цвет с бесцветного на зеленый (рис.3.2a).
2 мл уксусной кислоты налили в пробирку и к ней добавили 2-3 капли полученного индикатора. Раствор поменял цвет с бесцветного на розовый (рис.3.2б).
2 мл дистиллированной воды налили в пробирку и к ней добавили 2-3 капли полученного индикатора. Раствор осталась бесцветным (рис.3.2в).



Рисунок 3.2. –а) взаимодействие индикатора с щелочью, б) взаимодействие индикатора с кислотой, в) взаимодействие индикатора с водой.
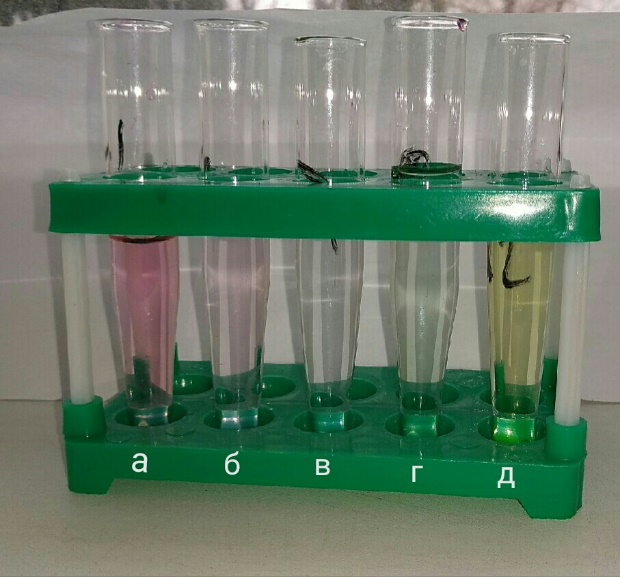
Рисунок 3.3 – тестирование водного раствора индикатора: а – рН=1; б – pH=3; в – pH=7; г – pH=9; д – pH=12
3.2.2. Спиртовой раствор индикатора
2 мл уксусной кислоты (pH-1) налили в пробирку и к ней добавили 2-3 капли спиртового индикатора. Раствор поменял цвет с бесцветного на розовый (рис.3.4а).
2 мл уксусной кислоты (pH-3) налили в пробирку и к ней добавили 2-3 капли спиртового индикатора. Раствор поменял цвет с бесцветного на розовый (рис.3.4б).
2 мл дистиллированной воды (pH-7) налили в пробирку и к ней добавили 2-3 капли спиртового индикатора. Раствор осталась бесцветным (рис.3.4в).
2 мл водного раствора аммиака (pH-9) налили в пробирку и к нему добавили 2-3 капли спиртового индикатора. Раствор поменял цвет с бесцветного на зеленый (рис. 3.4.г)
2 мл водного раствора аммиака (pH-12) налили в пробирку и к нему добавили 2-3 капли спиртового индикатора. Раствор поменял цвет с бесцветного на зеленый (рис. 3.4.д)
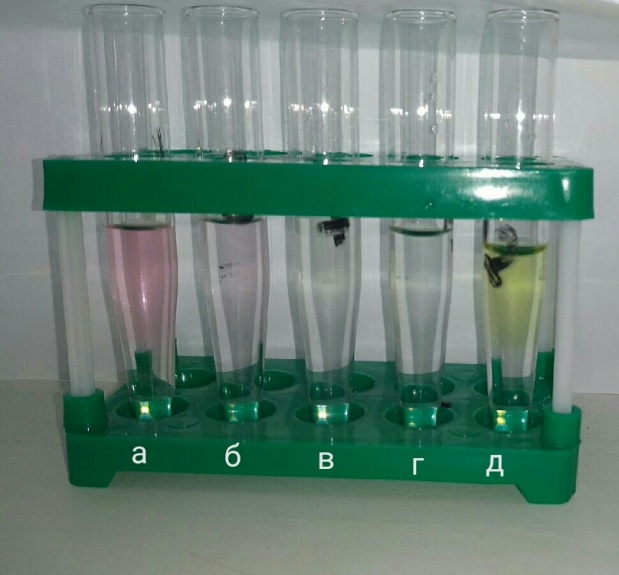
Рисунок 3.4 – тестирование спиртового раствора индикатора: а – рН=1; б – pH=3; в – pH=7; г – pH=9; д – pH=12
4. Выводы
В результате проделанной работы:
была изучена научная литература по теме исследования.
изготовила индикатор из краснокочанной капусты.
провела тестирование полученного индикатора.
доказала, что индикатор пригоден для распознавания среды в широком диапазоне pH.
В моем проекте было выявлено, что водный индикатор лучше растворяется чем спиртовой.
Изготовить индикатор в домашних условиях может каждый человек не зависимо от того есть у него глубокие познания по химии или нет.
Список литературы
Аликберова Л.Ю. Занимательная химия. – М.: АСТ-ПРЕСС, 2002.
Аликберова Л.Ю. Занимательная химия. Книга для учащихся, учителей и родителей. – М.: АСТ-ПРЕСС, 1999.
Байкова В.М. Химия после уроков. - Петрозаводск: Карелия, 1984.
Балаев И.И. Домашний эксперимент по химии.(Пособие для учителя) - М.: Просвещение, 1977.
Федерова Г.А. Естественные красители в плодово-ягодном сырье М.: ЦИНТИПищепром, 1965
Лебедева Т.С., Сытник К.М. Пигменты растительного мира. Киев: Наук.думка, 1978.
11


































