
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Подготовила:
Учитель химии МБОУ СОШ № 2
г. Новосибирск
Кузура А. П.
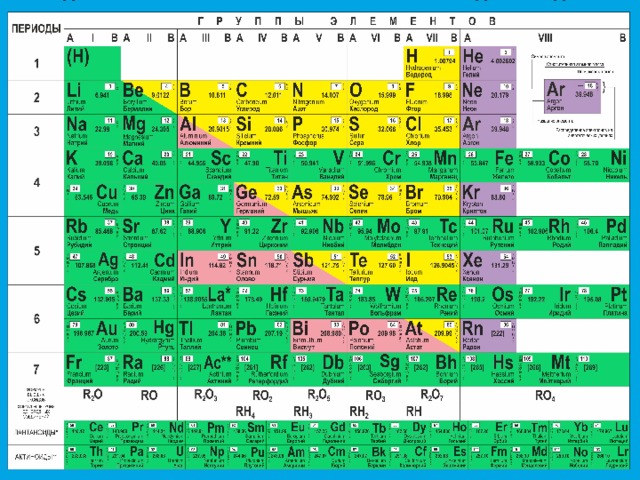

- Расположение в периодической системе
- Особенности строения атома
- Физические свойства
- Химические свойства
- Открытие
- Получение
- Na + и K + в организме человека
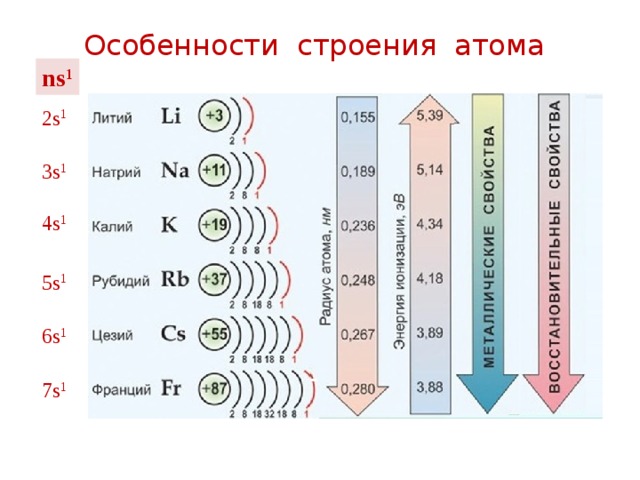
Особенности строения атома
ns 1
2s 1
3s 1
4s 1
5s 1
6s 1
7s 1
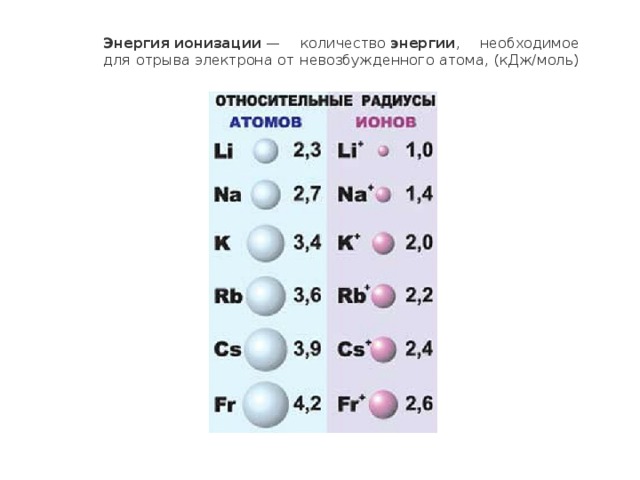
Энергия ионизации — количество энергии , необходимое для отрыва электрона от невозбужденного атома, (кДж/моль)

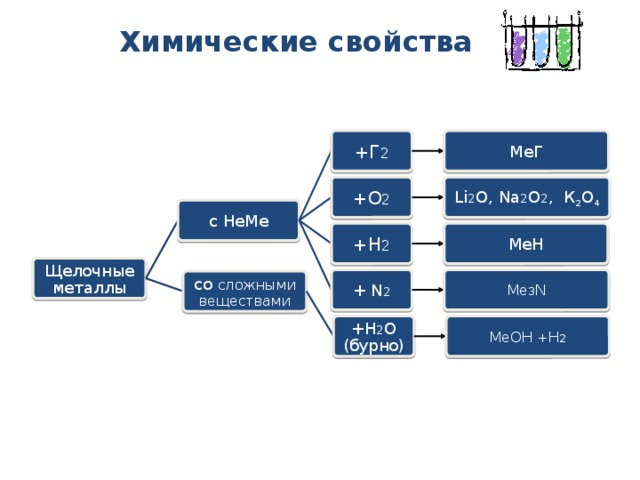
Химические свойства
MeГ
+Г 2
+O 2
Li 2 O, Na 2 O 2 , К 2 О 4
с НеМе
+H 2
МеH
Щелочные металлы
+ N 2
Me 3 N
со сложными веществами
+H 2 O (бурно)
МеOH +H 2
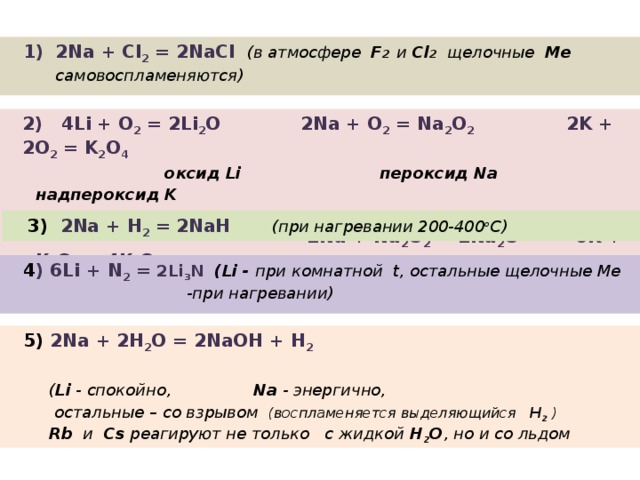
- 2Na + Cl 2 = 2NaCl (в атмосфере F 2 и Cl 2 щелочные Me самовоспламеняются)
2) 4Li + O 2 = 2Li 2 O 2Na + O 2 = Na 2 O 2 2K + 2O 2 = K 2 O 4
оксид Li пероксид Na надпероксид K
2Na + Na 2 O 2 = 2Na 2 O 6K + K 2 O 4 = 4K 2 O
3) 2Na + Н 2 = 2NaН (при нагревании 200-400 o C)
4 ) 6Li + N 2 = 2Li 3 N (Li - при комнатной t, остальные щелочные Me -при нагревании)
5) 2Na + 2Н 2 О = 2NaОН + Н 2
( Li - спокойно, Na - энергично,
остальные – со взрывом (воспламеняется выделяющийся Н 2 )
Rb и Cs реагируют не только с жидкой Н 2 О , но и со льдом

Качественное определение щелочных металлов
Для распознавания соединений щелочных металлов по окраске пламени исследуемое вещество вносится в пламя горелки на кончике железной проволоки
Li+ - карминово-красный K+ - фиолетовый Cs+ - фиолетово-синий
Na+ - желтый Rb + - красный
Li+ Na+ K+



Открытие щелочных металлов
- В 1807 г . в Англии Г. Деви открыл натрий и калий
«Натрун» - сода, «алкали» - щелочь
- В 1817г . в Швеции А. Арфведсоном был открыт литий .
«Литос» - камень
- В 1860 – 1861г.г . в Германии Р.Бунзен и Г.Кирхгоф открыли рубидий «темно-красный» и цезий «небесно-голубой»
- В 1939г. во Франции М. Перей открыла радиоактивный элемент франций , который назвала в честь своей страны – Франции

Получение щелочных металлов
1) Электролиз расплавов соединений щелочных металлов:
2МеCl = 2Ме + Cl 2
4МеOH = 4Ме + 2Н 2 О + О 2
2) Восстановление оксидов и гидроксидов щелочных металлов:
2Li 2 O + Si = 4Li + SiO 2
KOH + Na = NаOH + K

До 18 века натрий (natrium) называли содием (sodium). Поэтому соли натрия назывались сернокислая сода и гидрохлоровая сода. Название же «натрий» было впервые применено Берцелиусом

Na + - внутриклеточный ион, содержится в крови и лимфе, создает в клетках осмотическое давление
K + - внеклеточный ион, поддерживает работу сердца и мышц

Никто не хочет «блистать» отекшими ногами, да и перепады в настроении, усталость и слабость в мышцах совсем не к лицу современному человеку.
Поэтому думайте о калии и не забывайте про него

1. После кальция, фосфора и серы калий занимает в организме человека четвертое место, причем 98% этого вещества находиться внутри клеток.
2. Дефицит калия наблюдается при чрезмерном употреблении соли и при стрессе.
3. Роль калия в организме заключается в поддержании энергетического и водного баланса, сокращение мышц, в том числе и сердечной, передаче нервных импульсов.
Спортсменам, людям активным и подвижным калий жизненно необходим



Калий и натрий оказывают противоположное действие на обмен воды в организме. Калий воду выводит, а натрий – удерживает. Поэтому важно помнить о правильном соотношении этих двух элементов – 1:20 в пользу калия.
Оптимальное соотношение замечено в картофеле и горохе

РЕФЛЕКСИЯ
+
«плюс»
-
все, что понравилось на уроке либо может быть полезно в дальнейшем
«минус»
!?
все, что не понравилось на уроке, показалось скучным, осталось непонятным, или информация, которая, по мнению ученика, оказалась для него не нужной
«интересно»
любопытные факты, о которых узнали на уроке, что бы еще хотелось узнать по данной проблеме, вопросы к учителю














































