Просмотр содержимого документа
«Презентация к уроку в 9 классе "Хлор"»


История открытия….

- Впервые газ хлор получил и подробно описал шведский химик К. Шееле в 1774 году. Он нагревал соляную кислоту с минералом пиролюзитом MnO 2 и наблюдал выделение желто-зеленого газа с резким запахом. Так как в те времена господствовала теория флогистона, новый газ Шееле рассматривал как окись (оксид) соляной кислоты .
Карл Вильгельм Шееле

Лавуазье, Антуан Лоран
- А.Лавуазье рассматривал газ как оксид элемента «мурия» (соляную кислоту называли муриевой, от лат. muria — рассол).
- Такую же точку зрения сначала разделял английский ученый Г. Дэви, который потратил много времени на то, чтобы разложить «окись мурия» на простые вещества. Это ему не удалось, и к 1811 году Дэви пришел к выводу, что данный газ — это простое вещество, и ему отвечает химический элемент. Дэви первым предложил в соответствие с желто-зеленой окраской газа назвать его chlorine (хлорин).
Гемфри Дэви

Гей-Люссак, Жозеф Луи
- Название «хлор» элементу дал в 1812 французский химик Ж. Л. Гей-Люссак; оно принято во всех странах, кроме Великобритании и США, где сохранилось название, введенное Дэви. Высказывалось мнение о том, что данный элемент следует назвать «галоген» (т. е. рождающий соли), но оно со временем стало общим названием всех элементов группы VIIA.

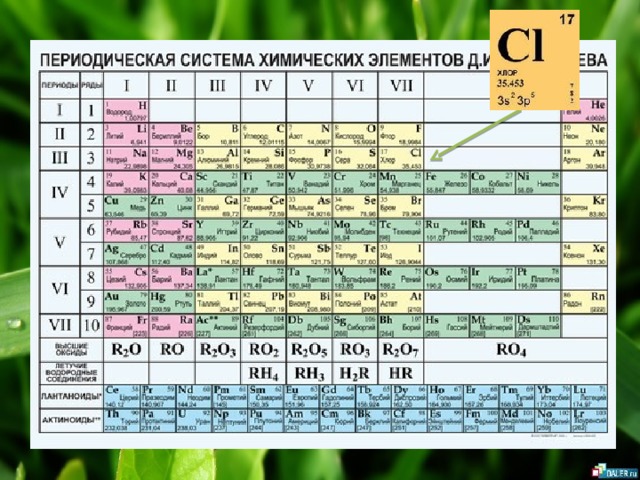

Общие сведения.
- Хлор (от греч. χλωρός — «зелёный») — элемент главной подгруппы седьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева , с атомным номером 17. Обозначается символом Cl ( лат. Chlorum). Химически активный неметалл . Входит в группу галогенов
- Простое вещество при нормальных условиях — ядовитый газ желтовато-зелёного цвета , с резким запахом. Молекула хлора двухатомная (формула Cl 2 ).

Строение атома


Строение электронной оболочки

- Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO 2 и Cl 2 O 6 . Однако, эти соединения являются радикалами , то есть у них есть один неспаренный электрон .
- На валентном уровне атома хлора содержится 1 неспаренный электрон : 1s 2 2s 2 2p 6 3s 2 3p 5 , поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:
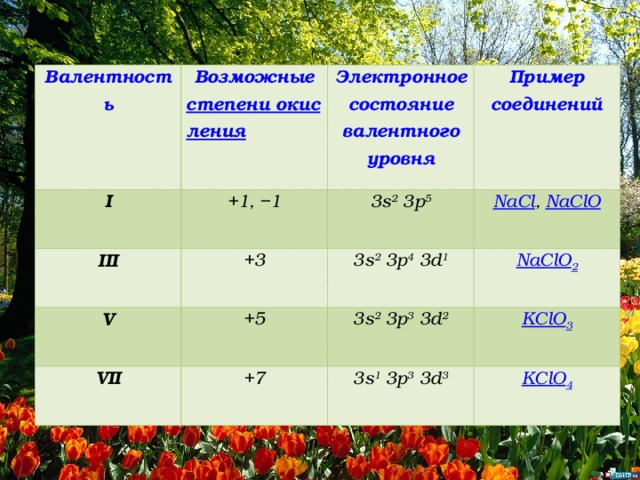
Валентность
I
Возможные степени окисления
Электронное состояние валентного уровня
+1, −1
III
V
Пример соединений
3s 2 3p 5
+3
VII
+5
3s 2 3p 4 3d 1
NaCl , NaClO
NaClO 2
3s 2 3p 3 3d 2
+7
KClO 3
3s 1 3p 3 3d 3
KClO 4

Изотопный состав

- В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %
Изотоп
Относительная масса, а.е.м.
35 Cl
37 Cl
34.968852721
Период полураспада
Тип распада
36.96590262
Стабилен
Ядерный спин
Стабилен
3/2
3/2

Физические свойства

- Хлор – газ желто – зеленого цвета
- Хлор ядовит для всего живого
- Хлор растворяется в воде, раствор хлора в воде называют хлорной водой.
![Свойство Значение [4] Температура кипения − 34 °C Температура плавления − 101 °C Температура разложения (диссоциации на атомы) ~1400 °C Плотность (газ, н.у. ) Теплоемкость (298 К, газ) 3,214 г/л 34,94 (Дж/моль·K) Критическая температура 144 °C Критическое давление 76 атм](https://fsd.multiurok.ru/html/2018/02/10/s_5a7f45b9f2dc8/img17.jpg)
Свойство
Значение [4]
Температура кипения
− 34 °C
Температура плавления
− 101 °C
Температура разложения (диссоциации на атомы)
~1400 °C
Плотность (газ, н.у. )
Теплоемкость (298 К, газ)
3,214 г/л
34,94 (Дж/моль·K)
Критическая температура
144 °C
Критическое давление
76 атм

Химические
свойства
Химические свойства

- Галогены являются типичными неметаллами , проявляют окислительные свойства.
- Степень окисления галогенов в соединениях с металлами и водородом-1;
- во всех кислородосодержащих соединениях галогены (кроме фтора) проявляют степени окисления +1,+3,+5,+7, например:
- HCL ( -1) ; HClO (+1); HCLO 2 ( +3); HCLO 3 ( +5) ; HCLO 4 (+7)

HF HCL HBr HI Усиление кислотных свойств HCL HClO HCLO 2 HCLO 3 HCLO 4 Усиление кислотных свойств
Все галогены проявляют высокую химическую активность ,
которая уменьшается при переходе от фтора к йоду.

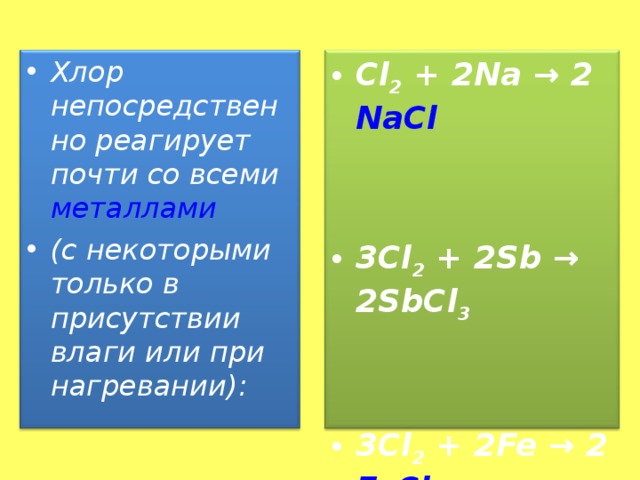
- Хлор непосредственно реагирует почти со всеми металлами
- (с некоторыми только в присутствии влаги или при нагревании):
- 3Cl 2 + 2Sb → 2SbCl 3
- 3Cl 2 + 2Fe → 2 FeCl 3
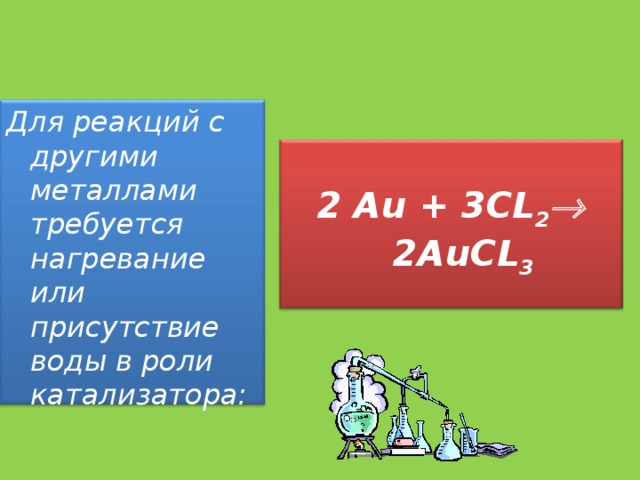
Для реакций с другими металлами требуется нагревание или присутствие воды в роли катализатора:
2 Au + 3CL 2 2 AuCL 3
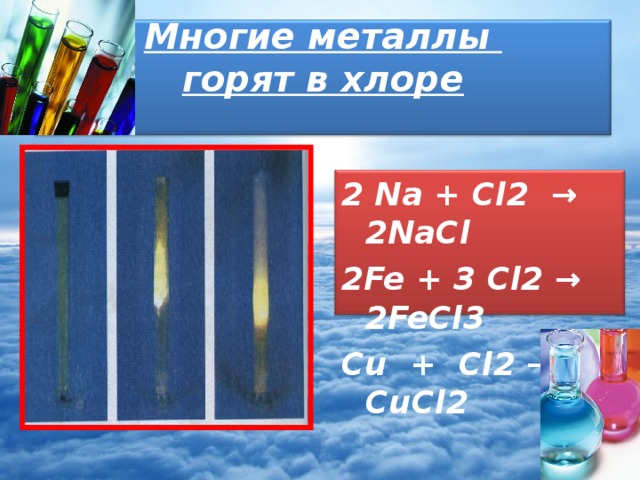
Многие металлы горят в хлоре
2 Na + Cl2 → 2NaCl
2Fe + 3 Cl2 → 2FeCl3
Cu + Cl2 → CuCl2


Взаимодействие хлора с водородом

- C неметаллами (кроме углерода , азота , кислорода и инертных газов ), образует соответствующие хлориды .
- На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода .
- Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
- Cl 2 + H 2 → 2HCl
- 5Cl 2 + 2P → 2PCl 5
- 2S + Cl 2 → S 2 Cl 2
-
- PCL 3
- P +CL 2
- PCL 5
- N 2 + CL 2 ≠ реакция не идет.

- С кислородом хлор образует оксиды в которых он проявляет степень окисления от +1 до +7: Cl 2 O, ClO 2 , Cl 2 O 6 , Cl 2 O 7 . Они имеют резкий запах, термически и фотохимически нестабильны, склонны к взрывному распаду.
- При реакции с фтором , образуется не хлорид, а фторид :
- Cl 2 + 3F 2 (изб.) → 2 ClF 3

Качественная реакция
- взаимодействие недостатка CL 2 c KI и обнаружение йода по синему окрашиванию после добавления раствора крахмала.
- CL 2 ( нед.) + 2KCL (p) = 2KCL +I 2 ↑
- 3 CL 2 ( изб .)+ 3 H 2 О + KI = 6HCl + KIO 3

Наиболее энергично хлор реагирует с металлами, причем с некоторыми из них ( сурьмой, цезием, рубидием) уже при обычных условиях:
- Хлор вытесняет из водных растворов бром и йод
- Cl 2 + 2 Na I → 2NaCl + I 2
- 2Sb + 3CL 2 = 2SbCL 3 ( или SbCL 5 )
- С водой
- Cl 2 + H 2 O ↔ HCl + HClO
- HClO = HCl + O


Взаимодействие хлора с органическими красителями

Хлор вытесняет бром и иод из их соединений с водородом и металлами:
- Cl 2 + 2HBr → Br 2 + 2HCl
- Cl 2 + 2NaI → I 2 + 2NaCl
- При реакции с монооксидом углерода образуется фосген :
Cl 2 + CO → COCl 2
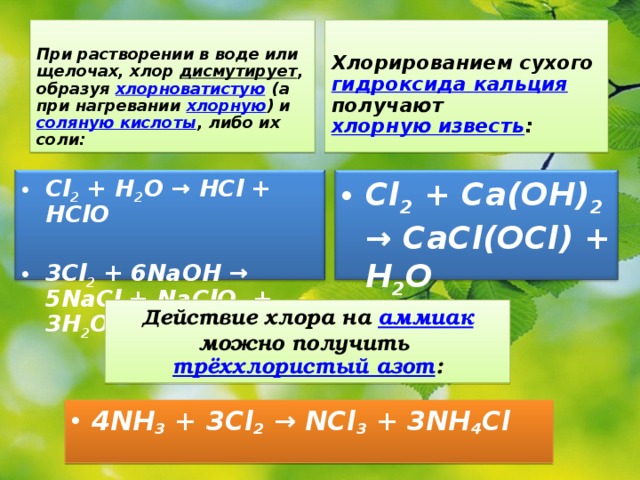
При растворении в воде или щелочах, хлор дисмутирует , образуя хлорноватистую (а при нагревании хлорную ) и соляную кислоты , либо их соли:
Хлорированием сухого гидроксида кальция получают хлорную известь :
- Cl 2 + H 2 O → HCl + HClO
- 3Cl 2 + 6NaOH → 5NaCl + NaClO 3 + 3H 2 O
- Cl 2 + Ca(OH) 2 → CaCl(OCl) + H 2 O
Действие хлора на аммиак можно получить трёххлористый азот :
- 4NH 3 + 3Cl 2 → NCl 3 + 3NH 4 Cl

Окислительные свойства хлора
Хлор очень сильный окислитель .
- С насыщенными соединениями :
- CH 3 - CH 3 + Cl 2 → C 2 H 6- x Cl x + HCl
- Присоединяется к ненасыщенным соединениям по кратным связям:
- CH 2 =CH 2 + Cl 2 → Cl-CH 2 -CH 2 -Cl
- Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl 3 или FeCl 3 ):
- C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl
Реакции с органическими веществами


- Содержание хлора в земной коре составляет 0,013% по массе, в заметной концентрации он в виде иона Cl – присутствует в морской воде (в среднем около 18,8 г/л).




- Первоначально промышленный способ получения хлора основывался на методе Шееле , то есть реакции пиролюзита с соляной кислотой :
- MnO 2 + 4HCl → MnCl 2 + Cl 2 ↑ + 2H 2 O
- В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха . Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода , являющегося побочным продуктом при промышленном хлорировании органических соединений.
- 4HCl + O 2 → 2H 2 O + 2Cl 2

- Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли :
- 2NaCl + 2H 2 О → H 2 ↑ + Cl 2 ↑ + 2NaOH
- Анод : 2Cl - — 2е - → Cl 2 0 ↑
- Катод : 2H 2 O + 2e - → H 2 ↑ + 2OH -
- Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом :
- 1,80 NaCl + 0,50 H 2 O → 1,00 Cl 2 ↑ + 1,10 NaOH + 0,03 H 2 ↑


Получение хлора

В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV) , перманганатом калия , дихроматом калия ):
- 2KMnO 4 + 16HCl →
- 2KCl + 2MnCl 2 + 5Cl 2 ↑ +8H 2 O
-
- K 2 Cr 2 O 7 + 14HCl →
- 3Cl 2 + 2KCl + 2CrCl 3 + 7H 2 O
-


- Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот , и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.

Биологическая роль
- Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
- У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия.
- В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока .

- Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений.
- Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами , стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии

Особенности работы и меры предосторожности

- Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье .
- Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну .
- При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками.
- На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na 2 SO 3 или тиосульфата натрия Na 2 S 2 O 3 .

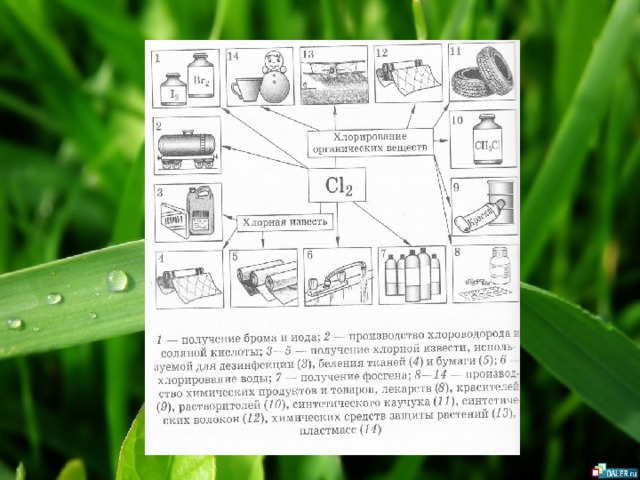

- Хлор широко используют в производстве хлорорганических соединений,
- неорганических хлоридов,
- для получения отбеливателей,
- как дезинфицирующее средство,
- для водоочистки и т.д.
- Хлор присутствует во многих минералах и соляных залежах, он - жизненно важный элемент для всех организмов. У животных и человека хлорид-ионы участвуют в выработке желудочного сока, регулируют водный обмен.

- Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов .




























![Свойство Значение [4] Температура кипения − 34 °C Температура плавления − 101 °C Температура разложения (диссоциации на атомы) ~1400 °C Плотность (газ, н.у. ) Теплоемкость (298 К, газ) 3,214 г/л 34,94 (Дж/моль·K) Критическая температура 144 °C Критическое давление 76 атм](https://fsd.multiurok.ru/html/2018/02/10/s_5a7f45b9f2dc8/img17.jpg)






























































