презентация по химии 9 класс к уроку по теме "Оксиды серы"
Просмотр содержимого документа
«Презентация к уроку "Оксиды серы"»

СЕРА

Если за день ничему не научился – зря прожил день .
Кит.

1) 0 8) 0
2) 1 9) 0
3) 1 10) 1
4) 1 11) 0
5) 0 12) 1
6) 1 13) 1
7) 1 14) 0

- Во многих лесах по всему миру можно найти целые области высохших как хворост стволов деревьев . В крупных городах стены некоторых домов выглядят, как наждачная бумага . Светлые полосы на автомобилях, перилах лестниц и других металлических сооружениях также все чаще можно встретить на улицах. Какова причина этих явлений?
Ответ подготовьте после изучения нового материала.

Урок подготовила Дуланова И.Т.

- Целью нашего урока является изучение свойств и применения оксидов серы SO 2 и SO 3. Используя материал учебника, заполните таблицу.
- Первый вариант изучает свойства SO 2 , второй вариант - SO 3.

SO 2 сернистый газ
SO 3 сернистый ангидрид
1.
2.
3.
4.
5.
6.

ПЛАН ИЗУЧЕНИЯ:
1. Степень окисления атома серы в оксиде.
2. Формула и название кислоты, соответствующей оксиду.
3. Физические свойства оксида.
4. Запишите реакции оксида серы с: H 2 O, Na 2 O, NaOH. Дайте название полученным веществам.
5. Применение оксида.
6. Способы получения оксида.
ПЛАН ИЗУЧЕНИЯ:
1.Степень окисления атома серы в оксиде.
2.Формула и название кислоты, соответствующей оксиду.
3.Физические свойства оксида.
4.Запишите реакции оксида серы с: H 2 O, Na 2 O, NaOH. Дайте название полученным веществам.
5.Применение оксида.
6. Способы получения оксида.

SO 2 сернистый газ
SO 3 сернистый ангидрид
1. + 4
1. + 6
2. H 2 SO 3 - сернистая кислота
2. H 2 SO 4 – серная кислота
3. Бесцветный газ с резким запахом, хорошо растворяется в воде, образуя слабую сернистую кислоту. Очень токсичен.
3. Бесцветная сильно дымящаяся жидкость, растворимая в воде.
4. SO 2 + H 2 O = H 2 SO 3
- SO 2 + Na 2 O = Na 2 SO 3 сульфит натрия
- SO 2 + 2NaOH = Na 2 SO 3 + H 2 O
4.SO 3 + H 2 O = H 2 SO 4
SO 3 + Na 2 O = Na 2 SO 4 сульфат натрия
SO 3 + 2NaOH = Na 2 SO 4 + H 2 O
5. Отбеливание шерсти, шелка, бумаги, консервирующих средств для сохранения свежих плотов и фруктов.
5.Получение серной кислоты.
6. 2H 2 S + 3O 2 = 2SO 2 +2H 2 O
- S + O 2 = SO 2
- ZnS + O 2 = ZnO + SO 2
6.S + O 2 = SO 2
2SO 2 + O 2 = 2SO 3
Демонстрация учителем получения оксида серы ( IV )
S + O 2 = SO 2

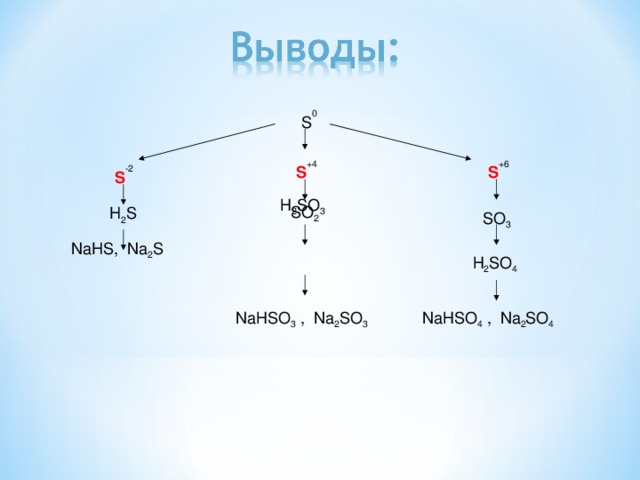
S 0
S +6
S +4
S -2
Н 2 SO 3
SO 2
H 2 S
SO 3
NaHS, Na 2 S
Н 2 SO 4
NaНSО 3 , Na 2 SО 3
NaНSО 4 , Na 2 SО 4
Обсуждение проблемной ситуации, поставленной в начале изучения новой темы.
- Кислотный дождь образуется в результате реакции между водой и такими загрязняющими веществами, как оксид серы (SO 2 ) и различными оксидами азота. Эти вещества выбрасываются в атмосферу автомобильным транспортом, в результате деятельности металлургических предприятий и электростанций, а также при сжигании угля и древесины. Вступая в реакцию с водой атмосферы, они превращаются в растворы кислот - серной, сернистой, азотистой и азотной. Затем, вместе со снегом или дождем, они выпадают на землю.
Проблемы, которые возникают в связи с выпадением кислотных дождей:
- Деревья теряют часть листьев, становясь беззащитными перед морозами болезнями
- Корни деревьев так же могут замедлить своё развитие, что скажется на нехватке питательных веществ
- Из-за химических реакций почвы потеряют некоторые микроэлементы и станут менее питательными
- Увеличение уровня кислотности воды и почв может стать проблемой для водных животных и растений
- Кислотные дожди могут растворить скрепляющий раствор в кладках зданий, повредить конструкции из природного камня, особенно известняка, что, в свою очередь, может привести к потере прочности конструкций и сооружений


РЕФЛЕКСИЯ
«Одним словом».
Необходимо выбрать 3 слова, которые наиболее точно передают его состояние на уроке:
Раздражение
Злость
Радость
Равнодушие.
Удовлетворение
Вдохновение
Скука.
Тревога.
Покой.
Уверенность
Неуверенность.
Наслаждение.

- § 27, упр. 2, 5,
- подготовить сообщение/ презентацию на выбор по темам: «Применение серной кислоты в промышленности», «Применение серной кислоты в медицине, «Соединения серы в природе», «Осторожно! Соединения серы!».







































