
Кислород и сера

План изучения
- Строение атома, возможные степени окисления

Положение кислорода и серы в периодической системе химических элементов Д.И. Менделеева

Положение в периодической системе
КИСЛОРОД и СЕРА
элементы VIA группы периодической системы
Элементы этой группы имеют общее название - ХАЛЬКОГЕНЫ, что означает «рождающие руды»

Строение атома кислорода
Электронные конфигурации атома:
Валентность кислорода равна двум
Степени окисления кислорода:
-2, 0, +2
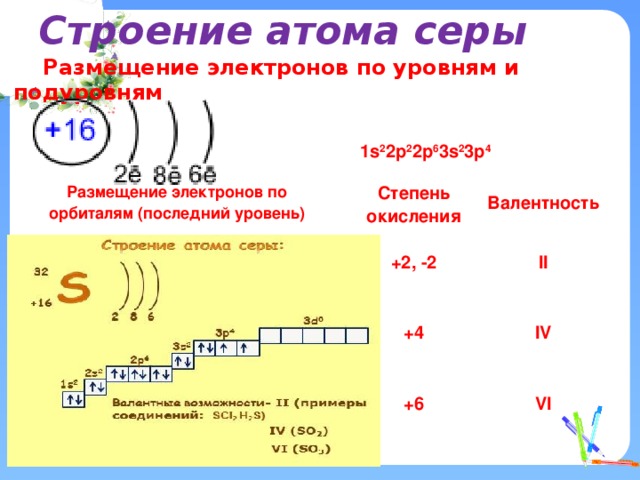
Строение атома серы
Размещение электронов по уровням и подуровням
1s 2 2p 2 2p 6 3s 2 3p 4
Размещение электронов по орбиталям (последний уровень)
Степень окисления
+2, -2
Валентность
II
+4
+6
IV
VI

Нахождение серы в природе
Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде .

Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит

Пирит – «огненный камень» (соединение серы в природе)

Сера в природе
Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца

Аллотропные модификации кислорода.
О 3
озон
(простое вещество)
«пахнущий»
Х. Ф. Шёнбейн 1839 г.
О 2
кислород
(простое вещество)
«рождающий кислоты»
К. В. Шееле 1772 г.
Дж. Пристли 1774 г.
А. Лавуазье 1777г.
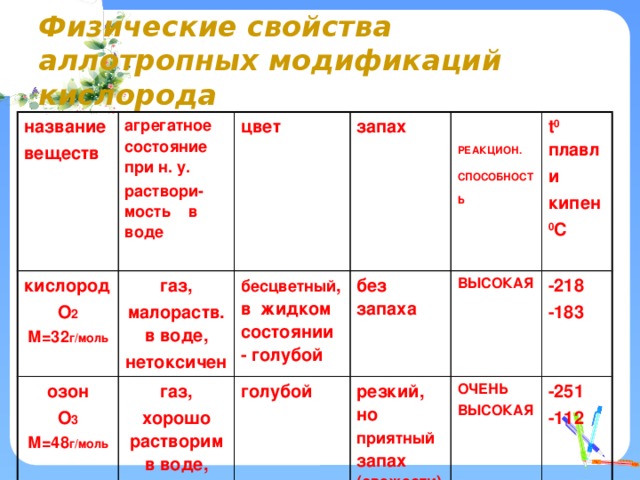
Физические свойства аллотропных модификаций кислорода
название
веществ
агрегатное состояние при н. у.
кислород
раствори-мость в воде
O 2
газ,
цвет
озон
малораств. в воде,
O 3
бесцветный , в жидком состоянии - голубой
газ,
запах
М=32 г/моль
без запаха
хорошо растворим в воде,
нетоксичен
М=48 г/моль
голубой
РЕАКЦИОН.
резкий, но приятный запах (свежести)
токсичен
ВЫСОКАЯ
t 0 плавл
-218
и
СПОСОБНОСТЬ
ОЧЕНЬ
-183
кипен
ВЫСОКАЯ
-251
-112
0 C
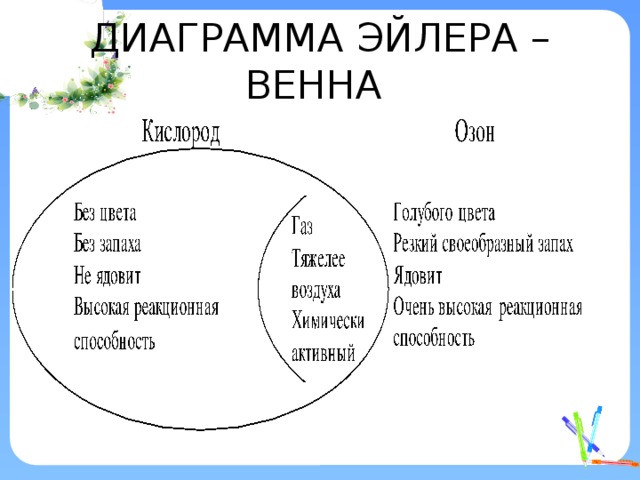
ДИАГРАММА ЭЙЛЕРА – ВЕННА
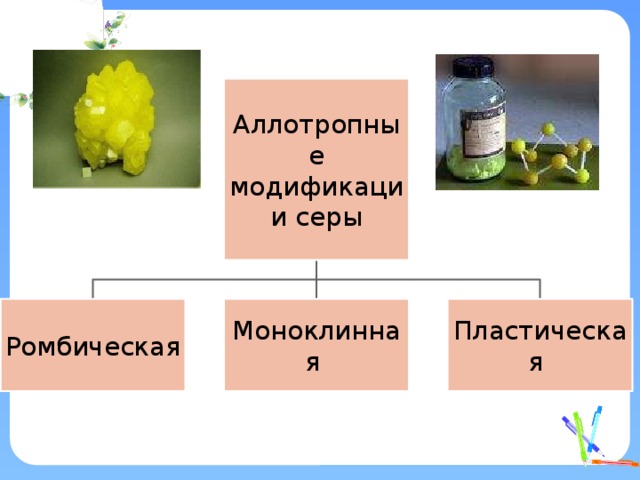
Аллотропные модификации серы
Ромбическая
Моноклинная
Пластическая
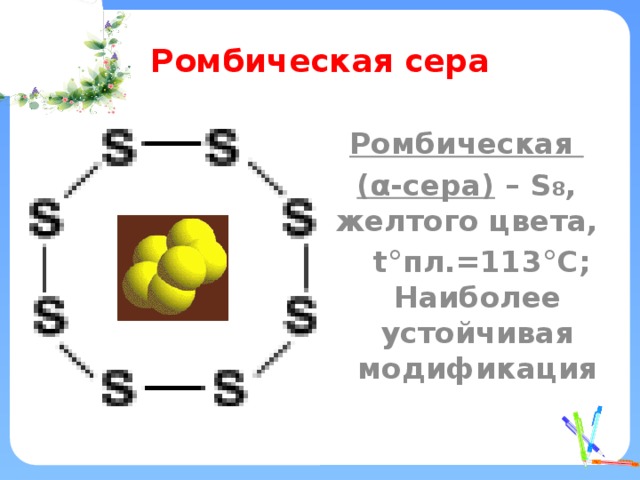
Ромбическая сера
Ромбическая
( α-сера) – S 8 , желтого цвета,
t°пл.=113°C; Наиболее устойчивая модификация
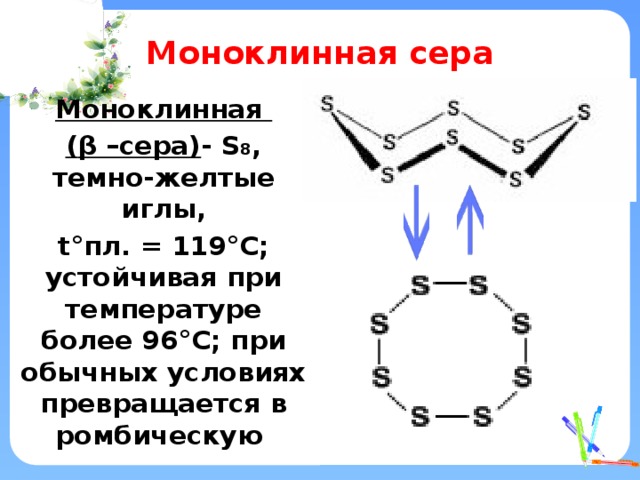
Моноклинная сера
Моноклинная
( β –сера) - S 8 , темно-желтые иглы,
t°пл. = 119°C; устойчивая при температуре более 96°С; при обычных условиях превращается в ромбическую
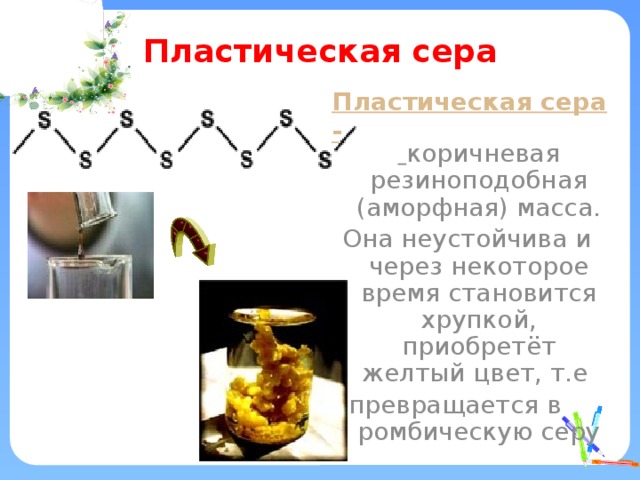
Пластическая сера
Пластическая сера- коричневая резиноподобная (аморфная) масса.
Она неустойчива и через некоторое время становится хрупкой, приобретёт желтый цвет, т.е
превращается в ромбическую серу

Физические свойства серы
- Твёрдое кристаллическое вещество желтого цвета, без запаха
- Плохо проводит теплоту и не проводит электрический ток
- Сера в воде практически не растворяется
- Температура плавления 120 0 С

Ответы
- 1- желтые
- 2 – запаха
- 3 – тепла
- 4 – электричества
- 5 – нерастворима
- 6 – кристаллическое
- 7 – жидкость
- 8 - пластическая

Химические свойства серы (восстановительные)
Сера проявляет в реакциях с сильными окислителями:
S - 2ē S +2 ; S - 4ē S +4 ; S - 6ē S +6
1) C кислородом:
S + O 2 t S +4 O 2
2S + 3O 2 t ;Рt 2S +6 O 3
2) С галогенами (кроме йода)
S + Cl 2 S +2 Cl 2

Химические свойства серы (окислительные)
S 0 + 2ē S -2
3) Сера реагирует со щелочными металлами без нагревания:
2 Na + S Na 2 S
c остальными металлами (кроме Au, Pt) - при повышенной t :
2Al + 3S – t Al 2 S 3
Cu + S – t CuS
4) С некоторыми неметаллами сера образует бинарные соединения:
H 2 + S H 2 S
C + 2S CS 2
Применение серы
Производство спичек
Медицина
Производство резины
Сельское хозяйство
Производство взрывчатых
веществ
Производство
серной
кислоты
Красители

Сера используется для производства спичек

Процесс химического взаимодействия каучуков с серой в технике называется вулканизацией. При вулканизации изменяется молекулярная структура полимера, что влечет за собой изменение его физико-механических свойств: резко возрастает прочность при растяжении и эластичность каучука, а пластичность почти полностью исчезает Вулканизированный каучук называется резиной

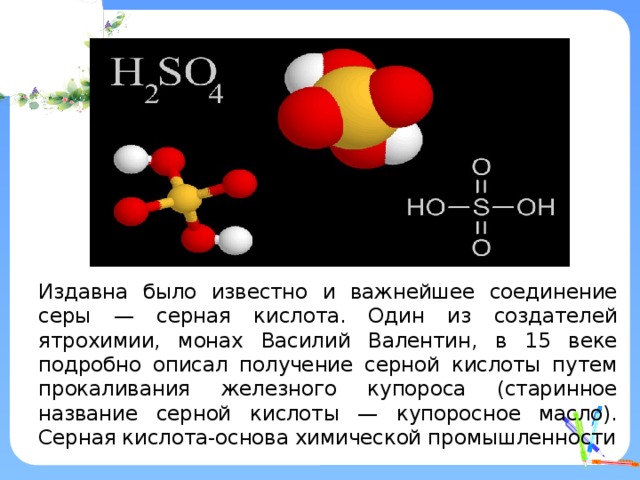
Издавна было известно и важнейшее соединение серы — серная кислота. Один из создателей ятрохимии, монах Василий Валентин, в 15 веке подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты — купоросное масло). Серная кислота-основа химической промышленности

Сера защищает растения от болезней. Для этого используется готовая "коллоидная сера" - тончайший порошок, который смешивают с мыльной водой и опрыскивают им растения. Сера как ядохимикат хороша тем, что практически безвредна для человека, не накапливается в организме и легко удаляется с листьев и плодов растений обычной водой

Применение серы в производстве удобрений имеет важное значение для получения полноценного минерального удобрения

Серу применяют в целлюлозно-бумажной промышленности и для производства красок, светящихся составов (люминисцентных и флюрисцентных).
15

В медицине для наружного употребления применяют: 1) раствор серы в льняном и терпентинном маслах , гарлемский бальзам — снаружи для втирания и для перевязок при подагрических страданиях, при паразитарных заболеваниях кожи, при ознобах. 2) Серное мыло — смесь 35 частей мыльного порошка, 5 частей серного цвета и соответствующего количества спирта (парфюмируется бергамотным маслом) — против чесотки.

Сера используется в косметологии. Наиболее известно "молочко Видаля" - болтушка, содержащая 5% серы осажденной. Готовые средства от прыщей также могут содержать серу очищенную (например, крем "Клерасил", гель "Делакс-Акне"). Хорошо себя зарекомендовала сера при использовании в мыле для лечения перхоти. Применяется при лечении заболеваний, вызванных повышенной секрецией сальных желез

Демеркуриза́ция — удаление ртути и её соединений физико-химическими или механическими способами с целью исключения отравления людей и животных. Металлическая ртуть высокотоксична и имеет высокое давление паров при комнатной температуре, поэтому при случайном проливе (а также в случае повреждения ртутных термометров, ламп, манометров и других содержащих ртуть приборов) подлежит удалению из помещений.
Ртуть вступает с серой в химическую реакцию и превращается в сульфид ртути HgS – нелетучий и, следовательно, неопасный. Обработку пола и других заражённых поверхностей необходимо проводить многократно, поэтому качественная демеркуризация занимаетнесколько дней

ПОЛУЧЕНА ЛИ НОВАЯ ИНФОРМАЦИЯ О КИСЛОРОДЕ И СЕРЕ?
























































