
Цель урока: повторить материал о видах химической связи, типах кристаллических решеток с точки зрения строения атома, валентности и о степени окисления.

ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
ковалентная
ионная
металлическая
полярная
неполярная
2

- К.Н.С. - это …
- К.П.С. - это …
- И.С. - это …
Слайд3.
![I. Выпишите формулы веществ: 1.с К.Н.С . 2.с К . П . С. 3. с И.С. KCl C MgO CS 2 Cu H 2 II. Изобразите механизм образования связи в веществах:: Cl 2 NH 3 NaF NaF H 2 S CO 2 Br 2 H 2 O H С l Cl Cl С l + - + N + 3 H N [ ] Na H Na + F F H](https://fhd.multiurok.ru/c/e/f/ceff18a4f178efd95ebcecaa5f110ae8d46422b5/img3.jpg)
I. Выпишите формулы веществ:
1.с К.Н.С .
2.с К . П . С.
3. с И.С.
KCl
C
MgO
CS 2
Cu
H 2
II. Изобразите механизм образования связи в веществах::
NaF
H 2 S
CO 2
Br 2
H 2 O
H
С l
Cl
Cl
С l
+
-
+
N
+ 3 H
N
[ ]
Na
H
Na
+
F
F
H

определите вид химической связи
К.П.С.
К.П.С .
P 2 O 5
H 3 N
И.С.
Mg S
К.Н.С.
И.С.
И.С.
Al 2 O 3
F 2
NaCl
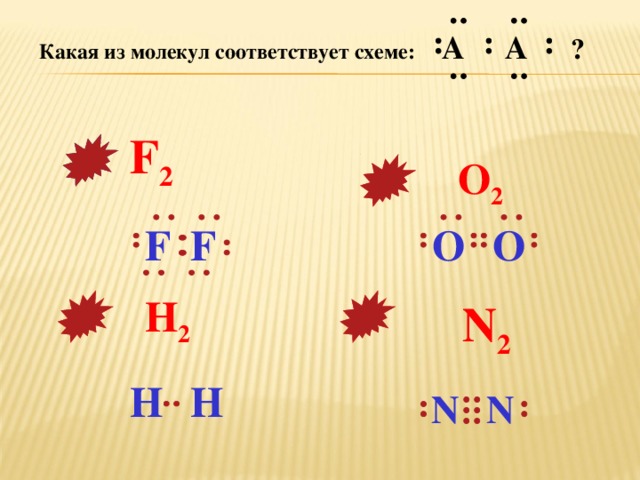
Какая из молекул соответствует схеме: A A ?
F 2
O 2
F
F
O
O
H 2
N 2
H
H
N
N

атомные
молекулярные
Слайд 7 В зависимости от того, какие частицы расположены в узлах кристаллической решетки, различают четыре вида кристаллов: ионные, атомные, молекулярные и металлические.
ионные
7
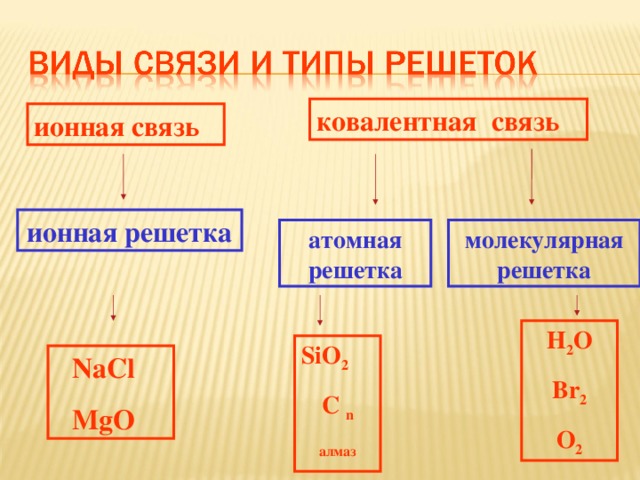
ковалентная связь
ионная связь
ионная решетка
атомная решетка
молекулярная решетка
Слайд 8. То, что должно быть на экране после ответа ученика
H 2 O
Br 2
O 2
SiO 2
C n
алмаз
NaCl
MgO
7

определите тип кристаллической решетки
молекулярная
молекулярная
К.П.С.
К.П.С .
P 2 O 5
H 3 N
ионная
И.С.
Mg S
атомная
ионная
К.Н.С.
ионная
И.С.
И.С.
Al 2 O 3
С n
NaCl

Частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называются 1)__________. Химическая связь, возникающая между ними, называется_2)_____________.
Ковалентная химическая связь возникает за счет образования _3)____________________. По числу общих электронных пар она бывает 4)________________________.
Способность атома оттягивать к себе общие электронные пары, участвующие в химической связи – это _5)_________________.
Ковалентная связь, которая образуется между атомами с одинаковой электроотрицательностью, называется 6)_____________, а с разной электроотрицательностью -7)_________________. Например, в молекулах_сероводорода, воды 8)__________________________ковалентная 9)____________ связь, а в 10)__________________ковалентная неполярная связь.

определите валентность элементов по формулам:
HgO, K 2 S, B 2 O 3 , ZnO, MnO 2 , NiO, Cu 2 O, SnO 2 , Ni 2 O 3 , SO 3 , As 2 O 5 , Cl 2 O 7 .

- Дайте определение степени окисления
- Окислительно-восстановительная реакция
- Окисление
- Восстановление
- Окислитель
- Восстановитель
Слайд 10
7

Na 2 O; O 2 ; H 2 SO 4 ; N 2 ; S; H 2 O; Al; Cu; HNO 3 ; F 2 ; Ca.

Расставить степени окисления в соединениях : Na; K 2 O; Fe; CaCO 3 ; AlCl 3 ; Li 3 N; BaSO 4 ; Zn; H 2 CO 3 ; O 3 ; OF 2 ; CuSO 4 ; NaOH; O 2 ; SO 3 ; KH; KOH; BaH 2 ; H 2 O; NH 3 .
Составьте формулы оксидов : меди (I), железа (III), вольфрама (VI), железа (II), углерода (IV), серы (VI), олова (IV), марганца (VII).

Какая реакция является окислительно-восстановительной?
+1 +6 -2 +1 -2 +1 +6 -2 +1 -2
НЕТ
H 2 SO 4 +Na 2 O Na 2 SO 4 + H 2 O
+6 -2 +1 -2 +1 +6 -2
НЕТ
SO 3 + H 2 O H 2 SO 4
+4 -2 0 +6 -2
2SO 2 + O 2 2SO 3
+1 -2 0 +1 -2 0
Н 2 S + O 2 H 2 O + S

Определите в каком веществе степень окисления серы равна +4
+1 -2
НЕТ
Н 2 S
+1 +6 -2
НЕТ
H 2 SO 4
+6 -2
НЕТ
SO 3
+4 -2
SO 2
+1 +4 -2
H 2 SO 3

Какой коэффициент перед формулой окислителя?
0 0 +3 -2
3
4
2
Al + O 2 Al 2 O 3
окислитель
восстановитель
нет
нет
нет
ok

Какой коэффициент перед формулой восстановителя?
0 0 + 3 - 1
3
2
2
P + Cl 2 PCl 3
окислитель
восстановитель
нет
ok
нет
нет

-3 +1
+ 1 -2
+ 3 -2
0 0
3
Fe 2 O 3 + NH 3 Fe + N 2 + H 2 O
2
2
0
+3
Fe
Fe
восстановление
+ 3 е
6
2
окислитель
-3
0
N
2
N 2
- 6 е
1
окисление
3
восстановитель










![I. Выпишите формулы веществ: 1.с К.Н.С . 2.с К . П . С. 3. с И.С. KCl C MgO CS 2 Cu H 2 II. Изобразите механизм образования связи в веществах:: Cl 2 NH 3 NaF NaF H 2 S CO 2 Br 2 H 2 O H С l Cl Cl С l + - + N + 3 H N [ ] Na H Na + F F H](https://fhd.multiurok.ru/c/e/f/ceff18a4f178efd95ebcecaa5f110ae8d46422b5/img3.jpg)
































