
Азербайджанская Республика
г. Евлах школа №9
Джавадзаде Алия
2012

Тема урока: Кислоты
Мотивация: Вопросы по картинкам
Цель урока: Обобщить и систематизировать знания о кислотах.
Форма работы: коллективная, групповая.
Постановка проблемы: Кислота и её важнейшие свойства.
Обмен информации.
Вывод.
Оценивание.
Домашнее задание.
Рефлексия.

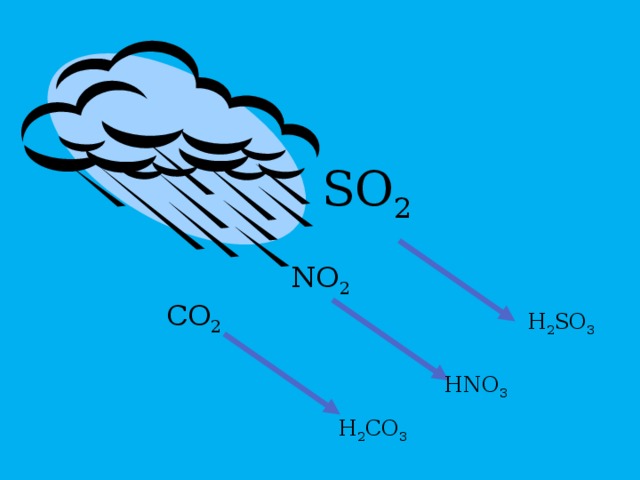
SO 2
NO 2
CO 2
H 2 SO 3
HNO 3
H 2 CO 3


Кислоты – это сложные вещества, состоящие из атомов водорода (способных замещаться на атомы металлов) и кислотного остатка. Количество атомов водорода, способных замещаться на атом металла, указывает на основность кислот или валентность кислотного остатка.



Амфотерный

Найдите X по реакции
X + H 2 O →X(OH) 2
1.Na 2 O. 2.CaO. 3.ZnO
A)только 1 B) только 2 C ) только 3 D)1,3 E)2,3
Решение:
I. Na 2 O + H 2 O → 2NaOH
II. CaO + H 2 O → Ca(OH) 2
III. ZnO + H 2 O →реакция не идёт

В водном растворе какого вещества индикатор окрашивается в синий цвет ?
- KOH
- Cu(OH) 2
- Be(OH) 2
- Ba(OH) 2
A) I,II B) III, IV C) I, IV D) II, III E) I, III

Определите X, Y и Z.
X + H 2 O → основание + H 2
Y + H 2 O → основание + H 2
Z + H 2 O → основание
X Y Z
- CaO Ca CaH 2
- Na K Li
- NaH Na 2 O Na
- Li 2 O CaO Na 2 O
- Na CaH 2 Na 2 O
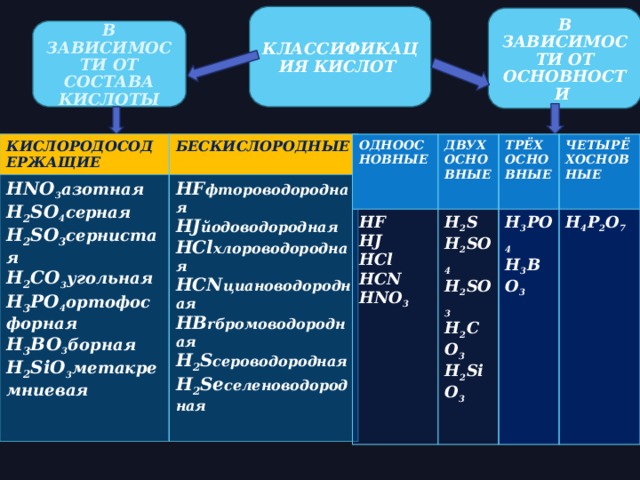
КЛАССИФИКАЦИЯ КИСЛОТ
В ЗАВИСИМОСТИ ОТ ОСНОВНОСТИ
В ЗАВИСИМОСТИ ОТ СОСТАВА КИСЛОТЫ
КИСЛОРОДОСОДЕРЖАЩИЕ
HNO 3 азотная
БЕСКИСЛОРОДНЫЕ
H 2 SO 4 серная
HF фтороводородная
ОДНООСНОВНЫЕ
HJ йодоводородная
H 2 SO 3 сернистая
HF
ДВУХОСНОВНЫЕ
H 2 S
HJ
HCl хлороводородная
H 2 CO 3 угольная
ТРЁХОСНОВНЫЕ
HCN циановодородная
H 2 SO 4
HCl
H 3 PO 4 ортофосфорная
ЧЕТЫРЁХОСНОВНЫЕ
H 3 PO 4
H 2 SO 3
H 3 BO 3
H 4 P 2 O 7
HCN
HB rбромоводородная
H 3 BO 3 борная
H 2 S сероводородная
H 2 CO 3
HNO 3
H 2 SiO 3 метакремниевая
H 2 SiO 3
H 2 Se селеноводородная

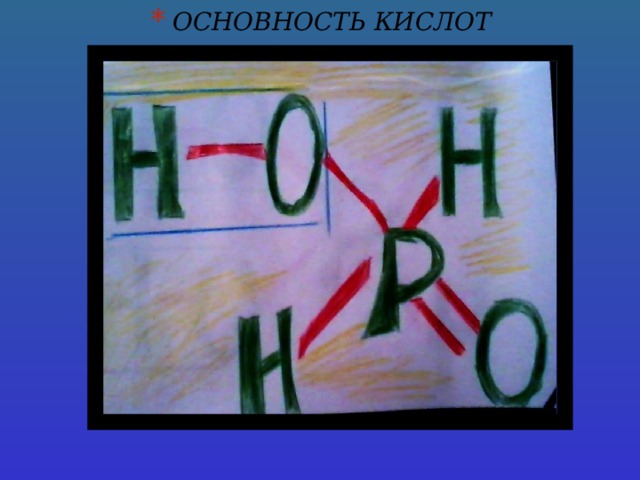
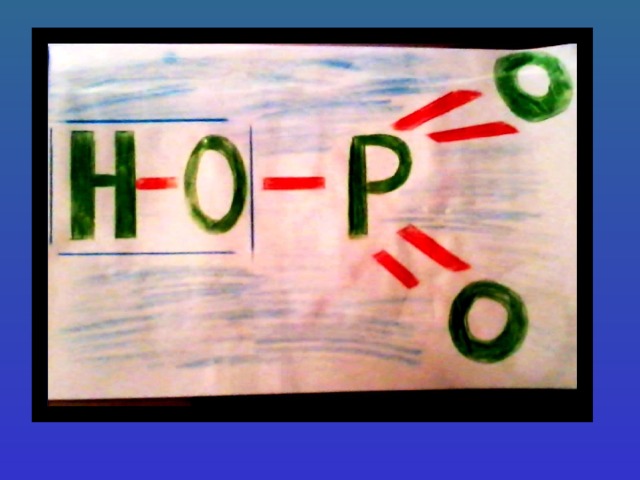
- Строение кислот и их основность
У всех кислот кроме HNO 3 , H 3 PO 2 , H 3 PO 3 степень окисления совпадает с валентностью неметалла.
В неорганических кислотах основность равняется количеству атомов водорода, способного замещаться атомом металла.Кроме кислот H 3 PO 2 , H 3 PO 3 у всех кислот основность и количество атомов водорода совпадают.
H 3 PO 2 – одноосновная
H 3 PO 3 – двухосновная
Основность определяется количеством водородных атомов соединённых атомом кислорода.


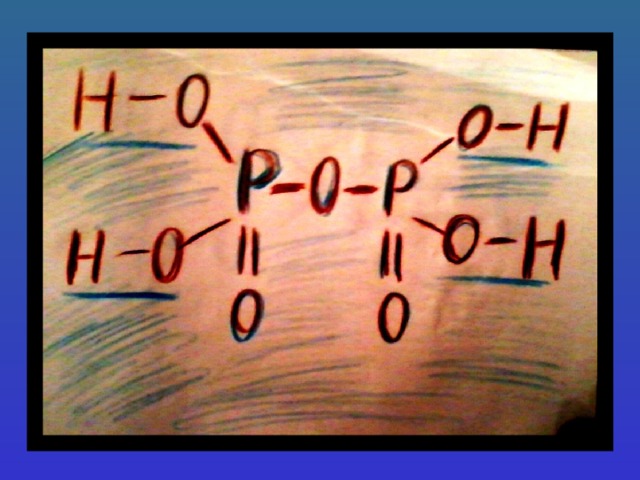

Названия кислот берутся от названия неметалла, образующего данную кислоту. Если неметалл образует несколько кислот, используются приставки мета-, орто-, гипо-, пиро-, пер-. У бескислородных кислот к названию элемента образующего кислоту, прибавляют слово «водородная», у кислородосодержащих кислот при средней степени окисления элемента «-истая», а при высшей степени окисления элемента «-ная».

- По активности кислоты делятся
СИЛЬНЫЕ
СРЕДНИЕ
H 2 SO 4
HF
СЛАБЫЕ
HNO 3
HPO 3
HCl
H 2 SiO 3
H 3 PO 4
H 2 CO 3
HBr
H 2 SO 3
H 2 S
HJ
HCN
CH 3 COOH

Физические свойства кислот
Твёрдые
Жидкие
HPO 3
H 3 PO 3
H 2 SO 4
H 3 PO 4
HNO 3
H 3 BO 3
HCOOH
H 2 SiO 3
CH 3 COOH
H 2 SiO 3 в воде не растворяется и индикатор цвета не меняет


индикатор
Свой цвет
Лакмус
Фиолетовый
Фенолфталеин
Окраска в кислой среде
Бесцветный
Метилоранж
Красный
Оранжевый
Бесцветный
Розовый

- Получение бескислородных кислот
При растворение в воде газа, полученного по реакции неметалла с водородом:
- H 2 + Cl 2 → 2HCl
- H 2 + J 2 → 2 HJ
- H 2 + S → H 2 S
II.Получение кислородосодержащих кислот:
- CO 2 + H 2 O → H 2 CO 3
- SO 3 + H 2 O → H 2 SO 4
- N 2 O 5 + H 2 O → 2HNO 3
- SiO 2 + H 2 O → реакция не идёт
![Вытеснением сильной кислотой слабой кислоты из её соли: H 2 SO 4 [HCl, HNO 3, H 3 PO 4 ] H 2 SO 3, H 2 CO 3, H 2 S, H 2 SiO 3 CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2 Na 2 CO 3 + H 2 S → реакция не идёт Так как сила кислот HCl HNO 3 H 3 PO 4 равны, то реакция будет идти только в случае , если образуется осадок NaCl + HNO 3 → реакция не идёт AgNO 3 + HCl → AgCl↓ + HNO 3](https://fhd.multiurok.ru/f/6/e/f6e55505fc99480959ab3d9082199fae82a62861/img25.jpg)
- Вытеснением сильной кислотой слабой кислоты из её соли:
H 2 SO 4 [HCl, HNO 3, H 3 PO 4 ] H 2 SO 3, H 2 CO 3, H 2 S, H 2 SiO 3
CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2
Na 2 CO 3 + H 2 S → реакция не идёт
Так как сила кислот HCl HNO 3 H 3 PO 4 равны, то реакция будет идти только в случае , если образуется осадок
NaCl + HNO 3 → реакция не идёт
AgNO 3 + HCl → AgCl↓ + HNO 3

- Химические свойства кислот
Zn + HCl → ZnCl 2 + H 2 ↑
Fe + HCl → FeCl 2 + H 2 ↑
Fe + H 2 SO 4 (разб.)→ FeSO 4 + H 2 ↑
2Na + H 2 SO 4 (разб.) → Na 2 SO 4 + H 2 ↑
с активными металлами
8Na + 5H 2 SO 4 (конц.) → 4Na 2 SO 4 + H 2 S ↑ + H 2 O
С малоактивными металлами
2Fe + 6H 2 SO 4 (конц.) t → Fe 2 (SO 4 ) 3 + 3SO 2 ↑ + 6H 2 O

H 2 SO 4 + 2NaOH → Na 2 SO 4 + 2H 2 O
HCl + NaOH → NaCl + H 2 O
Как видно из уравнений, один моль кислоты, имеющий в составе один водород, нейтрализуется одним молем гидроксида натрия –NaOH, и один моль кислоты, имеющей в составе два водорода, нейтрализуется двумя молями NaOH.



- Кислоты взаимодействуют с амфотерными оксидами и с основными оксидами:
- FeO + 2HCl → FeCl 2 + H 2 O Продукт соль,вода CuO + H 2 SO 4 → CuSO 4 + H 2 O ZnO +2HCl → ZnCl 2 + H 2 O
- FeO + 2HCl → FeCl 2 + H 2 O Продукт соль,вода CuO + H 2 SO 4 → CuSO 4 + H 2 O ZnO +2HCl → ZnCl 2 + H 2 O
- FeO + 2HCl → FeCl 2 + H 2 O Продукт соль,вода CuO + H 2 SO 4 → CuSO 4 + H 2 O ZnO +2HCl → ZnCl 2 + H 2 O
- FeO + 2HCl → FeCl 2 + H 2 O Продукт соль,вода CuO + H 2 SO 4 → CuSO 4 + H 2 O ZnO +2HCl → ZnCl 2 + H 2 O
- FeO + 2HCl → FeCl 2 + H 2 O Продукт соль,вода
- CuO + H 2 SO 4 → CuSO 4 + H 2 O
- ZnO +2HCl → ZnCl 2 + H 2 O
Кислоты взаимодействуют также с некоторыми солями. В соответствии с рядом вытеснения кислотами друг друга из соли можно определить, какая кислота реагирует с какой солью. Данный ряд называют вытеснительным (активным) рядом кислот. Стоящая в этом ряду предыдущая кислота вытесняет из соли последующую кислоту.
Na 2 CO 3 +2HCl → 2NaCl + CO 2 ↑ + H 2 O
CaCO 3 + 2HCl → CaCl 2 + CO 2 ↑ + H 2 O








- Тук-Тук ханум «Соляная кислота»

Наша «Тук-тук» ханум отыскивает для себя верного друга, но никак не может найти. И вот в конце она находит верного друга суслика. Мы импровизировали сказку на соляную кислоту ,которая не со всеми металлами вступает в реакцию.



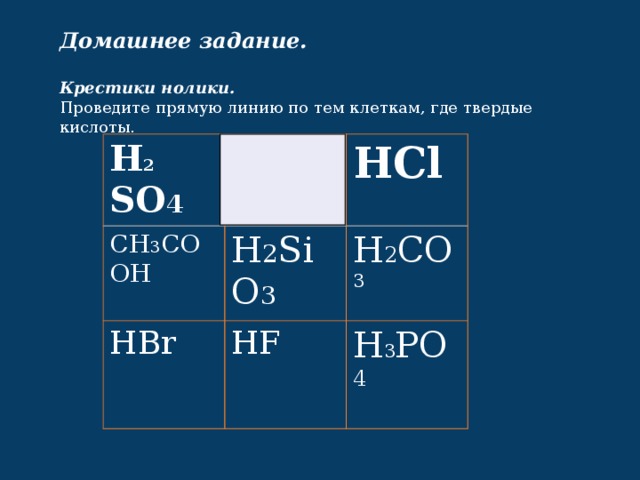
Домашнее задание.
Крестики нолики.
Проведите прямую линию по тем клеткам, где твердые кислоты.
H 2 SO 4
HNO 3
CH 3 COOH
HCl
H 2 SiO 3
HBr
HF
H 2 CO 3
H 3 PO 4

Нужно, нужно нам учиться, Нужно химию познать, Чтоб весною в огороде Удобренья применять. Будем опыты мы ставить, Будем формулы учить, Чтобы пользоваться ими, Понимать, а не зубрить! Надо нам готовить, красить И дела по дому делать, Но без химии, ты знаешь, Ничего не выйдет, милый!

К алий
О лово
Н атрий
Е дкий
Ц езий






























![Вытеснением сильной кислотой слабой кислоты из её соли: H 2 SO 4 [HCl, HNO 3, H 3 PO 4 ] H 2 SO 3, H 2 CO 3, H 2 S, H 2 SiO 3 CaCO 3 + 2HCl → CaCl 2 + H 2 O + CO 2 Na 2 CO 3 + H 2 S → реакция не идёт Так как сила кислот HCl HNO 3 H 3 PO 4 равны, то реакция будет идти только в случае , если образуется осадок NaCl + HNO 3 → реакция не идёт AgNO 3 + HCl → AgCl↓ + HNO 3](https://fhd.multiurok.ru/f/6/e/f6e55505fc99480959ab3d9082199fae82a62861/img25.jpg)






































