Просмотр содержимого документа
«Презентация к уроку химии в 9 классе по теме "Окислительно - восстановительные реакции. Значение окислительно - восстановительных реакций в природе и технике"»

Окислительно – восстановительные реакции. Значение окислительно- восстановительных реакций в природе и технике.
Учитель химии :Рыженкова В.В.

Окислительно-восстановительные реакции (ОВР) – это реакции,
в процессе которых меняется степень окисления двух элементов, один из которых является окислителем, а другой – восстановителем
Восстановитель – это тот элемент, который
в процессе реакции отдает электроны
и сам при этом окисляется
Окислитель – это тот элемент, который
в процессе реакции принимает электроны
и сам при этом восстанавливается
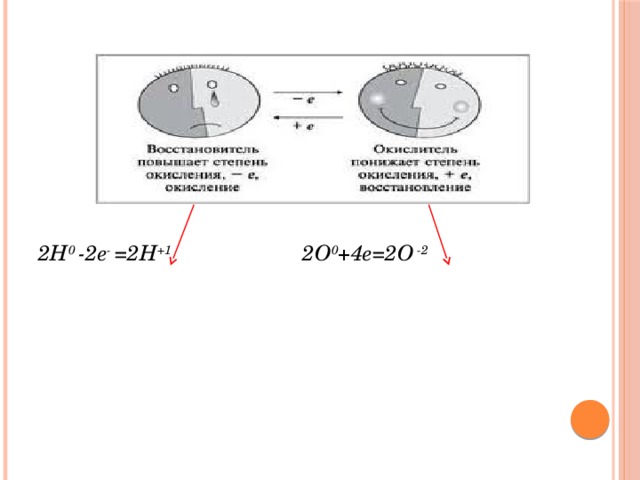
2Н 0 -2е - =2Н +1 2О 0 +4е=2О -2

Правила составления (алгоритм)
окислительно – восстановительных реакций (ОВР)

Составление уравнений ОВР
Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод ионно-электронного баланса (или метод полуреакций) .
Метод электронного баланса испoльзуют для cocтaвлeния уравнений прocтых окислительно-восстановительных реакций .
Общee числo элeктрoнoв, oтдaнныx вocстанoвитeлeм дoлжнo рaвнятьcя oбщему числу элeктрoнoв, принятыx oкислитeлeм.
Пoдсчeт числa пeрeшeдших элeктрoнoв лeжит в oснoвe cocтавления уравнений ОВР .

Значение
окислительно-
восстановительных
реакций

Лесные пожары
C + O 2 → CO 2

фотосинтез
О 2
О 2
О 2
О 2
CO 2 + H 2 O → C 6 H 12 O 6 + O 2

Коррозия металлов
Fe +H 2 O +O 2 → Fe(OH) 3


Аккумуляторы
Zn +H 2 SO 4 → ZnSO 4 + H 2 ↑

Извержение вулканов
S + O 2 → SO 2


Сгорание топлива

Взрывчатые вещества
P + KClO 3 → P 2 O 5 + KCl

Салют
Fe + O 2 → Fe 2 O 3









































