
Тема 1.4 «Химические реакции. Термодинамика и кинетика»
1.4.2. Кинетика химических реакций. Ферментативный катализ. Химическое равновесие. Условия смещения равновесия .

Химическая кинетика – учение о скоростях и механизмах химических реакций. Основное понятие кинетики – скорость химической реакции (v х.р. ).
Скорость химической реакции определяется числом частиц, прореагировавших за единицу времени в единице объема.
Т.к. число частиц (количество вещества) в единице объема
с=ν/V – это молярная концентрация, то можно сказать:
Скорость - это изменение концентрации вещества за единицу времени и измеряется в моль/л∙сек

Факторы, от которых зависит скорость химической реакции
- Природа реагирующих веществ
- Концентрация веществ
- Площадь поверхности (для гетерогенных реакций) и давление для реакций, в которых участвуют газы
- Температура
- Катализатор

Природа реагирующих веществ

Концентрация веществ и давление для реакций, в которых участвуют газы
Химическая реакция проходит при
непосредственном столкновении частиц
Закон действующих масс (К Гульдберг, П.Вааге, Н.Бекетов)
аА + вВ = dD v х.р. = k С(А) a ∙ С(B) b
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степени равной стехиометрическому коэффициенту в уравнении.
k –константа скорости, это скорость реакции при единичных молярных концентрациях исходных веществ, она зависит от природы веществ. Это правило верно для гомогенных реакций, т.е. для реакций, протекающих в одной фазе.

Составить кинетическое уравнение для реакций:

Для газообразных веществ вместо понятия «молярная концентрация» принято говорить о «парциальном давлении». Скорость реакции в которой участвуют газы, зависит от парциального давления этих газов.

Площадь поверхности (для гетерогенных реакций)
Для гетерогенных реакций, когда реагирующие вещества находятся в разных фазах и сталкиваются друг с другом только на границе раздела, скорость зависит прежде всего от величины площади поверхности раздела.
Например: В какой реакции скорость зависит от концентрации обоих веществ?
2Н 2 + О 2 = 2Н 2 О и 2Mg + О 2 = 2MgО

Как изменить скорость гетерогенной реакции?
- На скорость влияет концентрация вещества, которое находится в жидкой или газообразной фазе, следовательно ее изменение изменит скорость...
- При измельчении увеличивается общая площадь частиц…
- Непрерывный подвод реагентов и отвод продуктов – перемешивание.
![Важной характеристикой реакции является «порядок реакции». Реакции второго порядка - скорость зависит от концентрации двух исходных веществ и т.д. обычно это гомогенные реакции, например: 2Н 2 + О 2 = 2Н 2 О, v х.р. = k [Н 2 ] 2 ∙ [О 2 ] Реакции первого порядка - скорость зависит от концентрации какого-то одного исходного вещества, например: 2Mg + О 2 = 2MgО, v х.р. = k ∙ [О 2 ] Реакции нулевого порядка - скорость реакции не зависит от концентрации реагирующих веществ, т.е. v х.р. = k (постоянная). Например: 2SO 2 +O 2 = 2SO 3 Скорость зависит здесь от концентрации катализатора, а от концентрации веществ не зависит. В химии практически не встречаются реакции выше 2-го порядка.](https://fsd.multiurok.ru/html/2017/11/26/s_5a1a979f93a83/img9.jpg)
Важной характеристикой реакции является «порядок реакции».
- Реакции второго порядка - скорость зависит от концентрации двух исходных веществ и т.д. обычно это гомогенные реакции, например:
2Н 2 + О 2 = 2Н 2 О, v х.р. = k [Н 2 ] 2 ∙ [О 2 ]
- Реакции первого порядка - скорость зависит от концентрации какого-то одного исходного вещества, например:
2Mg + О 2 = 2MgО, v х.р. = k ∙ [О 2 ]
- Реакции нулевого порядка - скорость реакции не зависит от концентрации реагирующих веществ, т.е. v х.р. = k (постоянная). Например:
2SO 2 +O 2 = 2SO 3 Скорость зависит здесь от концентрации катализатора, а от концентрации веществ не зависит.
В химии практически не встречаются реакции выше 2-го порядка.
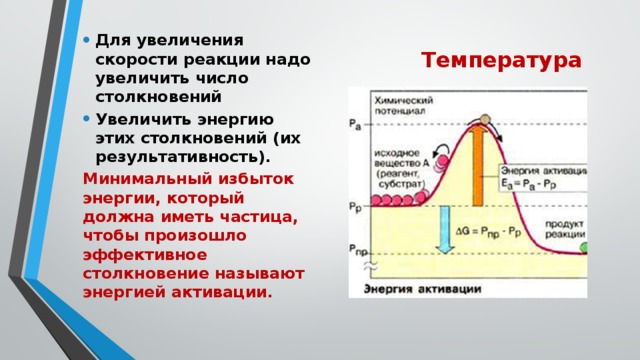
- Для увеличения скорости реакции надо увеличить число столкновений
- Увеличить энергию этих столкновений (их результативность).
Минимальный избыток энергии, который должна иметь частица, чтобы произошло эффективное столкновение называют энергией активации.
Температура
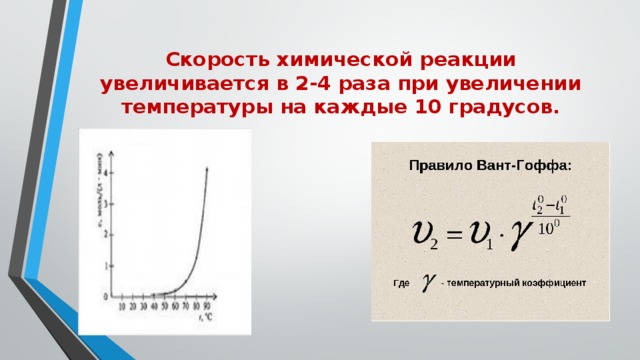
Скорость химической реакции увеличивается в 2-4 раза при увеличении температуры на каждые 10 градусов.

Есть и другой путь: катализ.
Катализ – изменение скорости химической реакции с помощью особых веществ – катализаторов, которые участвуют в процессе, но к концу реакции остаются неизменными.
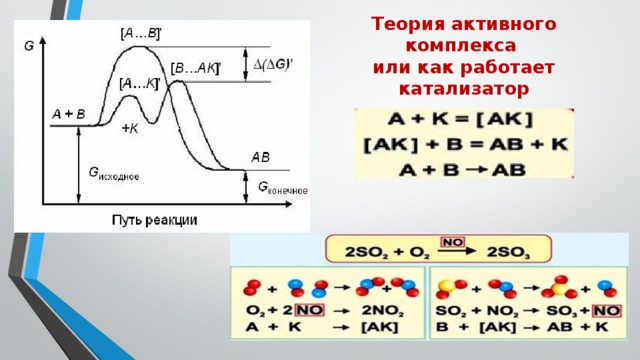
Теория активного комплекса или как работает катализатор

Катализ бывает:
- положительный и отрицательный – в зависимости от того увеличивается или уменьшается скорость в процессе катализа (отрицательный катализатор обычно называют ингибитором);
- автокаталитическим – если катализатором является какое-то вещество из продуктов реакции;
- кислотно-основный – если катализатором являются ионы водорода;
- гомогенным и гетерогенным – в зависимости от того в одной или разных фазах находятся катализатор и исходные вещества.

Особенности каталитических реакций:
1) катализатор не расходуется в процессе катализа;
2) взаимодействие обычно происходит не по уравнению реакции;
3) катализаторы не влияют на химическое равновесие , они одинаково ускоряют прямую и обратную реакцию;
4) катализаторы чувствительны к посторонним веществам , если это вещество усиливает действие катализатора – его называют промотором (активатором), если ослабляет – каталитически ядом;
5) большинство катализаторов избирательны .

Ферментативный катализ
Особую группу катализаторов составляют ферменты (энзимы) – биологические катализаторы .
Их известно приблизительно 2000. Они управляют всеми биохимическими процессами в организме, ни одна реакция в организме не протекает без участия фермента. Ферменты – это специфические белки, присутствующие во всех клетках. В их состав могут входить и небелковые части – коферменты.

Особенности ферментативного катализа
1) Очень высокая скорость реакций (в 10 6 -10 12 раз больше, чем скорость обычных реакций), потому что энергия активации ферментативных процессов очень низкая. Ферментативные реакции принято характеризовать молекулярной активностью. Молекулярная активность – число молекул вещества превращенных 1 молекулой фермента за 1 сек. Для пепсина молекулярная активность равна 20, для амилазы – 300, для холинэстеразы – 300 000.
2) Изменение концентрации фермента очень сильно влияет на скорость метаболических процессов. Определение концентрации ферментов (ее называют активностью фермента) в биологических жидкостях позволяет диагностировать различные заболевания (энзимодиагностика). Существует также энзимотерапия – применение ферментов с лечебной целью. Например, мезим-форте.

3) Очень высокая специфичность (избирательность) биохимических реакций.
4) Ферменты легко теряют свои каталитические свойства , поэтому ферментативные процессы протекают в очень мягких условиях и очень сильно зависят от температуры и кислотности среды.
5) Скорость ферментативных процессов сильно зависит от присутствия посторонних веществ , которые могут быть активаторами и ингибиторами ферментов. Например: KCN, H 2 S, CO, пестициды, многие лекарства взаимодействуют с ферментами и мешают образованию активного комплекса; а ионы Mg, Mn, Zn и других металлов активируют ферменты.

- Скорость химической реакции зависит от концентрации веществ.
- С течением времени концентрация исходных веществ уменьшается и скорость прямой реакции тоже уменьшается. А скорость обратной реакции со временем увеличивается, потому что увеличивается концентрация продуктов реакции.
- Химическим равновесием называется состояние системы, когда скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие

В состоянии химического равновесия отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ с учетом стехиометрических коэффициентов, есть величина постоянная при данной температуре, и называется константой равновесия.
аА + вВ сС + dD
Концентрации всех веществ, участвующих в реакции, связаны между собой, и изменение одной из них влечет за собой изменение другой. Константа равновесия является количественной характеристикой равновесия. К от 0 до ∞

Закон действующих масс – один из основных законов химии, он позволяет рассчитывать константы равновесия и концентрации веществ при различных химических процессах (диссоциации, гидролиза, растворения и т.д.). Напишите выражение для константы равновесия данного процесса.

1884 г Ле Шателье сформулировал правила по которому можно определить как сдвигается химическое равновесие при при изменении внешних условий. Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в системе ускоряются процессы, направленные на ослабление этого воздействия.

Куда сдвинется химическое равновесие при изменении условий реакции?
2Н 2(г) + О 2(г) 2Н 2 О (г) + Q
Этот процесс при определенных условиях обратим. В процессе реакции (всегда!) изменяется число молекул исходных веществ и продуктов реакции, температура (очень часто), и давление (если меняется число частиц газообразных веществ)
- Рассмотрим, что происходит в прямой реакции: концентрация водорода и кислорода уменьшается (Они вступают в реакцию и расходуются), а концентрация воды (она образуется) – увеличивается. Температура увеличивается (т.к. реакция экзотермическая). Давление уменьшается (2 ν + 1 ν ↔ 2 ν).
- В обратной реакции все наоборот. (ЗАПИСАТЬ ВСЕ ИЗМЕНЕНИЯ ПАРАМЕТРОВ НАД И ПОД СТРЕЛКАМИ в уравнении реакции !!!)
 ), равновесие (рс) сдвигается (→) в сторону (исходных веществ? продуктов реакции?). 4) Если уменьшить концентрацию кислорода, то … 5) Если увеличить концентрацию водорода, то… 6) Если понизить температуру, то… 7) Если повысить давление, то 8) Если увеличить концентрацию воды, то … 9) Если понизить давление, то … " width="640"
), равновесие (рс) сдвигается (→) в сторону (исходных веществ? продуктов реакции?). 4) Если уменьшить концентрацию кислорода, то … 5) Если увеличить концентрацию водорода, то… 6) Если понизить температуру, то… 7) Если повысить давление, то 8) Если увеличить концентрацию воды, то … 9) Если понизить давление, то … " width="640"
3) По принципу Л-Ш , если увеличить температуру (↑t), то система стремится понизить температуру ( ↓t). И для этого увеличивается скорость (↑v) (прямой? обратной?) реакции. Следовательно (=), равновесие (рс) сдвигается (→) в сторону (исходных веществ? продуктов реакции?).
4) Если уменьшить концентрацию кислорода, то …
5) Если увеличить концентрацию водорода, то…
6) Если понизить температуру, то…
7) Если повысить давление, то
8) Если увеличить концентрацию воды, то …
9) Если понизить давление, то …

2С (тв) + О 2(г) ↔ 2СО (г) + Q Как сдвинется равновесие, если… а) увеличить температуру б) уменьшить концентрацию СО в) увеличить давление
















![Важной характеристикой реакции является «порядок реакции». Реакции второго порядка - скорость зависит от концентрации двух исходных веществ и т.д. обычно это гомогенные реакции, например: 2Н 2 + О 2 = 2Н 2 О, v х.р. = k [Н 2 ] 2 ∙ [О 2 ] Реакции первого порядка - скорость зависит от концентрации какого-то одного исходного вещества, например: 2Mg + О 2 = 2MgО, v х.р. = k ∙ [О 2 ] Реакции нулевого порядка - скорость реакции не зависит от концентрации реагирующих веществ, т.е. v х.р. = k (постоянная). Например: 2SO 2 +O 2 = 2SO 3 Скорость зависит здесь от концентрации катализатора, а от концентрации веществ не зависит. В химии практически не встречаются реакции выше 2-го порядка.](https://fsd.multiurok.ru/html/2017/11/26/s_5a1a979f93a83/img9.jpg)














 ), равновесие (рс) сдвигается (→) в сторону (исходных веществ? продуктов реакции?). 4) Если уменьшить концентрацию кислорода, то … 5) Если увеличить концентрацию водорода, то… 6) Если понизить температуру, то… 7) Если повысить давление, то 8) Если увеличить концентрацию воды, то … 9) Если понизить давление, то … " width="640"
), равновесие (рс) сдвигается (→) в сторону (исходных веществ? продуктов реакции?). 4) Если уменьшить концентрацию кислорода, то … 5) Если увеличить концентрацию водорода, то… 6) Если понизить температуру, то… 7) Если повысить давление, то 8) Если увеличить концентрацию воды, то … 9) Если понизить давление, то … " width="640"


















