
Подготовка к ОГЭ по химии в 2018 году
Подготовила
учитель химии МБОУ СОШ № 9 Серебрякова Елена Васильевна

Сроки и место проведения
Сроки ОГЭ 9-х классов по химии в 2018 году:
Основной период – 7 июня (четверг) ,
резерв - 25 июня (понедельник) .
ОГЭ по химии выпускники сдают на добровольной основе по своему выбору.

Структура и содержание КИМ 2018
- Согласно КИМ 2016 года в структуре ОГЭ по химии изменения отсутствуют
1. Структура варианта КИМ по-прежнему состоит из двух частей (часть 1 – задания с кратким ответом, часть 2 – задания с развернутым ответом).
- 2. Задания в варианте КИМ представлены в режиме сквозной нумерации.

Структура и содержание КИМ 2018
- Изменения в содержании КИМ отсутствуют. Как и в 2017 году в проекте демоверсии предложено две модели проведения ОГЭ:
- - модель 1 (без реального эксперимента) – 22 задания,
- - модель 2 (с реальным экспериментом) – 23 задания.

Содержание заданий аттестации по химии
- Содержание КИМ определяется на основе документов:
- Обязательный минимум содержания основного общего образования по химии (Приказ МО РФ № 1236 от 19.05.98 г.).
- Федеральный компонент государственных стандартов основного общего и среднего (полного) общего образования по химии (Приказ МО РФ № 1089 от 05.03.2004 г.).
- Проверяемые элементы содержания учебного предмета представлены в Кодификаторе контрольно-измерительных материалов ГИА.

- Часть 1 содержит 19 заданий с кратким ответом, в их числе 15 заданий базового уровня сложности (порядковые номера этих заданий: 1, 2, 3, 4,…15) и 4 задания повышенного уровня сложности (порядковые номера этих заданий: 16, 17, 18, 19).
- При всем своем различии задания этой части сходны в том, что ответ к каждому из них записывается кратко в виде одной цифры или последовательности цифр (двух или трех).

Часть 2 КИМ содержит 3 задания высокого уровня сложности, с развернутым ответом:
Задание 22, предусматривает выполнение «мысленного эксперимента»;
Задания расположены по принципу постепенного нарастания уровня их сложности.
Доля заданий базового, повышенного и высокого уровней сложности составляет в работе 68, 18 и 14% соответственно

Задание 20 предусматривает расстановку коэффициентов в ОВР методом электронного баланса (аналогично С1 ЕГЭ, на более простых реакциях).
Задание 21 - расчетная задача .
Задание 22 - мысленный эксперимент: для заданного набора веществ спланировать синтез нового вещества, написав уравнения реакций, указать признаки их протекания. Написать ионное уравнение одной из реакций.

Продолжительность ОГЭ по химии
На выполнение экзаменационной работы отводится 120 минут;
Примерное время, отводимое на выполнение отдельных заданий,
составляет:
1) для каждого задания части 1 – 3–8 минуты;
2) для каждого задания части 2 – 12–17 минут;

Система оценивания выполнения заданий
Верное выполнение каждого из заданий части 1 базового уровня сложности (1–15) оценивается 1 баллом. Верное выполненное каждого из заданий части 1 повышенного уровня сложности (16–19) максимально оценивается 2 баллами.
Задания 16 и 17 считаются выполненными верно, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются 0 баллов.

Система оценивания выполнения отдельных заданий и экзаменационной работы в целом
Верное выполненное каждого из заданий части 1 повышенного уровня сложности (16–19) максимально оценивается 2 баллами.
Задания 16 и 17 считаются выполненными верно, если в каждом из них правильно выбраны два варианта ответа. За неполный ответ – правильно назван один из двух ответов или названы три ответа, из которых два верные, – выставляется 1 балл. Остальные варианты ответов считаются неверными и оцениваются 0 баллов.

Система оценивания выполнения отдельных заданий и экзаменационной работы в целом
Задания 18 и 19 считаются выполненными верно, если правильно установлены три соответствия.
Частично верным считается ответ, в котором установлены два соответствия из трех; он оценивается 1 баллом.
Остальные варианты считаются неверным ответом и оцениваются 0 баллов.

Система оценивания выполнения отдельных заданий и экзаменационной работы в целом
Проверка заданий части 2 (20–23)
Максимальная оценка за верно выполненное задание: за задания 20 и 21 – по 3 балла; за задание 22 – 5 баллов;
Задания с развернутым ответом могут быть выполнены обучающимися разными способами.

Шкалирование
Максимальный первичный балл за выполнение всех заданий экзаменационной работы по химии составляет 34 балла. Шкала пересчета первичного балла в пятибальную оценку:
Первичный балл Отметка
0 – 8 «2»
9 – 17 «3»
18 – 26 «4»
27 - 34 «5»
Отметку «5» рекомендуется выставлять в том случае, если из общей суммы баллов, достаточной для получения этой отметки, выпускник набрал 5 и более баллов за выполнение заданий части 2.
Результаты экзамена могут быть использованы при приеме учащихся в профильные классы средней школы. Ориентиром при отборе в профильные классы может быть показатель, нижняя граница которого соответствует 23 баллам.

Задание1
Четыре электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
На данном рисунке
1 ) С, Si, Sn
изображена модель атома
2) О, Cl, I
- 1) хлора
- 2) азота
- 3) магния
- 4) фтора
3) N, C, S
4) Mg, Be, Ca

Подсказка1
1. По порядковому номеру элемента можно определить:
а) заряд ядра ;
б) число протонов ;
в) число электронов ;
г ) рассчитать число нейтронов (от относительной атом-ной массы отнять число протонов).
2. По номеру периода определяют число электронных
уровней в атоме .
3. По номеру группы можно определить:
а) число электронов на внешнем уровне для элементов
главной (А) подгруппы;
б) максимальную валентность (есть исключения).

Задание 2
В каком ряду химические элементы расположены в по-
рядке увеличения металлических свойств?
1) Li-Be-B
2) Li-Na-K
3) Mg-Al-Si
4) Ca-Mg-Be
В каком ряду химические элементы расположены в порядке усиления неметаллических свойств?
- 1) O-S-Se
- 2) Si-P-S
- 3) S-Р-Si
- 4) O-N-C

Задание 16
- В ряду химических элементов В — С — N
- 1) увеличивается заряд ядер атомов
- 2) возрастают кислотные свойства образуемых гидроксидов
- 3) увеличивается число электронных уровней
- 4) уменьшается электроотрицательность
- 5) возрастает атомный радиус

Подсказка 2
Слева направо по периоду :
а) металлические свойства простых веществ, образованных элементами, уменьшаются, а неметаллические свойства увеличиваются;
б ) радиус атома уменьшается;
в) основные свойства оксидов и гидроксидов уменьшаются, а кислотные свойства увеличиваются;
г ) восстановительные свойства уменьшаются, а окислительные увеличиваются;
д ) электроотрицательность элементов возрастает.

Сверху вниз по группе:
а) металлические свойства простых веществ, образованных элементами, увеличиваются, а неметаллические свойства убывают;
б) радиус атома увеличивается;
в) основные свойства оксидов и гидроксидов возрастают, а кислотные свойства убывают;
г) электроотрицательность элементов уменьшается.


1. В ряду химических элементов О → S → Sе :
1
уменьшается радиус атома
2
2
уменьшается электроотрицательность
3
усиливаются неметаллические свойства
4
4
увеличиваются заряды ядер атомов
5
уменьшается число заполненных электронных слоев
ОТВЕТ:

Решение задач
Задание 21
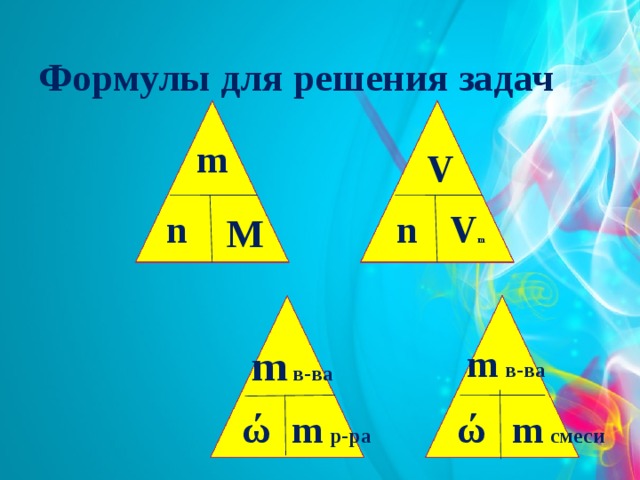
Формулы для решения задач
m
V
n
n
V m
M
m в-ва
m в-ва
m смеси
m р-ра
ώ
ώ

Напишите уравнения к задачам
- FeS + 2HCl= FeCl 2 + H 2 S
- 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O
- 2NaOH + CO 2 = Na 2 CO 3 + H 2 O
- Fe + 2HCl= FeCl 2 + H 2
- H 2 SO 4 + BaCl 2 = BaSO 4 + 2HCl
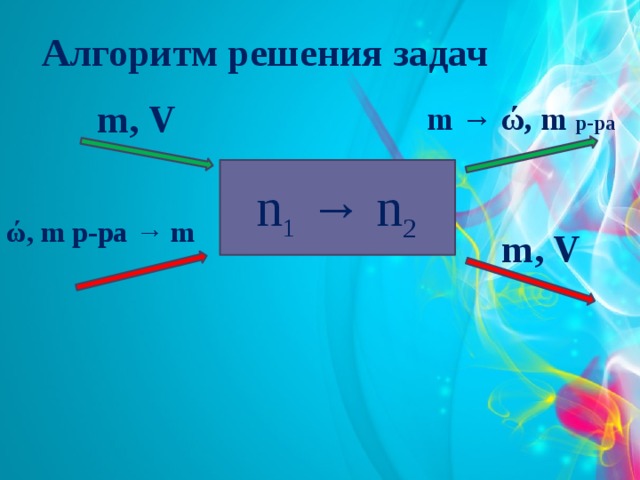
Алгоритм решения задач
m, V
m → ώ, m р-ра
n 1 → n 2
ώ, m р-ра → m
m, V

Решите задачи
1) При взаимодействии избытка раствора карбоната калия с 10%-ным раствором нитрата бария выпало 3,94 г осадка. Определите массу взятого для опыта раствора нитрата бария.
2) Через 40 г раствора гидроксида натрия с массовой долей 6 % пропустили углекислый газ до образования карбоната натрия. Вычислите объём (н.у.) вступившего в реакцию газа.



Мысленный эксперимент
Задание 22

Критерии оценивания
- Два уравнения в молекулярном виде
- Сокращенное ионное уравнение
- Признаки протекания двух реакций

Признаки реакций
Fe(OH) 2 - серо-зеленый
Fe(OH) 3 –
красно-коричневый

Признаки реакций
Al(OH) 3 , Zn(OH) 2 - белесый
Cu - красный

Признаки реакций
AgCl, BaSO 4, СaСО 3 –
белый
Cu(OH) 2 - голубой

Признаки реакций
- Цвет осадков:
- AgI, Ag 3 PO 4 – желтый
PbS, CuS - черный
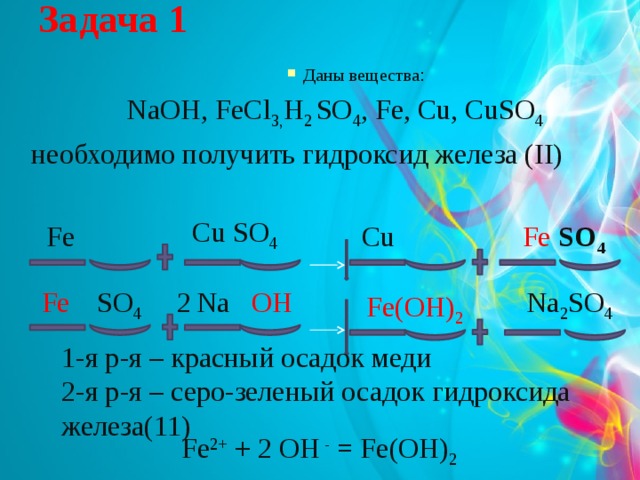
Задача 1
- Даны вещества :
- Даны вещества :
- Даны вещества :
- Даны вещества :
- Даны вещества :
- Даны вещества :
- Даны вещества :
- Даны вещества :
- Даны вещества :
NaOH, FeCl 3, H 2 SO 4 , Fe, Cu, CuSO 4
необходимо получить гидроксид железа (II)
Cu SO 4
Cu
Fe
Fe SO 4
2
Na 2 SO 4
SO 4
Na
OH
Fe
Fe(OH) 2
1-я р-я – красный осадок меди
2-я р-я – серо-зеленый осадок гидроксида железа(11)
Fe 2+ + 2 ОН - = Fe(OH) 2

Задача 2
- Даны: твердые хлорид аммония и гидроксид кальция, растворы азотной кислоты, гидроксида натрия, нитрата бария, раствор лакмуса. Получить раствор нитрата аммония.
- 1)2NH 4 Cl + Ca(OH) 2 = 2NH 3 +2H 2 O +CaCl 2
- 2) NH 3 + HNO 3 = NH 4 NO 3
1-я р-я: выделение газа с резким запахом
2-я р-я: раствор азотной кислоты, окрашенный лакмусом в красный цвет становится синим (фиолетовым), запах исчезает
NH 4 + + ОН - = NH 3 + Н 2 O

Особые случаи
а) Fe(OH) 3 + 3 HCl → FeCl 3 + 3 H 2 O
- Растворение бурого осадка и ( или) образование раствора желтого цвета
б) Zn(OH) 2 + 2 HCl → ZnCl 2 + 2 H 2 O
- Растворение белого осадка и (или) образование прозрачного раствора
в) NaOH + HCl → NaCl + H 2 O

Спасибо за внимание!





























































