
«…Узнать, понять и охватить гармонию научного здания
с его недостроенными частями – такое наслаждение,
какое дает только высшая красота и правда».
Д.И.Менделеев, Сочинения, том 24

О каком веществе идет речь?
1. Это вещество входит в состав крови человека.

О каком веществе идет речь?
1. Это вещество входит в состав крови человека.
2. Легионеры Древнего Рима получали часть жалованья этим веществом.

О каком веществе идет речь?
1. Это вещество входит в состав крови человека.
2. Легионеры Древнего Рима получали часть жалованья этим веществом.
3.Оно содержится в Мировом океане.

О каком веществе идет речь?
1. Это вещество входит в состав крови человека.
2. Легионеры Древнего Рима получали часть жалованья этим веществом.
3.Оно содержится в Мировом океане.
4. Наши предки встречали гостей в знак дружбы хлебом и …
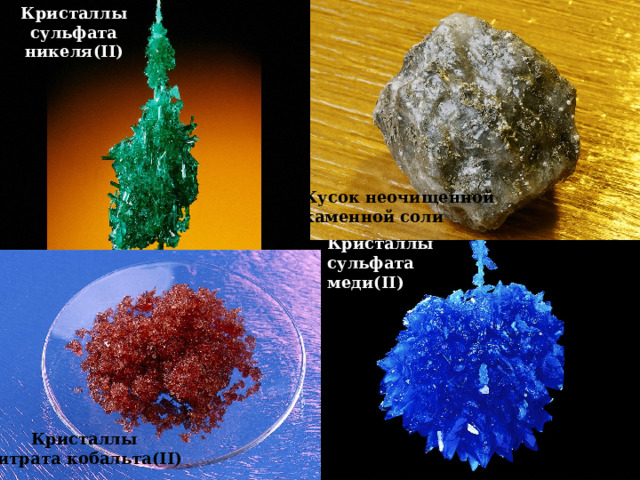
Кристаллы
сульфата
никеля(II)
Кусок неочищенной
каменной соли
Кристаллы
сульфата меди(II)
Кристаллы
нитрата кобальта(II)

![Даны вещества : К 2 О , HCl, FeBr 3 , Cu(OH) 2 , (CaOH) 3 PO 4 MnSO 4 , Na[Al(OH) 4 ], HNO 3 , NaHS, NaH, CaC 2 , Li 3 N, Ni(CO) 4 … Выпишите из них формулы солей. FeBr 3, (CaOH) 3 PO 4 , MnSO 4 , Na[Al(OH) 4 ], NaHS](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img7.jpg)
Даны вещества : К 2 О , HCl, FeBr 3 , Cu(OH) 2 , (CaOH) 3 PO 4
MnSO 4 , Na[Al(OH) 4 ], HNO 3 , NaHS,
NaH, CaC 2 , Li 3 N, Ni(CO) 4 …
Выпишите из них формулы солей.
FeBr 3, (CaOH) 3 PO 4 , MnSO 4 ,
Na[Al(OH) 4 ],
NaHS

СОЛИ – это продукты полного или частичного замещения водорода в кислоте на металл или гидроксильной группы в основании на кислотный остаток
запишите

Физические свойства солей
Свойство
Соль
Цвет
1. NH 4 NO 3
Растворимость в воде
2. CaCO 3
Электропро-
водность
3. CuSO 4
4. LiF
Вывод: По каким физическим признакам соли отличаются друг от друга?
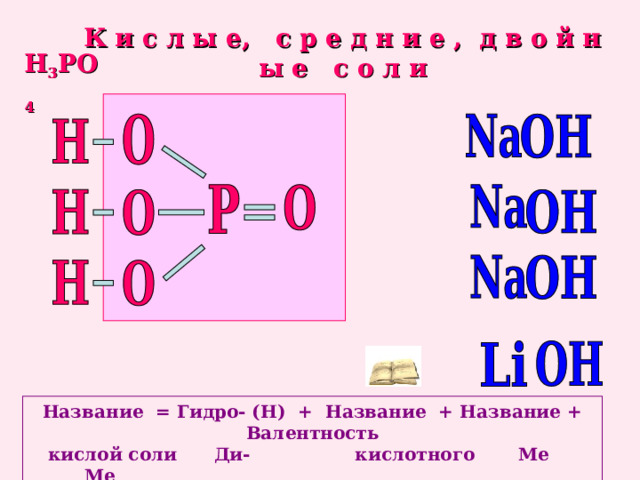
К и с л ы е, с р е д н и е , д в о й н ы е с о л и
H 3 PO 4
Название = Гидро- (Н) + Название + Название + Валентность
кислой соли Ди- кислотного Ме Ме
остатка
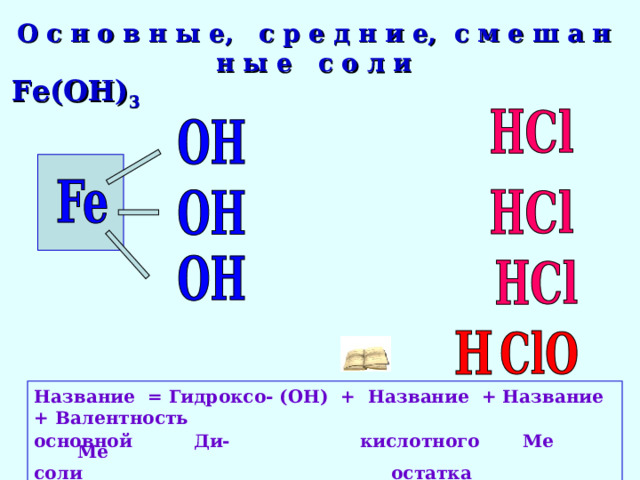
О с н о в н ы е, с р е д н и е, с м е ш а н н ы е с о л и
Fe(OH) 3
Название = Гидроксо- (ОН) + Название + Название + Валентность
основной Ди- кислотного Ме Ме
соли остатка
![Комплексные соли K 4 [Fe(CN) 6 ] – гексацианоферрат ( ІІІ) калия ( жёлтая кровяная соль ( Fe 3+ )) [Ag(NH 3 ) 2 ]Cl – хлорид диаммин серебра (І) Кристаллогидраты CuSO 4 ·5H 2 O – медный купорос MgSO 4 ·7H 2 O – горькая английская соль](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img12.jpg)
Комплексные соли
K 4 [Fe(CN) 6 ] – гексацианоферрат ( ІІІ) калия
( жёлтая кровяная соль ( Fe 3+ ))
[Ag(NH 3 ) 2 ]Cl – хлорид диаммин серебра (І)
Кристаллогидраты
CuSO 4 ·5H 2 O – медный купорос
MgSO 4 ·7H 2 O – горькая английская соль
![Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия KNaSO 4 Fe(HCO 3 ) 2 Cu(NO 3 ) 2 Ba(OH)Br K 2 [Zn(OH) 4 ] CuSO 4 ·5H 2 O NH 4 Fe(SO 4 ) 2 CsH 2 PO 4](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img13.jpg)
Сульфат калия-натрия
Гидрокарбонат железа ( ІІ)
Нитрат меди (ІІ)
Гидроксобромид бария
Тетрагидроксоцинкат калия
Пентагидрат сульфата меди (ІІ)
Сульфат аммония-железа (ІІІ)
Дигидрофосфат цезия
- Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия
- Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия
- Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия
- Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия
KNaSO 4
Fe(HCO 3 ) 2
Cu(NO 3 ) 2
Ba(OH)Br
K 2 [Zn(OH) 4 ]
CuSO 4 ·5H 2 O
NH 4 Fe(SO 4 ) 2
CsH 2 PO 4
![КОМПЛЕКСНЫЕ Na «Странные» соединения СРЕДНИЕ (НОРМАЛЬНЫЕ ) ОСНОВНЫЕ (Cu ) 2 CO 3 SO 4 [Al(OH) 4 ] OH Cu КИСЛЫЕ ДВОЙНЫЕ (SO 4 ) 2 Cu ( SO 4 ) 2 H KAl СМЕШАННЫЕ Ca(OCl) КРИСТАЛЛОГИДРАТЫ Na 2 CO 3 · Cl 2 10H 2 O запишите](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img14.jpg)
КОМПЛЕКСНЫЕ
Na
«Странные» соединения
СРЕДНИЕ
(НОРМАЛЬНЫЕ )
ОСНОВНЫЕ
(Cu ) 2 CO 3
SO 4
[Al(OH) 4 ]
OH
Cu
КИСЛЫЕ
ДВОЙНЫЕ
(SO 4 ) 2
Cu ( SO 4 ) 2
H
KAl
СМЕШАННЫЕ
Ca(OCl)
КРИСТАЛЛОГИДРАТЫ
Na 2 CO 3 ·
Cl 2
10H 2 O
запишите

Основные способы получения солей

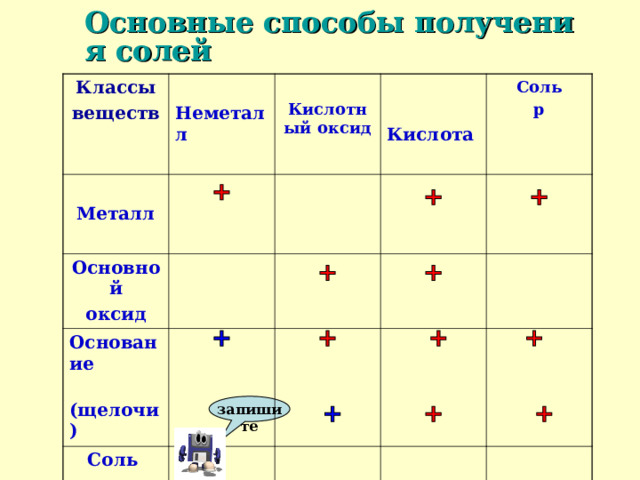
Основные способы получения солей
Классы
веществ
Неметалл
Основной
оксид
Кислотный оксид
Металл
Кислота
Основание
(щелочи)
Соль
р
Соль
р
запишите
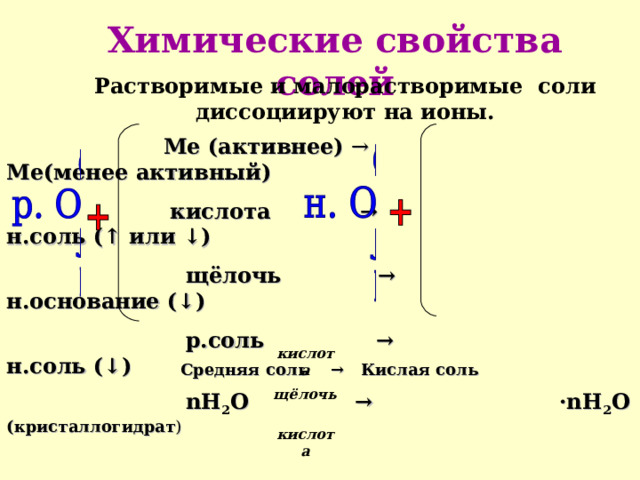
Химические свойства солей
Растворимые и малорастворимые соли диссоциируют на ионы.
Ме (активнее) → Ме(менее активный)
кислота → н.соль (↑ или ↓)
щёлочь → н.основание (↓)
р.соль → н.соль (↓)
nH 2 O → ·nH 2 O ( кристаллогидрат )
кислота
Средняя соль → Кислая соль
←
Средняя соль → Основная соль
←
щёлочь
кислота

Разложение солей – особое свойство
до Mg
Me +n ( NO 2 ) n + O 2 ↑
Ме NO 3
t o
от Mg до Cu
Me x O y + NO 2 ↑ + O 2 ↑
t o
t o
нитраты
после С u
Me 0 + NO 2 ↑ + O 2 ↑
Соли аммония достаточно легко разлагаются при t 0 :
NH 4 Cl ↔
NH 4 NO 3 =
NH 4 NO 2 =
(NH 4 ) 2 Cr 2 O 7 =
(NH 4 ) 2 CO 3 =
(NH 4 ) 2 SO 4 =
(NH 4 ) 3 PO 4 =
Тв. карбонаты и гидрокарбонаты :
СаСО 3 =
Са( HCO 3 ) 2 =
2NaHCO 3 =
Na 2 CO 3 , K 2 CO 3 плавятся без разложения !!!
NH 3 ↑ + HCl ↑
N 2 O + 2H 2 O
СаО + СО 2
СаСО 3 ↓ +СО 2 ↑ +Н 2 О
N 2 ↑ + 2H 2 O
Na 2 CO 3 +CO 2 ↑+H 2 O
N 2 ↑ + Cr 2 O 3 + 4H 2 O
2NH 3 ↑ + CO 2 ↑ + H 2 O
запишите
NH 3 ↑ + NH 4 HSO 4
2NH 3 ↑ + NH 4 H 2 PO 4
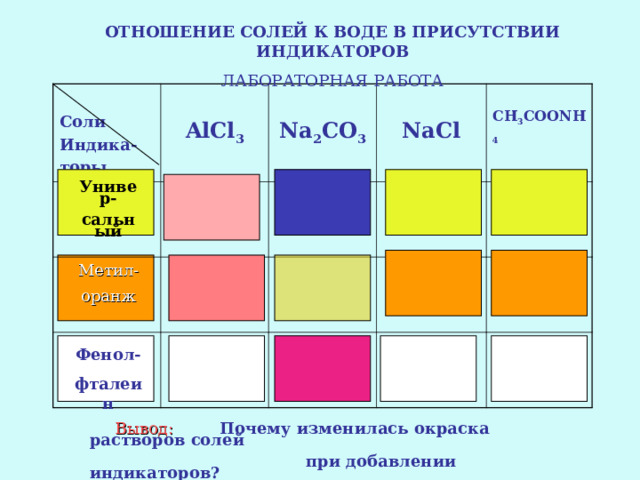
ОТНОШЕНИЕ СОЛЕЙ К ВОДЕ В ПРИСУТСТВИИ ИНДИКАТОРОВ
ЛАБОРАТОРНАЯ РАБОТА
Соли
Индика-
торы
AlCl 3
Na 2 CO 3
NaCl
CH 3 COONH 4
Универ-
сальный
Метил-
оранж
Фенол-
фталеин
Вывод: Почему изменилась окраска растворов солей
при добавлении индикаторов?
 [OH - ] лакмус - красный Na 2 CO 3 сильным основанием слабой кислотой , по АНИОНУ среда щелочная [H + ] - ] лакмус - синий Al 2 S 3 слабым основанием слабой кислотой, по КАТИОНУ И АНИОНУ, полный гидролиз, необратим Al(OH) 3 HCl NaOH H 2 CO 3 Al(OH) 3 H 2 S NaCl сильным основанием, сильной кислотой, среда нейтральная [H + ] = [OH - ] лакмус - фиолетовый Гидролиз – обратимая реакция , усиливается при нагревании системы, при разведении водой " width="640"
[OH - ] лакмус - красный Na 2 CO 3 сильным основанием слабой кислотой , по АНИОНУ среда щелочная [H + ] - ] лакмус - синий Al 2 S 3 слабым основанием слабой кислотой, по КАТИОНУ И АНИОНУ, полный гидролиз, необратим Al(OH) 3 HCl NaOH H 2 CO 3 Al(OH) 3 H 2 S NaCl сильным основанием, сильной кислотой, среда нейтральная [H + ] = [OH - ] лакмус - фиолетовый Гидролиз – обратимая реакция , усиливается при нагревании системы, при разведении водой " width="640"
Гидролиз солей
Соль образована
AlCl 3
слабым основанием
сильной кислотой ,
по КАТИОНУ
среда кислая
[H + ] [OH - ]
лакмус - красный
Na 2 CO 3
сильным основанием
слабой кислотой ,
по АНИОНУ
среда щелочная
[H + ] - ]
лакмус - синий
Al 2 S 3
слабым основанием
слабой кислотой,
по КАТИОНУ И
АНИОНУ,
полный гидролиз,
необратим
Al(OH) 3
HCl
NaOH
H 2 CO 3
Al(OH) 3
H 2 S
NaCl
сильным основанием,
сильной кислотой,
среда нейтральная
[H + ] = [OH - ]
лакмус - фиолетовый
Гидролиз – обратимая реакция , усиливается
при нагревании системы, при разведении водой
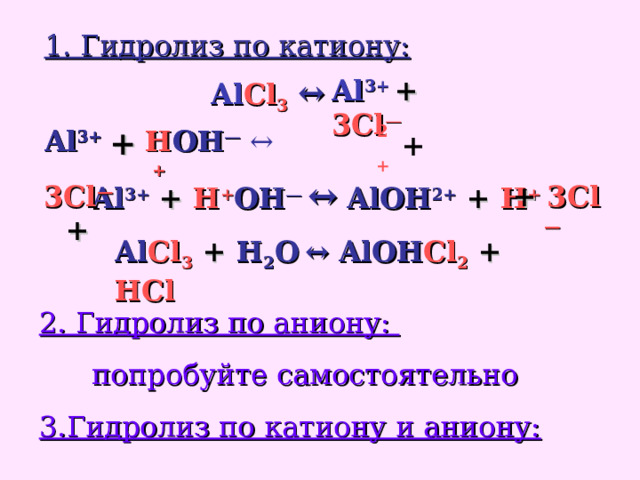
1. Гидролиз по катиону:
Al Cl 3 ↔
Al 3+ + 3Cl —
2+
↔
H +
OH —
OH —
H +
+
Al 3+
Al 3+
+
Al 3+ + H + OH — ↔ AlOH 2+ + H +
3Cl — +
+ 3Cl —
Al Cl 3 + H 2 O ↔ AlOH Cl 2 + HCl
2. Гидролиз по аниону:
попробуйте самостоятельно
3.Гидролиз по катиону и аниону:

Применение солей



СПАСИБО ЗА УРОК!
Мы учим химию опять, чтоб
в жизни знания применять,
в олимпиадах побеждать,
да и просто умным стать!!!














![Даны вещества : К 2 О , HCl, FeBr 3 , Cu(OH) 2 , (CaOH) 3 PO 4 MnSO 4 , Na[Al(OH) 4 ], HNO 3 , NaHS, NaH, CaC 2 , Li 3 N, Ni(CO) 4 … Выпишите из них формулы солей. FeBr 3, (CaOH) 3 PO 4 , MnSO 4 , Na[Al(OH) 4 ], NaHS](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img7.jpg)




![Комплексные соли K 4 [Fe(CN) 6 ] – гексацианоферрат ( ІІІ) калия ( жёлтая кровяная соль ( Fe 3+ )) [Ag(NH 3 ) 2 ]Cl – хлорид диаммин серебра (І) Кристаллогидраты CuSO 4 ·5H 2 O – медный купорос MgSO 4 ·7H 2 O – горькая английская соль](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img12.jpg)
![Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия Сульфат калия-натрия Гидрокарбонат железа ( ІІ) Нитрат меди (ІІ) Гидроксобромид бария Тетрагидроксоцинкат калия Пентагидрат сульфата меди (ІІ) Сульфат аммония-железа (ІІІ) Дигидрофосфат цезия KNaSO 4 Fe(HCO 3 ) 2 Cu(NO 3 ) 2 Ba(OH)Br K 2 [Zn(OH) 4 ] CuSO 4 ·5H 2 O NH 4 Fe(SO 4 ) 2 CsH 2 PO 4](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img13.jpg)
![КОМПЛЕКСНЫЕ Na «Странные» соединения СРЕДНИЕ (НОРМАЛЬНЫЕ ) ОСНОВНЫЕ (Cu ) 2 CO 3 SO 4 [Al(OH) 4 ] OH Cu КИСЛЫЕ ДВОЙНЫЕ (SO 4 ) 2 Cu ( SO 4 ) 2 H KAl СМЕШАННЫЕ Ca(OCl) КРИСТАЛЛОГИДРАТЫ Na 2 CO 3 · Cl 2 10H 2 O запишите](https://fsd.multiurok.ru/html/2022/03/29/s_6242ce3bc5ba9/img14.jpg)






 [OH - ] лакмус - красный Na 2 CO 3 сильным основанием слабой кислотой , по АНИОНУ среда щелочная [H + ] - ] лакмус - синий Al 2 S 3 слабым основанием слабой кислотой, по КАТИОНУ И АНИОНУ, полный гидролиз, необратим Al(OH) 3 HCl NaOH H 2 CO 3 Al(OH) 3 H 2 S NaCl сильным основанием, сильной кислотой, среда нейтральная [H + ] = [OH - ] лакмус - фиолетовый Гидролиз – обратимая реакция , усиливается при нагревании системы, при разведении водой " width="640"
[OH - ] лакмус - красный Na 2 CO 3 сильным основанием слабой кислотой , по АНИОНУ среда щелочная [H + ] - ] лакмус - синий Al 2 S 3 слабым основанием слабой кислотой, по КАТИОНУ И АНИОНУ, полный гидролиз, необратим Al(OH) 3 HCl NaOH H 2 CO 3 Al(OH) 3 H 2 S NaCl сильным основанием, сильной кислотой, среда нейтральная [H + ] = [OH - ] лакмус - фиолетовый Гидролиз – обратимая реакция , усиливается при нагревании системы, при разведении водой " width="640"
























