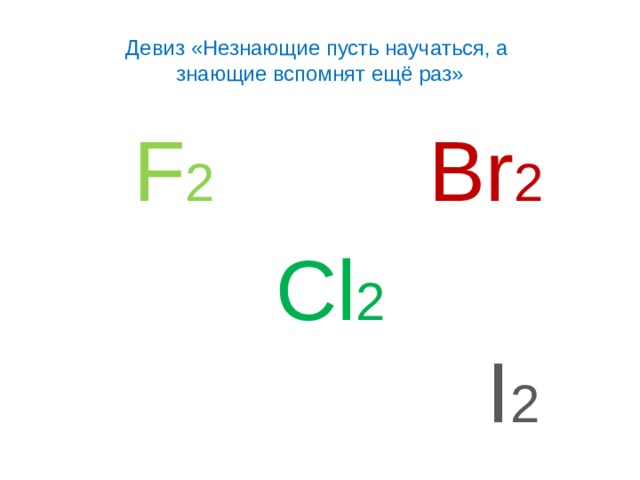
Девиз «Незнающие пусть научаться, а знающие вспомнят ещё раз»
F 2 Br 2
Cl 2 I 2


Открытие галогенов
Шееле Карл Вильгельм
Балар А Жером
Анри Муассан
Бернар КУРТУА

Задание №1
В склянку, ярко освещенную солнечными лучами, ввели равное количество газов хлора и водорода, затем закрыли ее хорошо притертой пробкой – что может произойти в подобных условиях ? Николай задумался ненадолго и произнес:
___Гм…Водород соберется наверху, потому что он более легкий, а хлор…Хлор, бесспорно, останется внизу.
Евгений взглянул на товарища и бросил:
___Навряд ли. Пройдет часа три – четыре и газы просто перемешаются.
Алексей, смущаясь, заметил:
___ Знаете что, братцы – кролики, от такой баночки нужно держаться подальше: она может неожиданно взорваться.

Задание №2 Составьте уравнения реакций взаимодействия железа с хлором, брома с алюминием, йода с алюминием.



1) 2Fe +3Cl 2 = 2FeCl 3
3) 2Al + 3I 2 = 2Al I 3

23.12.16
Соединения галогенов
I
H

Цели урока:
- продолжить знакомство с галогенами на примере их важнейших соединений;
- закрепить умения характеризовать химические свойства кислот на примере соляной кислоты;
- рассмотреть и проводить качественные реакции на галогенид-ионы;
- познакомить с природными соединениями галогенов.

Галогеноводороды
Физические свойства:
- Газы, Ц , резкий запах.
- Хорошо растворимы в воде.
Например, в 1 объеме воды при 0°С растворяется до 507 объемов хлороводорода и 612 объемов бромоводорода.
- Дымят на воздухе.
- Токсичны.
10/19/20

Галогеноводородные кислоты
- Водным растворам галогеноводородов присущи все свойства кислот.
HF – HCl – HBr – HI
Сила кислот возрастает
что объясняется
- уменьшением в этом же направлении энергии связи;
- увеличением межъядерного расстояния.

Получение хлороводорода
В лаборатории для получения HCl используют реакцию обмена между кристаллическим хлоридом натрия и концентрированной серной кислотой.
Составьте уравнение реакции:


NaCl + H 2 SO 4 = NaHSO 4 + HCl
Необратимому протеканию этой реакции способствует летучесть HCl.
В промышленности HCl получают прямым взаимодействием H 2 и Cl 2
(сжиганием)
H 2 + Cl 2 = 2HCl + Q

Хлороводород – это газ с резким запахом, без цвета, очень хорошо растворим в воде (500 объемов HCl в 1 объеме воды), на воздухе «дымит», так как взаимодействует с парами воды и образует капельки соляной кислоты. Раствор хлороводорода в воде и называют соляной кислотой.

Физические свойства соляной кислоты
Соляная кислота – бесцветная дымящаяся на воздухе жидкость
(в продажу поступает 36%-ный раствор хлороводорода в воде),
Несколько тяжелее воды (плотность 1,19 г/мл).

Химические свойства
Задание №3
Лабораторная работа
«Действие индикаторов на раствор соляной кислоты»
Соблюдаем правила ТБ

Химические свойства
Взаимодействие кислот
- с металлами Мg +2HCl =MgCl 2 +H 2 ↑
- с основными и амфотерными оксидами
- с основаниями и амфотерными гидроксидами
- с солями

HCl
1
2
3
4
5
6

Применение соляной кислоты
1. Получение солей
2. Производство пластмасс и других
синтетических материалов
3. Приготовление лекарств
4. При паянии
5. Очистка поверхности металлов в
гальваностегии
6. Производство красок


Соли галогеноводородных кислот
Галогеноводородные кислоты
образуют соли: фториды( CaF 2 ),
хлориды( NaCl ), бромиды( NaB r),
йодиды( KI ).

Задание №5
Лабораторная работа
«Определение в растворе хлорид, бромид и йодид- ионов»
Соблюдаем правила ТБ
Учебник стр. 170, рис 96

Нахождение в природе
По распространенности в природе хлор занимает 11-е место.
Хлор образует следующие важнейшие минералы:
- Галит (хлорид натрия NaCl).
2. Сильвин (хлорид калия KCl);
3. Сильвинит (хлорид калия-натрия KCl · NaCl);
4. Бишофит (хлорид магния MgCl 2 ·6H 2 O);
5. Карналлит KCl ·MgCl 2 · 6H 2 O);
6. Каинит (KCl · MgSO 4 · 3H 2 O)/
Соединения хлора содержаться в гидросфере: соленых морях и озерах
(Эльтон, Баскунчак).
Соединения хлора обязательно присутствуют в живых организмах, прежде
всего в их жидких средах: крови, желудочном соке, лимфе и др.
Важнейший пищевой продукт,
консервирующее средство.
Широко используется в хими-
ческой промышленности для
получения хлора, соляной
кислоты, гидроксида натрия.

Домашнее задание
§23 упр. 3,4 §24. записать применение и влияние на организм человека
Ресурсы Интернета
- Википедия
- http://interneturok.ru
- ФИПИ банк открытых заданий

















































