Просмотр содержимого документа
«Презентация по химии: "Неметаллы"»

Неметаллы

НЕМЕТАЛЛЫ - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего уровня.
В периоде:
- число электронов на
внешнем слое уменьш.
- электроотрицательность
увеличивается
увеличиваются
- НЕМЕТАЛЛИЧЕСКИЕ
свойства
УВЕЛИЧИВАЮТСЯ
В главной подгруппе:
- число электронов на внешнем слое не изменяется
- радиус атома увеличивается
- электроотрицательность
уменьшается
уменьшаются
- НЕМЕТАЛЛИЧЕСКИЕ свойства УМЕНЬШАЮТСЯ
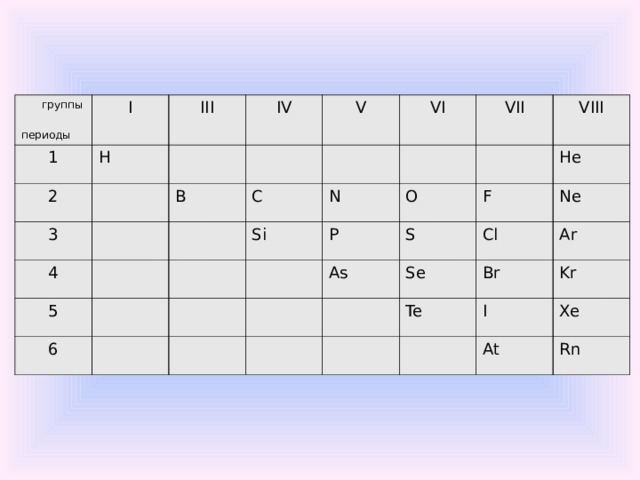
группы
периоды
1
I
III
H
2
IV
3
V
4
B
VI
5
C
VII
N
Si
6
VIII
P
O
He
As
S
F
Cl
Se
Ne
Br
Ar
Te
Kr
I
Xe
At
Rn

Особенности атомного строения неметаллов
Небольшой атомный радиус
На внешнем уровне 4-8 электронов
Располагаются только в главных подгруппах
Характерно высокое значение ЭО

ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
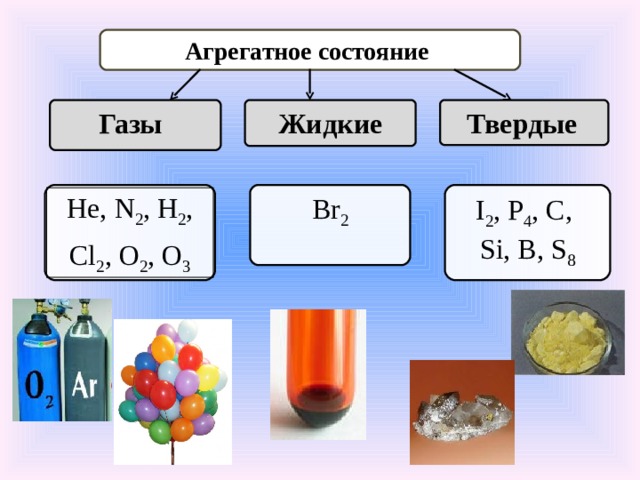
Агрегатное состояние
Газы
Жидкие
Твердые
Br 2
I 2 , P 4 , C,
Si, B, S 8
Не, N 2 , Н 2 ,
Cl 2 , O 2 , O 3

Цвет неметаллов
КРАСНЫЙ
ЖЕЛТЫЙ
ФИОЛЕТОВЫЙ
ФОСФОР
СЕРА
ЙОД
БЕСЦВЕТНЫЙ
УГЛЕРОД

Цвет неметаллов
ЧЕРНЫЙ
БЕЛЫЙ
ФОСФОР
ФОСФОР
ГРАФИТ
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР

Температура плавления
- 3 800 0 С – у графита
- - 210 0 С - азота
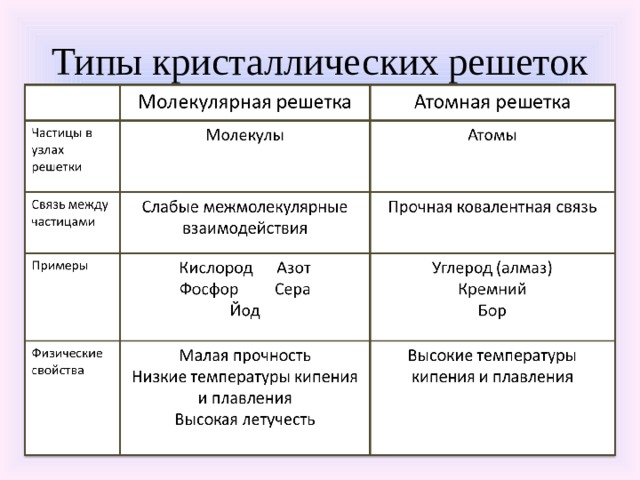
Типы кристаллических решеток

Аллотропия
- Разное типы кристаллических решеток
Р - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная
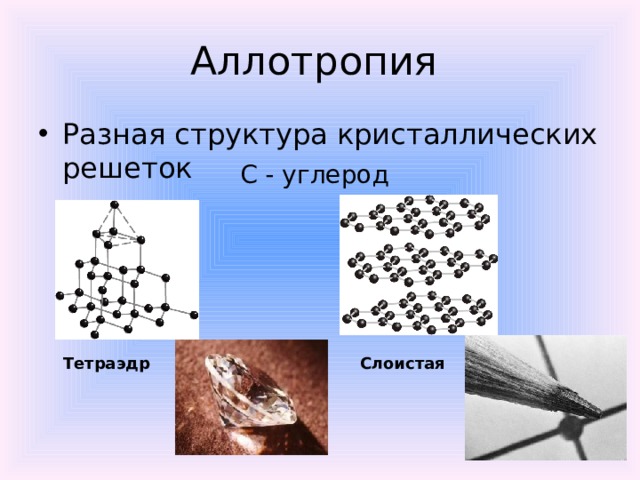
Аллотропия
- Разная структура кристаллических решеток
С - углерод
Тетраэдр
Слоистая

Аллотропия серы. Кристаллическая, пластическая и моноклинная
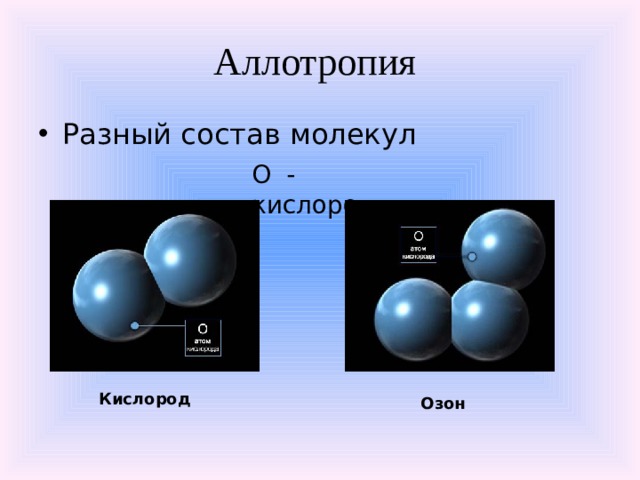
Аллотропия
О - кислород
Кислород
Озон

ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ
Окислительные свойства простых веществ:
2Fe + 3 Cl₂⁰ = 2 Fe Cl ⁻₃
3N₂⁰ + H₂ = 2N⁻³ H₃
- Реагируют с неметаллами с более низким значением электроотрицательности
2P⁰ + 5S⁰ = P₂⁺⁵ S₅⁻²
4) Реагируют с некоторыми сложными веществами
C⁻⁴H⁺₄ + 2 O⁰₂ = C⁺⁴ O₂⁻² + 2 H₂⁺ O⁻²

Восстановительные свойства неметаллов
( простых веществ):
- Со фтором все восстановители
2) С кислородом
Si⁰ + O₂ = Si⁺⁴ O₂
3) Со сложными веществами-окислителями
Например - H₂, C
3C⁰ + 2Fe₂O₃ = 3 C⁺⁴ O₂ + 4Fe
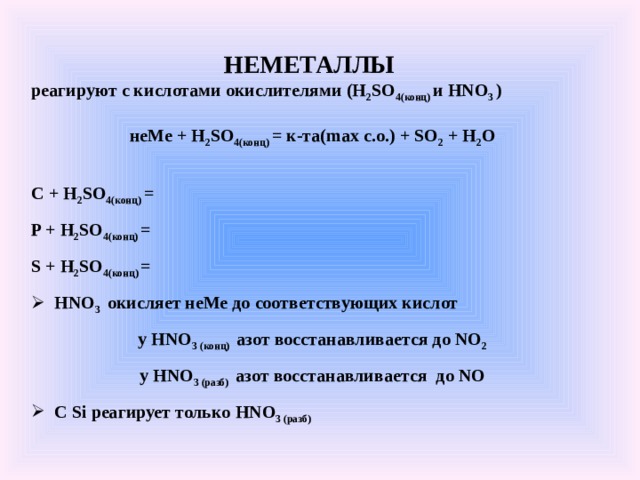
НЕМЕТАЛЛЫ
реагируют с кислотами окислителями (H 2 SO 4( конц) и HNO 3 )
неМе + H 2 SO 4( конц) = к-та( max c.o.) + SO 2 + H 2 O
C + H 2 SO 4( конц) =
P + H 2 SO 4( конц) =
S + H 2 SO 4( конц) =
- HNO 3 окисляет неМе до соответствующих кислот
у HNO 3 (конц) азот восстанавливается до NO 2
у HNO 3 (разб) азот восстанавливается до NO
- С Si реагирует только HNO 3 (разб)

Реакции диспропорционирования
- галогены (кроме фтора) и сера при взаимодействии со щелочами
S + KOH =
Cl 2 + NaOH (на холоду) =
Cl 2 + NaOH (при нагревании) =
хлор и бром при взаимодействии с водой образуют смесь кислот
Cl 2 + H 2 O = HClO + HCl











































