
Неметаллы
Общая характеристика
Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si – 27%).
C, H, O, N, P, S – биогенные элементы, составляют 98,5% от массы растений
и 97,6% от массы тела человека.

Строение атомов НеМ.
1. Элементы расположены в главных подгруппах III –VIII групп.
2. На последнем уровне 4 – 7 (8) электронов.
3. Радиус атома: уменьшается
растёт
4. Неметаллические свойства: в периоде – увеличиваются, в группе – уменьшаются.
5. Высокая электроотрицательность (в периоде увеличивается, в группе уменьшается).
6. Принимают электроны и отдают.
7. НеМ → кислотный оксид → кислота
8. Летучие водородные соединения
(кислоты, основания и безразличные)
 Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Радиус атома Атомы неметаллов Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Радиус атома Атомы неметаллов Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Атомы металлов и неметаллов.
Задание :
Сравните строение электронных оболочек и атомные характеристики (радиус, электроотрицательность, способность отдавать и принимать электроны) металлов и неметаллов.
1 – 3 4 и более
Характеристики сравнения
Атомы металлов
Количество электронов на внешнем уровне
Радиус атома
Атомы неметаллов
Электроотрицательность
Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня
По периоду – уменьшается, по группе - возрастает
По периоду – возрастает, по группе - уменьшается
Способны только отдавать электроны
Более склонны принимать электроны, чем отдавать их

Простые вещества - неметаллы.
Задание :
Определите вид химической связи в молекулах N 2 , O 2 , Cl 2 , составьте схемы её образования, укажите её особенности.
Химическая связь – ковалентная неполярная:
1. Образуется при помощи общих электронных пар.
2. Обобществлённые электроны в равной степени принадлежат связываемым атомам.
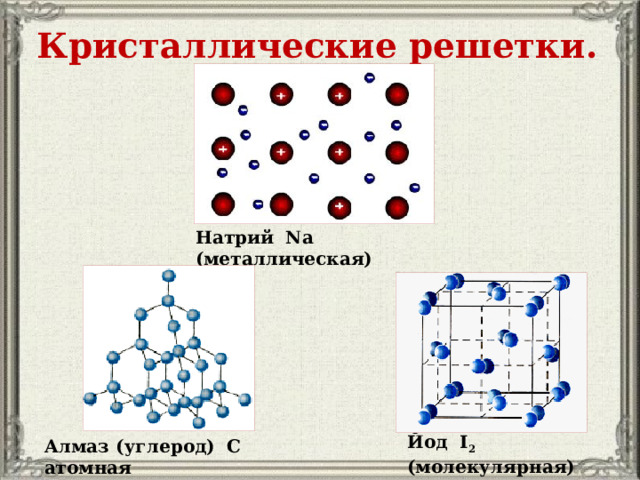
Кристаллические решетки.
Натрий Na (металлическая)
Йод I 2 (молекулярная)
Алмаз (углерод) С атомная

Металлы
Тип химической связи
Неметаллы
Металлическая
Кристаллическая решетка
Ковалентная неполярная
Металлическая
Молекулярная или атомная

Типы кристаллических решеток неметаллов.
Частицы в узлах решетки
Молекулярная
Атомная
Молекулы
Связь между частицами
Атомы
Слабые межмолекулярные взаимодействия
Примеры
Физические свойства
Прочная ковалентная связь
O 2 N 2 F 2 S 2 I 2
C Si B
Малая прочность
Низкие температуры кипения и плавления
Высокие температуры кипения и плавления
Высокая летучесть

Агрегатное состояние неметаллов.
Газы
Жидкие
Твердые
I 2 , P 4 , C,
Br 2
Si, B, S 8
Не, N 2 , Н 2 ,
Cl 2 , O 2 , O 3

Цвет неметаллов.
ЧЕРНЫЙ
БЕЛЫЙ
ГРАФИТ
ФОСФОР
ФОСФОР
ЖЕЛТО-ЗЕЛЕНЫЙ
ХЛОР

Цвет неметаллов.
ФИОЛЕТОВЫЙ
КРАСНЫЙ
ЖЕЛТЫЙ
ФОСФОР
СЕРА
ЙОД
Бесцветный
УГЛЕРОД

Температура плавления
3 800 0 С – у графита
- 210 0 С - азота

Сравнение простых веществ.
Физические свойства
Металлы
1. Состояние при обычных условиях
Неметаллы
Твердое
2. Цвет
(кроме ртути)
Различное (твердые, жидкие и газы)
Серый
3. Блеск
4. Пластичность или хрупкость
Различный
Есть
Нет
Пластичные, ковкие
5. Тепло- и электропроводность
Хрупкие
Да
Нет (кроме графита)

Химические свойства неметаллов
Преобладают окислительные свойства:
В соответствии с численными значениями относительной ЭО окислительные способности неметаллов увеличиваются в следующем порядке:

Химические свойства неметаллов.
Окислительные свойства неметаллов:
1. Реагируют с металлами:
2K + S ⁰ = K₂S ⁻²
3Ca + N₂ ⁰ = Ca₃N₂ ⁻³
2Fe + 3 Cl₂ ⁰ = 2 FeCl⁻₃
2. Реагируют с водородом:
H₂ + S ⁰ = H₂S⁻²
N₂ ⁰ + 3H₂ = 2N⁻³H₃
3H₂ ⁰ + WO₃ = 3H₂O + W
3. Реагируют с некоторыми сложными веществами,
C ⁻⁴ H₄ ⁺ + 2 O₂ ⁰ = C⁺⁴O₂⁻² + 2 H₂⁺O ⁻²
2 KI⁻ + Cl₂ ⁰ = 2 K Cl ⁻ + I₂ ⁰

Химические свойства неметаллов
Задание :
Запишите уравнения реакций взаимодействия:
1) алюминия и йода 2) фосфора и кислорода
Расставьте степени окисления элементов в веществах, покажите при помощи стрелки переход электронов, укажите окислитель и восстановитель:
2Al 0 + 3I 2 0 = 2Al +3 I 3 -1
6 ē
восстановитель окислитель
4P 0 + 5O 2 0 = 2P 2 +5 O 5 -2
20 ē
восстановитель окислитель

Самостоятельная работа
1.Допишите уравнения реакций :
Na + Br₂ → ?
Mg + P → ?
Na + Si → ?
H₂ + Cl ₂ → ?
P + Cl₂ → ?
2Na + Br₂⁰ = 2 Na Br ⁻
3Mg + 2P⁰ = Mg₃ P₂⁻³
4Na + Si⁰ = Na₄ Si⁻⁴
H₂ + Cl₂⁰ = 2H Cl ⁻
2P + 5Cl₂⁰ = 2P Cl ₅⁻

Самостоятельная работа
2.Допишите уравнения реакций :
Si + F₂→
H₂ + WO₃ →
Li + N₂ →
Si + 2F₂ = SiF₄
3H₂ + WO₃ = 3H₂O + W
6Li + N₂ = 2Li₃N

Аллотропия
Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ.
Причина аллотропии:
- Различный состав молекул простого вещества.
- Разная структура и разные типы кристаллических решёток.
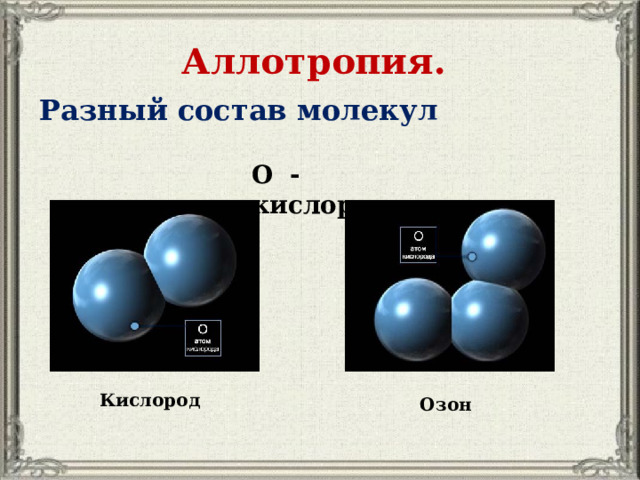
Аллотропия.
Разный состав молекул
О - кислород
Кислород
Озон

Озон О 3
Светло - синий газ с сильным запахом.
Имеет запах свежести.
Появляется после грозы.
Содержится в воздухе сосновых лесов и морского побережья
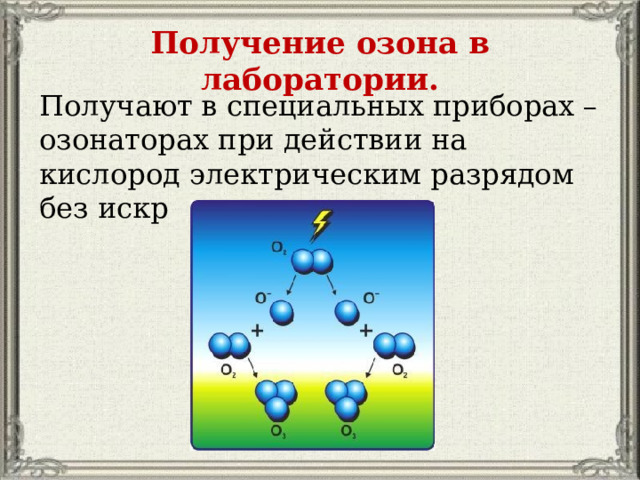
Получение озона в лаборатории.
Получают в специальных приборах – озонаторах при действии на кислород электрическим разрядом без искр

Значение озона для Земли.
Озоновый слой расположен на высоте 20 – 25 км.
Задерживает ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов
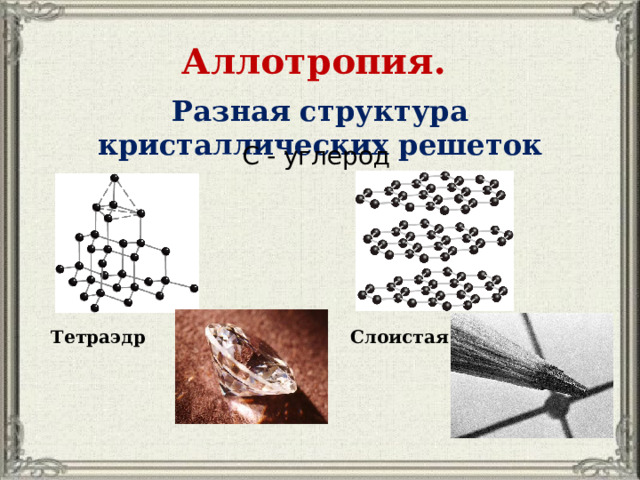
Аллотропия.
Разная структура кристаллических решеток
С - углерод
Тетраэдр
Слоистая

Аллотропия.
Разное типы кристаллических решеток.
Р - фосфор
Красный фосфор - атомная
Белый фосфор - молекулярная

Состав воздуха

Постоянные составные воздуха.
Азот
Кислород
Благородные газы

Переменные составные воздуха.
Углекислый газ
Водяные пары
Озон

Случайные составные воздуха.
Пыль
Микроорганизмы
Пыльца растений
Оксиды серы и азота

1.Какого газа ( по объему) больше всего в атмосфере Земли ?
А З О Т А
2.Какого элемента-неметалла ( по массе) больше всего в литосфере?
К И С Л О Р О Д А
3.Атомов какого элемента-неметалла (по массе) больше всего в живых организмах ?
К И С Л О Р О Д А

4. В доме выше всех живем, вдвоем тепло и свет даем.
ВОДОРОД И ГЕЛИЙ
5. Он безжизненным зовется, но жизнь без него не создается.
АЗОТ
6. Красив в кристаллах и парах, на детей наводит страх.
ЙОД
7. Из горы кусочек вынули, в деревянный ствол задвинули.
ГРАФИТ (С) В КАРАНДАШЕ
8. Гордится уголек невзрачный негорючим братом, и братом прозрачным.
АЛМАЗ, ГРАФИТ

9. Прокаленный уголек дышать пожарнику помог.
АКТИВИРОВАННЫЙ УГОЛЬ
10. Белый воздуха боится, покраснел чтоб сохраниться.
БЕЛЫЙ И КРАСНЫЙ ФОСФОР
11. Хоть многие вещества превращает в яд, в химии она достойна всяческих наград.
СЕРА
12. Какой неметалл является лесом?
БОР
13. Какие химические элементы утверждают, что могут другие вещества рождать?
ВОДОРОД, КИСЛОРОД, УГЛЕРОД
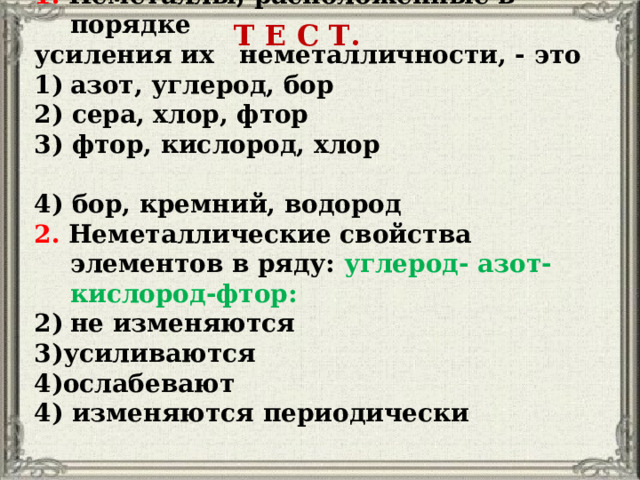
1. Неметаллы, расположенные в порядке
усиления их неметалличности, - это
2) сера, хлор, фтор
3) фтор, кислород, хлор
4) бор, кремний, водород
2. Неметаллические свойства элементов в ряду: углерод- азот- кислород-фтор:
4) изменяются периодически
Т Е С Т.

3. Ковалентная полярная связь образуется в соединении:
1) NaCl 2) 3) P₄ 4) BaCl₂
Т Е С Т.
NH₃
4. Простое вещество сера -S реагирует с каждым из веществ ряда:
1) HCl, Na, O₂
2) Mg, O₂, H₂
3) K, Zn, Na₂SO₄
4) Al, H₂O, O₂








 Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Радиус атома Атомы неметаллов Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
Характеристики сравнения Атомы металлов Количество электронов на внешнем уровне Радиус атома Атомы неметаллов Электроотрицательность Способность отдавать и принимать электроны с целью завершения внешнего энергетического уровня По периоду – уменьшается, по группе - возрастает По периоду – возрастает, по группе - уменьшается Способны только отдавать электроны Более склонны принимать электроны, чем отдавать их " width="640"
















































