

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Была в сети 22.04.2024 21:55

Капранчикова Ольга Ивановна
Учитель химии
59 лет
Местоположение
Россия, Воронеж
Специализация
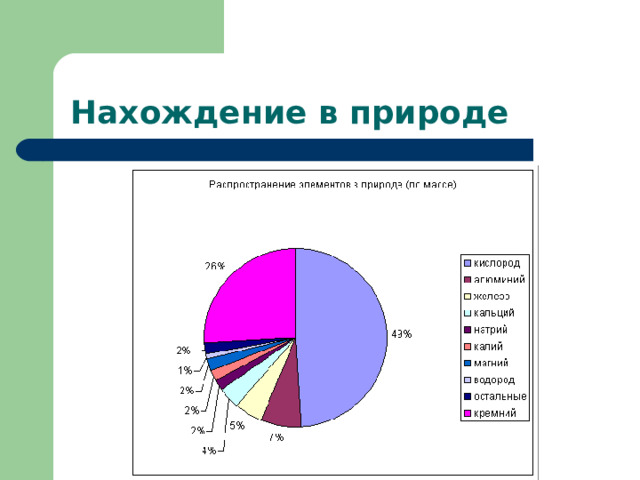
Презентация по химии для 9 класса. Тема "Алюминий"
Категория:
Химия
04.09.2023 22:13
© 2023, Капранчикова Ольга Ивановна 99 1










![Взаимодействие со щелочами . 2 Al + 2 NaOH +6 H 2 O = 2 Na[Al(OH) 4 ]+3 H 2 Na [А l (ОН) 4 ] - тетрагидроксоалюминат натрия С растворами солей: 2 Al + 3 CuSO 4 = Al 2 ( SO 4 ) 3 + 3 Cu](https://fsd.multiurok.ru/html/2023/09/04/s_64f62c5dc3d2c/img9.jpg)

 Al + CuCl 2 - Al + HNO 3 (конц) - t - Al + NaOH + H 2 O - " width="640"
Al + CuCl 2 - Al + HNO 3 (конц) - t - Al + NaOH + H 2 O - " width="640"





















