Просмотр содержимого документа
«Презентация "основания"»

О С Н О В А Н И Я
- Это сложные неорганические вещества, содержащие гидроксид группу ОН, соединенную с атомом (ионом) металла
- Валентность металла покажет число гидросид групп в формуле
- NaOH Ca(OH)2 Al(OH)3
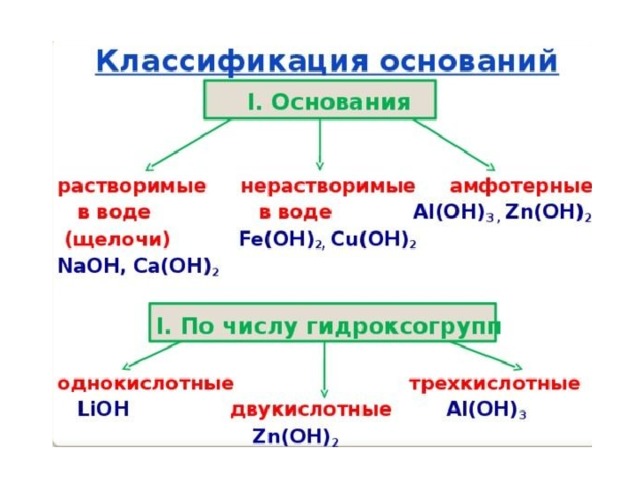

Растворимые основания называются щелочами . Растворы щелочей скользкие на ощупь ("мыльные") и довольно едкие. Они разъедают кожу, ткани, бумагу,
очень опасны (как и кислоты) при попадании в глаза. Поэтому при работе со щелочами и кислотами необходимо пользоваться защитными очками.

Если раствор щелочи все-таки попал в лицо, необходимо промыть глаза большим количеством воды, а затем разбавленным раствором слабой кислоты (например, уксусной). Этот способ медицинской помощи основан на уже известной нам реакции нейтрализации .
Лишь небольшую часть всех оснований называют щелочами. Это, например, KOH – гидроксид калия (едкое кали), NaOH – гидроксид натрия (едкий натр), LiOH – гидроксид лития, Ca(OH) 2 – гидроксид кальция (его раствор называется известковой водой), Ba(OH) 2 – гидроксид бария. Большинство других оснований в воде нерастворимы и щелочами их не называют.
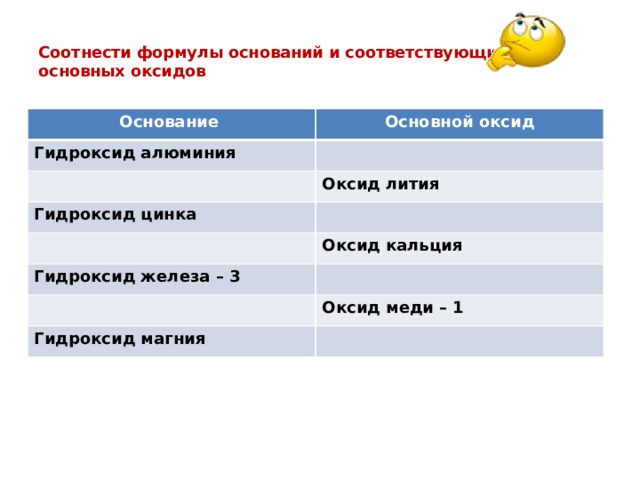
Соотнести формулы оснований и соответствующих им основных оксидов
Основание
Основной оксид
Гидроксид алюминия
Оксид лития
Гидроксид цинка
Оксид кальция
Гидроксид железа – 3
Оксид меди – 1
Гидроксид магния
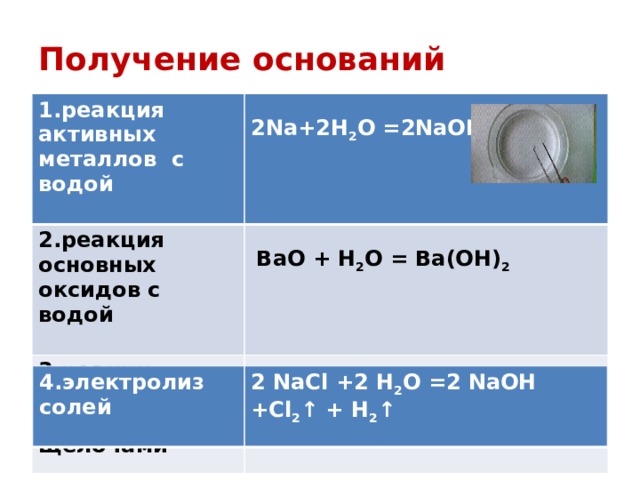
Получение оснований
1.реакция активных металлов с водой
2.реакция основных оксидов с водой
3.реакция растворов солей с щелочами
2Na+2H 2 O =2NaOH + H 2
BaО + H 2 O = Ba(OH) 2
CuSO 4 +2 NaOH = Na 2 SO 4 + Cu(OH) 2
4.электролиз солей
2 NaCl +2 H 2 O =2 NaOH +Cl 2 ↑ + H 2 ↑

Упражнения
составить уравнения реакций получения
- 1. гидроксида лития –два способа
- 2. гидроксида кальция три способа
- 3. гидроксида алюминия два способа


Химические свойства щелочей
Реакция нейтрализации
Реакция с солями
2KOH + H 2 SO 4 =K 2 SO 4 + 2 H 2 O
2NaOH + CuSO 4 =Cu(OH) 2 ↓+ 2 H 2 O
Реакция с кислотными оксидами
2NaOH + SO 3 =Na 2 SO 4 + H 2 O
Разложение сплавов щелочей
Ca(OH) 2 = CaO + H 2 O

Химические свойства нерастворимых оснований
Реакция нейтрализации
Fe(OH) 3 + 3HCl = FeCl 3 + 3H 2 O
Реакция разложения
Cu(OH) 2 = CuO + H 2 O

Упражнения
- Составить уравнения реакций для нерастворимого гидроксида никеля
с соляной кислотой и разложение при нагревании
- Ni(OH) 2 + 2HCl = NiCl 2 +2H 2 O
- Ni(OH) 2 = NiO +H 2 O

Упражнения
- Составить уравнения для химических свойств гидроксида бария:
ортофосфорной кислотой, оксидом углерода, сульфатом натрия
- 3Ba(OH) 2 + 2H 3 PO 4 = Ba 3 (PO 4 ) 2 +6H 2 O
- Ba(OH) 2 + CO 2 = BaCO 3 +H 2 O
- Ba(OH) 2 + Na 2 SO 4 = BaSO 4 +2NaOH