
Серная кислота и его свойства
Автор : Бахранова Мадина
Преподаватель химии средней общеобразовательной школы №57
Нарпайского района Самаркандской области
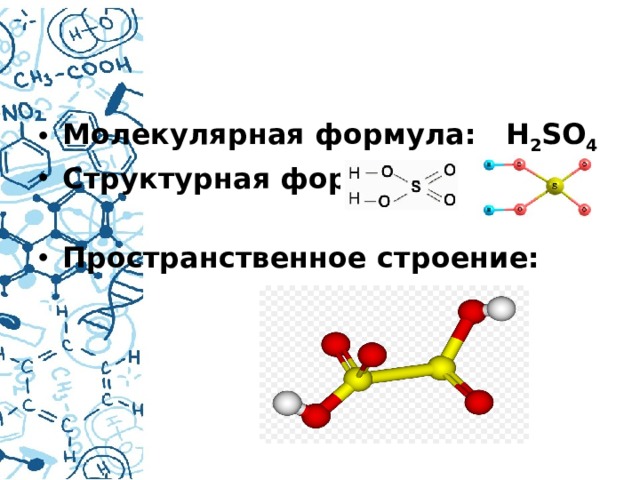
- Молекулярная формула: H 2 SO 4
- Структурная формула:
- Пространственное строение:
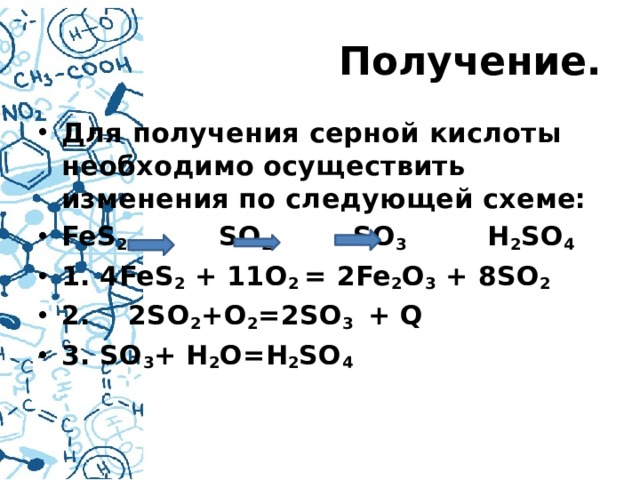
Получение.
- Для получения серной кислоты необходимо осуществить изменения по следующей схеме:
- FeS 2 SO 2 SO 3 H 2 SO 4
- 1. 4FeS 2 + 11O 2 = 2Fe 2 O 3 + 8SO 2
- 2. 2SO 2 +O 2 =2SO 3 + Q
- 3. SO 3 + H 2 O=H 2 SO 4
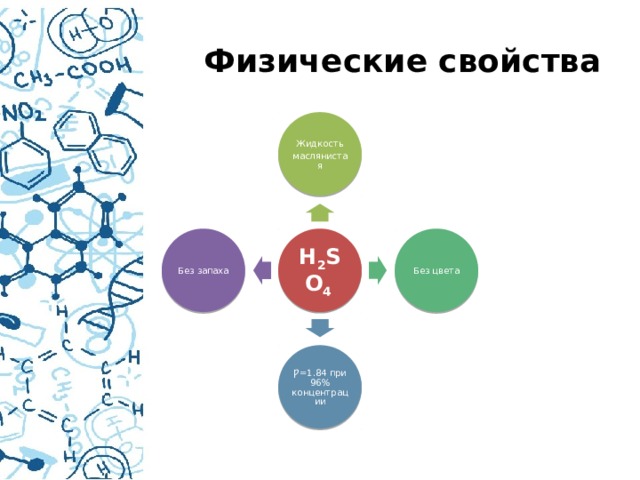
Физические свойства
Жидкость
маслянистая
H 2 SO 4
Без цвета
Без запаха
Ƿ=1.84 при 96% концентрации

Важно!
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Серная кислота H 2 SO 4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.

Химические свойства
- 1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H 2 SO 4 ⇄ H + + HSO 4 –
- По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO 4 – ⇄ H + + SO 4 2–

- 2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
- Например, серная кислота взаимодействует с оксидом магния:
H 2 SO 4 + MgO → MgSO 4 + H 2 O
- Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H 2 SO 4 + КОН → KHSО 4 + H 2 O
H 2 SO 4 + 2КОН → К 2 SО 4 + 2H 2 O
- Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H 2 SO 4 + 2Al(OH) 3 → Al 2 (SO 4 ) 3 + 6H 2 O
- 3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
- Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Н 2 SO 4 + 2NaHCO 3 → Na 2 SO 4 + CO 2 + H 2 O
Или с силикатом натрия:
H 2 SO 4 + Na 2 SiO 3 → Na 2 SO 4 + H 2 SiO 3
- Концентрированная серная кислота реагирует с твердым нитратом натрия . При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO 3 (тв.) + H 2 SO 4 → NaHSO 4 + HNO 3
- Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
NaCl (тв.) + H 2 SO 4 → NaHSO 4 + HCl

- 4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H 2 SO 4 + BaCl 2 → BaSO 4 + 2HCl
- 5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H 2 SO 4(разб.) + Fe → FeSO 4 + H 2
- Серная кислота взаимодействует с аммиаком с образованием солей аммония:
- H 2 SO 4 + NH 3 → NH 4 HSO 4

Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO 2 . С активными металлами может восстанавливаться до серы S, или сероводорода Н 2 S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H 2 SO 4(конц.) +2Fe→Fe 2 (SO 4 ) 3 +3SO 2 +6H 2 O
6H 2 SO 4(конц.) +2Al→Al 2 (SO 4 ) 3 +3SO 2 +6H 2 O

- При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H 2 SO 4(конц.) +Cu→CuSO 4 + SO 2 ↑ + 2H 2 O
2H 2 SO 4(конц.) + Hg → HgSO 4 + SO 2 ↑ + 2H 2 O
2H 2 SO 4(конц.) + 2Ag → Ag 2 SO 4 +SO 2 ↑+2H 2 O

- При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg+4H 2 SO 4 →3MgSO 4 + S +4H 2 O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H 2 SO 4(конц.) +4Zn →4ZnSO 4 +H 2 S↑ +4H 2 O

- 6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl 2 + Na 2 SO 4 → BaSO 4 ↓ + 2NaCl

- 7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H 2 SO 4(конц.) + 2P → 2H 3 PO 4 +5SO 2 ↑ + 2H 2 O
2H 2 SO 4(конц.) + С → СО 2 ↑+ 2SO 2 ↑+2H 2 O
2H 2 SO 4(конц.) + S → 3SO 2 ↑ + 2H 2 O
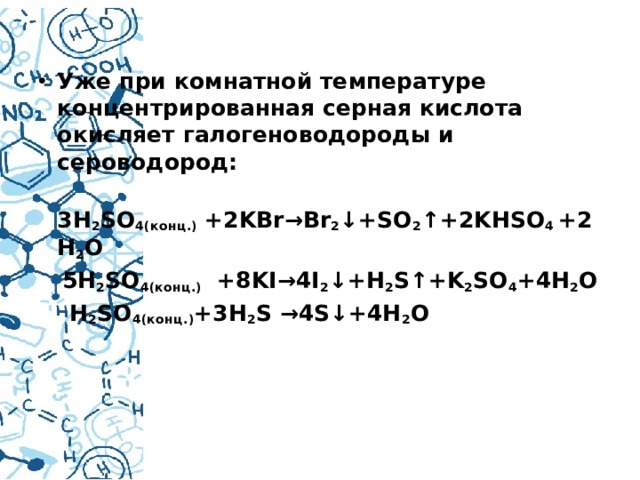
- Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H 2 SO 4(конц.) +2KBr→Br 2 ↓+SO 2 ↑+2KHSO 4 +2H 2 O
5H 2 SO 4(конц.) +8KI→4I 2 ↓+H 2 S↑+K 2 SO 4 +4H 2 O
H 2 SO 4(конц.) +3H 2 S →4S↓+4H 2 O

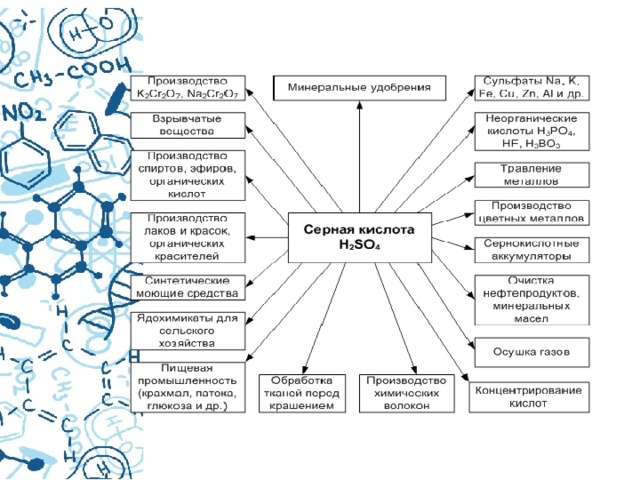
- Применение солей серной кислоты
- Железный купорос FеSО 4 •7Н 2 O применяли раньше для лечения чесотки, гельминтоза и опухолей желез, в настоящее время используют для борьбы с сельскохозяйственными вредителями. Медный купорос CuSO 4 •5Н 2 O широко используют в сельском хозяйстве для борьбы с вредителями растений.
- «Глауберова соль» (мирабилит) Nа 2 SO 4 •10Н 2 O была получена немецким химиком И. Р. Глаубером при действии серной кислоты на хлорид натрия, в медицине ее используют как слабительное средство

- «Бариевая каша» BaSO 4 обладает способностью задерживать рентгеновские лучи в значительно большей степени, чем ткани организма. Это позволяет рентгенологам при заполнении «бариевой кашей» полых органов определить в них наличие анатомических изменений.
Гипс СаSO 4 •2Н 2 O находит широкое применение в строительном деле, в медицинской практике для накладывания гипсовых повязок, для изготовления гипсовых скульптур.
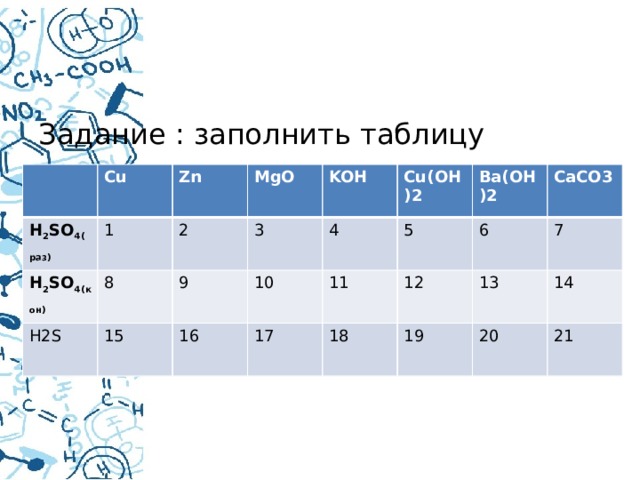
Задание : заполнить таблицу
Сu
H 2 SO 4(раз)
1
H 2 SO 4(кон)
Zn
MgO
2
8
H2S
15
3
KOH
9
10
4
16
Cu(OH)2
5
17
11
Ba(OH)2
6
CaCO3
12
18
19
7
13
14
20
21











































