
Окислительно-восстановительные реакции

Цель урока :
формирование представления об окислительно-восстановительных процессах, окислителях и восстановителях.

В природе постоянно происходят превращения разных веществ, которые можно выразить с помощью химических уравнений.
Жизнь на нашей планете невозможна без химических реакций, постоянно происходящих вокруг нас.

Условный заряд элемента, рассчитанный исходя из условий, что все связи в соединении ионные, называется степенью окисления.
Процессы дыхания, фотосинтеза, горения, брожения, извержения вулканов, грозового разряда, образования перегноя, коррозии металлов и многие другие – все это окислительно-восстановительные реакции.
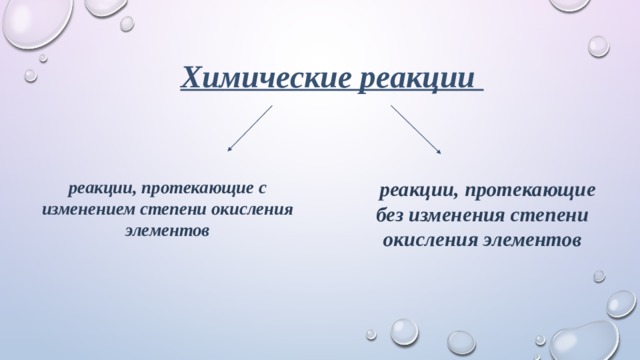
Химические реакции
реакции, протекающие без изменения степени окисления элементов
реакции, протекающие с изменением степени окисления
элементов

В реакции
+1 +5 -2 +1 -1 +1 -1 +1 +5 -2
AgNO 3 + HCl AgCl + HNO 3
степени окисления атомов химических элементов после реакции не изменились.
А вот в другой реакции – взаимодействие соляной кислоты с цинком
+1 -1 0 +2 -1 0
2HCl + Zn ZnCl 2 + H 2
атомы двух элементов, водорода и цинка, изменили свои степени окисления: водород с +1 на 0, а цинк – с 0 на +2. следовательно, в этой реакции каждый атом водорода получил по одному электрону, а каждый атом цинка – отдал два электрона
+1 0
2H + 2e H 2
0 +2
Zn - 2е Zn

Основные понятия:
Окислительно-восстановительные реакции – это химические реакции, которые протекают с изменением степени окисления атомов химических элементов или ионов, образующих реагирующие вещества.

Восстановление — процесс присоединения электронов, который сопровождается понижением степени окисления.
Окисление — процесс отдачи электрона, который сопровождается повышением степени окисления.
Восстановитель — атом или ион, который отдает электрон, а сам окисляется. Его степень окисления при этом понижается.
Окислитель — атом или ион, который принимает электрон, а сам восстанавливается.

Физкультминутка
Мы на химии писали и немножечко устали,
Мы немножко отдохнем и учиться вновь начнем - (встаем).
Электрон изображаем, путь его мы повторяем,
Как электроны по кругу перемещаются,
Наши головы вращаются - (круговые движения головой).
Пробирку все изображаем, руки вверх мы поднимаем - (руки вверх).
Реакция осуществляется, осадок вниз весь опускается - (руки вниз).
Упражнение повторим, пробирку вновь изобразим - (руки вверх, вниз).
Теперь представим мы весы - (руки в стороны).
Мы взвесить вещество должны – (покачали руками вверх-вниз)
На левую чашку вещество положили - (наклон влево),
На правую разновесы поместили - (наклон вправо).
Покачались, покачались, к равновесию пришли - (встали ровно).
Всё, немножечко размялись – вновь учиться мы должны! – (сели за парты).
+

Метод электронного баланса
Общее число электронов, которые отдаёт восстановитель, всегда равно общему числу электронов, которые присоединяет окислитель .

1. Взаимодействие металлов с неметаллами
2Mg + O 2 =2MgO
Восстановитель Mg 0 -2e Mg +2 2 окисление
Окислитель O 2 +4e 2O -2 1 восстановление

2. Взаимодействие металлов с кислотой
0 +1 +2 0
Mg +H 2 SO 4 = Mg SO 4 +H 2
Восстановитель Mg 0 -2e Mg +2 2 окисление
Окислитель 2 H 1 + 2e 2 H 0 1 восстановление

3. Взаимодействие металлов с солью
CuSO4 + Mg =MgSO 4 +Cu
Восстановитель Mg 0 -2e Mg +2 2 окисление
Окислитель Cu +2 +2e Cu 0 1 восстановление

Составим схему реакции:
Из этого примера видно, что число электронов, принятых окислителем, может отличаться от числа электронов, отданных восстановителем. Но этого быть не должно(!), так как при этом нарушается закон сохранения материи. Значит, число отданных электронов должно равняться числу принятых электронов. А для этого следует изменить число атомов окислителя и восстановителя, поставив соответствующие коэффициенты.

Например, в данном случае:
Эти коэффициенты (3 и 2) означают, что три атома меди отдают шесть электронов, а два атома азота принимают шесть электронов:
Или в краткой форме:
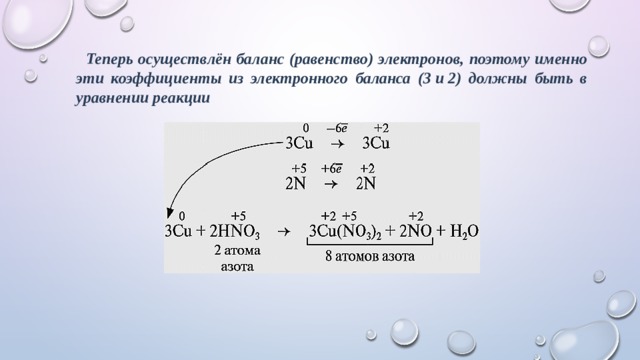
Теперь осуществлён баланс (равенство) электронов, поэтому именно эти коэффициенты из электронного баланса (3 и 2) должны быть в уравнении реакции

Но теперь не осуществляется баланс по азоту! Где же допущена ошибка? Дело в том, что в электронном балансе учитываются только электронные процессы окисления и восстановления, т. е. учитываются только те атомы, которые меняют степени окисления, а часть атомов не изменила ее:
Отсюда правило: коэффициенты электронного баланса ставят только к тем атомам, которые с данной степенью окисления встречаются в химическом уравнении один раз.
Исправим ошибку и уравняем атомы остальных элементов:

Правила расстановки коэффициентов методом электронного баланса
1. Расставить степени окисления.
2. Выписать элементы, изменившие степени окисления, указав число отданных и принятых электронов. Определить окислитель и восстановитель.
3. Поставить дополнительные коэффициенты, уравняв число отданных и принятых электронов.
4. Проверить эти коэффициенты: они должны соответствовать числу атомов данного элемента в молекуле. Например, если дополнительный коэффициент нечётный, а в молекуле чётное число атомов, то оба дополнительных коэффициента удваиваются.
5. Проверенные коэффициенты переносят в уравнение, считая атомы, к тем элементам, которые с данной степенью окисления встречаются в уравнении ОДИН раз.
6. Затем уравнивают атомы:
- металлов;
- неметаллов;
- водорода.

Составьте уравнение электронного баланса,
расставьте коэффициенты в уравнении реакции:
HNO 3 + H 2 S = H 2 SO 4 + NO + H 2 O
Составим электронные уравнения:
N +5 +3e — = N +2 | 8 окислитель
S -2 — 8e — = S +6 | 3 восстановитель
Сложим два уравнения:
8N +5 +3S -2 — = 8N +2 + 3S +6
Подставим коэффициенты в молекулярное уравнение:
8HNO 3 +3H 2 S = 3H 2 SO 4 + 8NO + 4H 2 O.

Выводы:
- окислительно-восстановительные реакции – это единство двух противоположных процессов окисления и восстановления;
- сутью окислительно-восстановительных реакций является переход электронов от одних атомов, молекул и ионов к другим;
- окислительно-восстановительные реакции играют огромную роль во всех жизненных процессах, поэтому очень важно научиться грамотно их составлять.

«Я МОЛОДЕЦ!»

Домашнее задание
Параграф 43:
- запишите основные определения урока;
- приведите примеры важнейших восстановителей и окислителей;
- расставьте коэффициенты в уравнениях реакций, укажите восстановитель и окислитель:
а) KNO 3 = KNO 2 + O 2 ;
б) Mg+ N 2 = Mg 3 N 2 .

Используемая литература:
- Аликберова Л.Ю. Полезная химия: задачи и истории. – М.: Дрофа, 2005. – 187 с.
- Габриелян О.С. Химия. 8 класс: учеб. для ОУ. – 16-е изд., стереотип. – М.: Дрофа, 2010. – 270 с.
- Денисова Л.В. Химия: Таблица Д.И. Менделеева и справочные материалы: Пособие для уч-ся. / Л.В. Денисова, Г.М. Черногорова – М.: Гуманитар. изд. центр ВЛАДОС, 2004. – 16 с.
- Лидин Р.А. Реакции неорганических веществ: справочник / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; под ред. Р.А. Лидина. – 2-е изд., перераб. и доп. – М.: Дрофа, 2007. – 637 с.
- Хомченко Г.П. Химия для поступающих в ВУЗы: Учеб.пособие. – 2-е изд., испр. – М.: Высш.шк., 1994. – 447 с.
- http://zadachi-po-khimii.ru/obshaya-himiya/zadachi-k-razdelu-okislitelno-vosstanovitelnye-reakcii.html
- http :// lara1972kav.blogspot.com/2012/08/blog-post_21.html
Приложение № 1
Приложение № 2















































