
ЗАНЯТИЕ ЭЛЕКТИВНОГО КУРСА
ПО ТЕМЕ:
«ГИДРОЛИЗ СОЛЕЙ» в 9 классе
Чистякова Татьяна Михайловна учитель химии первой категории
МОУ «ЛИЦЕЙ №3» г. Курчатова

Цели занятия:
Образовательные:
- Сформировать представление о процессе гидролиза солей, о его сущности.
- Научить учащихся составлять уравнения гидролиза солей.
- Совершенствовать умение объяснять реакцию среды раствора присутствием соответствующих ионов.
- Дать представление о практическом значении гидролиза в природе, народном хозяйстве, повседневной жизни человека.

Цели урока:
Развивающие :
- Развивать учебно-информационные навыки : умение извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов;
- Совершенствовать учебно-логические умения : умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий;
- Развивать учебно-организационные умения : организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений.
- Развивать познавательный интерес

Цели урока:
Воспитательные
- Совершенствовать коммуникативные умения в ходе коллективного обсуждения;
- Развивать умение формулировать и аргументировать собственное мнение;
- Развивать самостоятельность;
- Продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире.

Содержание занятия
1 . Механизм гидролиза солей различного состава.
2. Суть процесса гидролиза.
3. Роль гидролиза в природе
и повседневной жизни человека.

Слово учителя:
«Сегодня мы должны установить связь между химией и жизнью, межпредметные связи химии, биологии, русского языка на основе одной из важнейших тем - «ГИДРОЛИЗ». Задача нашего занятия: выявить проникновение темы «ГИДРОЛИЗ» в повседневную жизнь человека, учиться устанавливать причинно -следственные связи между строением, свойствами веществ и их применением. »


Требования к знаниям и умениям учащихся:
Должны знать:
Определение понятия «гидролиз солей»;
Сущность гидролиза солей;
Зависимость среды раствора и продуктов гидролиза от состава исходной соли;
Значение гидролиза в природе и жизни человека.

Требования к знаниям и умениям учащихся:
Должны уметь:
- Объяснять процессы, протекающие в растворах солей;
- Предсказывать реакцию раствора в зависимости от состава соли, подвергающейся гидролизу;
- Предсказывать образование кислых и основных солей в реакциях гидролиза;
- Записывать сокращенные ионные и молекулярные уравнения реакций гидролиза.

«ГИДРОЛИЗ» - от греческого «гидро» - вода «лизис» - разложение


ТЕСТ -КОНТРОЛЬ «ОКРАСКА ЛАКМУСОВОЙ БУМАГИ В РАЗЛИЧНЫХ СРЕДАХ»
Раствор щелочи
Окраска лакмусовой бумаги
Синяя
Раствор кислоты
Среда
Дистиллированная вода
Красная
Щелочная
Ионы
ОН -
Бесцветная
Кислотная
Водопроводная вода
Н +
Нейтральная
Н + = ОН -


ТЕСТ-ИЗМЕРИТЕЛЬ «ОКРАСКА ЛАКМУСА В РАСТВОРАХ СОЛЕЙ»:
хлорида алюминия
AlCl 3
Силикат натрия
Na 2 SiO 3
хлорида натрия
NaCl


ИТОГОВАЯ ТАБЛИЦА «ОКРАСКА ЛАКМУСА В РАСТВОРАХ СОЛЕЙ»
Окраска лакм уса
Хлорид алюминия AlCl 3
Красный
Среда
Силикат натрия Na 2 SiO 3
Ионы
Синий
Хлорид натрия
NaCl
Фиолетовый

![АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. AlCl 3 Al ( OH ) 3 HCl слабое основание сильная кислота [ OH ] - H ] + (что сильней того и больше!) К и с л о т н а я среда Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. Al 3+ + HOH AlOH 2+ + H + Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода . Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.](https://fsd.multiurok.ru/html/2023/05/19/s_64674f68b1a32/img17.jpg)
АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
- Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль.
AlCl 3
Al ( OH ) 3 HCl
слабое основание сильная кислота
[ OH ] - H ] +
(что сильней того и больше!) К и с л о т н а я среда
Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза.
Al 3+ + HOH AlOH 2+ + H +
- Написать на основании краткого ионного уравнения молекулярное уравнение.
Исходные вещества известны – соль и вода . Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

AlCl 3 + H 2 O AlOHCl 2 + HCl
Одним из продуктов данной обменной реакции является основная соль.
Сформулируем вывод :
Раствор соли, образованной
________________, имеет _____________реакцию, так как в растворе избыток___________________.


АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ
- Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль.
- Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза.
- Написать на основании краткого ионного уравнения молекулярное уравнение.
Исходные вещества известны – соль и вода . Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.
 [ H ] + (что сильней того и больше!) Щ е л о ч н а я среда " width="640"
[ H ] + (что сильней того и больше!) Щ е л о ч н а я среда " width="640"
Схема гидролиза СИЛИКАТА натрия
Na 2 SiO 3
Na OH H 2 SiO 3
сильное основание слабая кислота
[ OH ] - [ H ] +
(что сильней того и больше!)
Щ е л о ч н а я среда


Na 2 SiO 3 +H 2 O NaHSiO 3 +NaOH Одним из продуктов данной обменной реакции является кислая соль.
Сформулируем вывод :
Раствор соли, образованной
________________, имеет__________реакцию, так как в растворе избыток ________________.

![Схема гидролиза ХЛОРИДА натрия NaCl Na OH H Cl сильное основание сильная кислота [ OH ] - = [ H ] + Н е й т р а л ь н а я среда](https://fsd.multiurok.ru/html/2023/05/19/s_64674f68b1a32/img25.jpg)
Схема гидролиза ХЛОРИДА натрия
NaCl
Na OH H Cl
сильное основание сильная кислота
[ OH ] - = [ H ] +
Н е й т р а л ь н а я среда
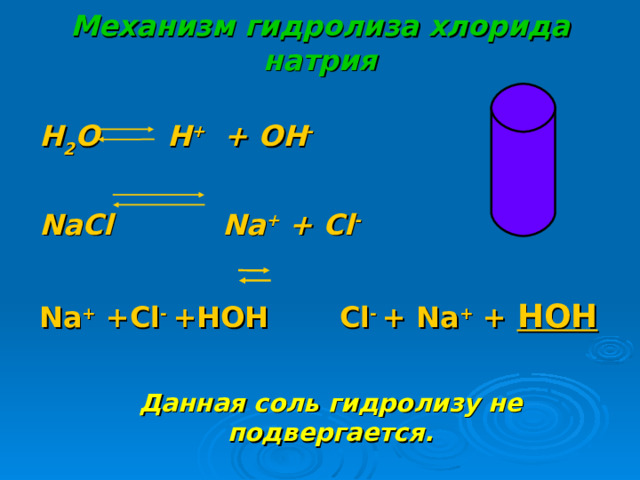
Механизм гидролиза хлорида натрия
H 2 O H + + OH -
Na С l Na + + Cl -
Na + +Cl - +HOH Cl - + Na + + HOH
Данная соль гидролизу не подвергается.
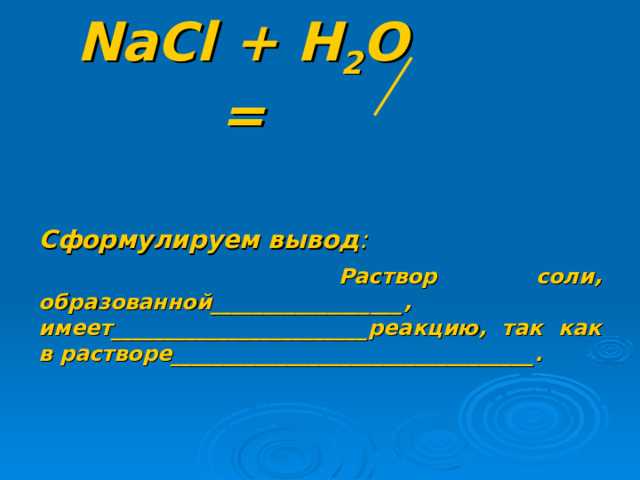
NaCl + Н 2 О =
Сформулируем вывод :
Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.

Сформулируем определение понятия «гидролиз»:
- К какому типу относятся данные реакции?
- Какие вещества в них участвуют?
- В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили?


ВЫВОД:
ГИДРОЛИЗ –
это реакция обмена между некоторыми солями и водой, приводящая к образованию слабого электролита.

Тест
Вариант 1
1. Гидролиз солей – это:
А) обменная реакция соли с водой;
Б) растворение соли в воде;
В) диссоциация соли в воде.
2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы;
Б) в образовании слабодиссоциирующих веществ;
В) в образовании молекул сильных электролитов.
3. Раствор нитрата меди ( ||) Cu ( NO 3 ) 2 имеет
А) кислотную среду
Б) щелочную среду;
В) нейтральную среду.

Тест
Вариант 2
Гидролиз солей – это:
1. А) растворение соли в воде;
Б) обменная реакция соли с водой;
В) диссоциация соли в воде.
2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы;
Б) в образовании молекул сильных электролитов;
В) в образовании слабодиссоциирующих веществ.
3. Раствор карбоната лития Li 2 С O 3 имеет
А) кислотную среду;
Б) щелочную среду;
В) нейтральную среду.

Ключ к оценке результата теста:
Верные ответы:
С u 2+ + HOH CuOH + + H +
С O 3 2 - + HOH HCO 3 - + OH -
Ключ к оценке качества выполнения теста
«5» - 0 ошибок;
«4» - 1 ошибка; «3» - 2 ошибки.


Применение темы «Гидролиз» в повседневной жизни
ГРУППОВАЯ ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА
Задание группы №1.
- Определить pH среды различных сортов мыла « Dove », «Глицериновое», « Camay ».
Задание группы №2
- Определение pH среды лосьонов « Sunsilk » , «Огуречный», «С lerasil »
Задание группы №3
- Определение pH среды шампуней « Shauma », « Dove », « Nivea ».
Задание группы №4
- Определение pH среды стиральных порошков «Тайд», «Ариэль», «Дени».

Творческое
домашнее задание
Подготовить мини проекты по темам:
- Блеск и сила здоровых волос
- Рекламный проспект косметических средств «Орифлейм»
Процессы гидролиза в повседневной жизни человека
- Стирка
- Мытье посуды
- Умывание с мылом
- Процессы пищеварения
























![АЛГОРИТМ СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ГИДРОЛИЗА СОЛЕЙ Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. AlCl 3 Al ( OH ) 3 HCl слабое основание сильная кислота [ OH ] - H ] + (что сильней того и больше!) К и с л о т н а я среда Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. Al 3+ + HOH AlOH 2+ + H + Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода . Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.](https://fsd.multiurok.ru/html/2023/05/19/s_64674f68b1a32/img17.jpg)



 [ H ] + (что сильней того и больше!) Щ е л о ч н а я среда " width="640"
[ H ] + (что сильней того и больше!) Щ е л о ч н а я среда " width="640"



![Схема гидролиза ХЛОРИДА натрия NaCl Na OH H Cl сильное основание сильная кислота [ OH ] - = [ H ] + Н е й т р а л ь н а я среда](https://fsd.multiurok.ru/html/2023/05/19/s_64674f68b1a32/img25.jpg)






























