

Урок 1. Степень окисления -
условный заряд на атоме, который образуется в результате отдачи или принятия электронов.

Нахождение степени окисления
Значение С.О. определяется числом электронов, смещённых от данного атома к атому более электроотрицательного элемента:
- С.О. имеет знак « + », если электроны отданы
Na 0 -1e = Na +1
- и знак « - », если электроны приняты
Cl 0 +1e = Cl -1

Степень окисления –
условный заряд на атоме, вычисленный из предположения, что все соединения состоят из ионов.
Na +1 Cl -1

+1 -1
1. СО ( F ) = -1 HF
2. СО (О) = -2
Исключение:
+1 -1
пероксид водорода H 2 O 2
+2 -1
фторид кислорода OF 2

3. СО ( металлов 1А, 2А, 3А ) = +1, +2, +3
+1 -2 +2 -2 +3 -2
Na 2 О Ca О Al 2 О 3
1 гр. 2 гр. 3 гр.
Оксиды –
сложные вещества, состоящие из двух химических элементов, один из которых кислород со степенью окисления -2.

+1 -2
4. CО (H) = +1 H 2 O
Исключение: гидриды металлов
+1 -1 +2 -1 +3 -1
NaH CaH 2 AlH 3
Гидриды –
сложные вещества, состоящие из двух химических элементов, один из которых водород со степенью окисления -1.

5. Суммарная СО = 0
+3 -2
Al2O3 ( +3 )*2 + ( -2 )*3 = (+6) +(-6) = 0
6. СО (атомов в простых веществах) = 0
0 0 0 0 0
Al H2 F2 Ca O 2

7. СО (Неметаллов)
Высшая= № группы Низшая= № группы – 8
+4 -2 +3 -1 + 1 -1
CO 2 Al С l3 НС l
В соединениях с
металлами и водородом неметаллы проявляют
низшую СО

Бинарные соединения
- Бинарные соединения – это соединения, в состав которых входят атомы двух х.э. ( би – два)
- Как правило в бинарных соединениях на втором месте записывают х.э. с отрицательным значением СО
( более электроотрицательный х.э .)
+1 -2 +2 -1 +3 -2 +3 -4 +2 -3 +1 -1
K 2 S MgCl 2 Fe 2 O 3 Al 4 C 3 Ca 3 N 2 NaBr

Определение степени окисления в бинарных соединениях
- В бинарных соединениях СО х.э., стоящего на втором месте, находим по формуле:
N – 8 , где N – номер группы в ПСХЭ
- СО второго элемента рассчитываем по химической формуле вещества
Например: MgCl2
степень окисления хлора равна (7 – 8) = -1,
пусть СО магния +х
Х + (-1)*2 = 0 х + (-1)*2 = 0 следовательно, х = +2
+2 -1
MgCl2

Домашнее задание
Параграф 18,
№ 5, №2 (определить степени окисления элементов в соединениях) с.106,
выучить записи в тетради
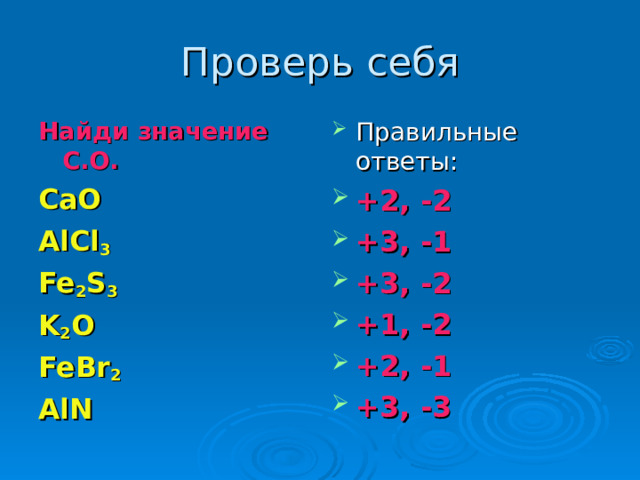
Проверь себя
Найди значение С.О.
CaO
AlCl 3
Fe 2 S 3
K 2 O
FeBr 2
AlN
- Правильные ответы:
- +2, -2
- +3, -1
- +3, -2
- +1, -2
- +2, -1
- +3, -3
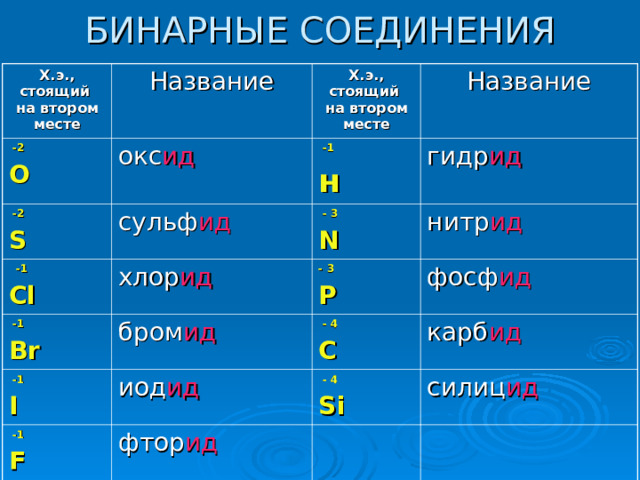
БИНАРНЫЕ СОЕДИНЕНИЯ
Х.э., стоящий на втором месте
Название
-2
O
Х.э., стоящий на втором месте
окс ид
-2
S
-1
Cl
Название
-1
н
сульф ид
-1
Br
хлор ид
- 3
N
гидр ид
нитр ид
- 3
Р
бром ид
-1
I
фосф ид
- 4
C
иод ид
-1
F
карб ид
- 4
Si
фтор ид
силиц ид

- Если атом одного х.э. может принимать несколько значений СО (металлы побочных подгрупп, неметаллы), в названии указывают С.О. римскими цифрами в скобках.
- Примеры:
+ 2 - 2 + 3 - 2
FeO Fe 2 O 3
оксид оксид
железа ( II ) железа ( III )

Названия веществ:
- Оксид кальция
- Хлорид алюминия
- Оксид калия
- Бромид железа( II )
- Нитрид алюминия

Как вы думаете, можно ли составить формулу вещества, зная степени окисления химических элементов, из которых состоит вещество?
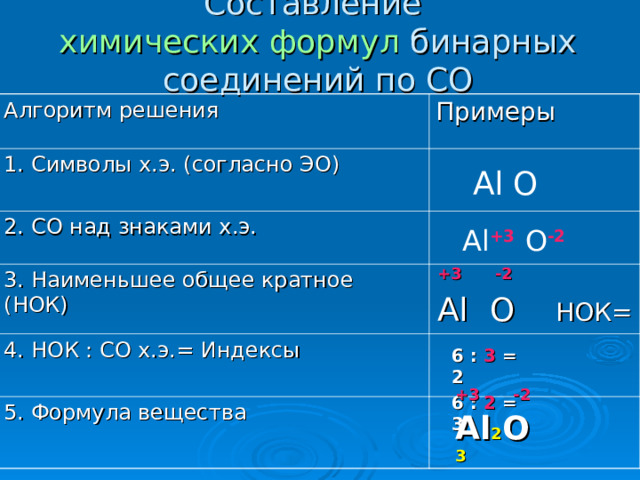
Составление химических формул бинарных соединений по СО
Алгоритм решения
Примеры
1. Символы х.э. (согласно ЭО)
2. СО над знаками х.э.
3. Наименьшее общее кратное (НОК)
4. НОК : СО х.э.= Индексы
5. Формула вещества
Al О
Al +3 О -2
+3 -2
Al О НОК= 6
6 : 3 = 2
6 : 2 = 3
+3 -2
Al 2 О 3


Домашнее задание
Параграф 18, № 1, 2, 6 с.106
Выучить названия бинарных соединений !












































