
Ионная химическая связь. Ионные кристаллические решетки.
СГБОУ ПО
«Севастопольский медицинский колледж имени Жени Дерюгиной »
Преподаватель Звягинцева О.В.
Ионная химическая связь.
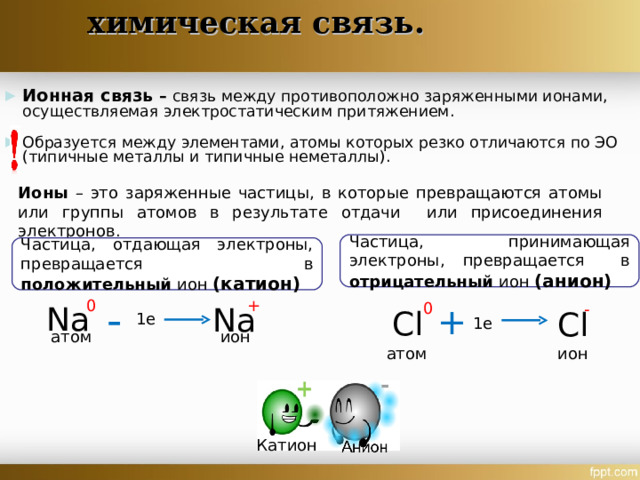
- Ионная связь – связь между противоположно заряженными ионами, осуществляемая электростатическим притяжением.
- Образуется между элементами, атомы которых резко отличаются по ЭО (типичные металлы и типичные неметаллы).
Ионы – это заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов.
Частица, принимающая электроны, превращается в отрицательный ион (анион)
Частица, отдающая электроны, превращается в положительный ион (катион)
-
+
0
0
+
-
Na
Na
Cl
Cl
1e
1e
атом
ион
атом
ион
Катион
2

Механизм образования ионной связи.
Пример:
NaCl – хлорид натрия (поваренная, пищевая соль)
Записывая заряд иона, сначала следует написать число, а затем знак, например, Ba 2+ , SO 4 2 , K + , Cl
2
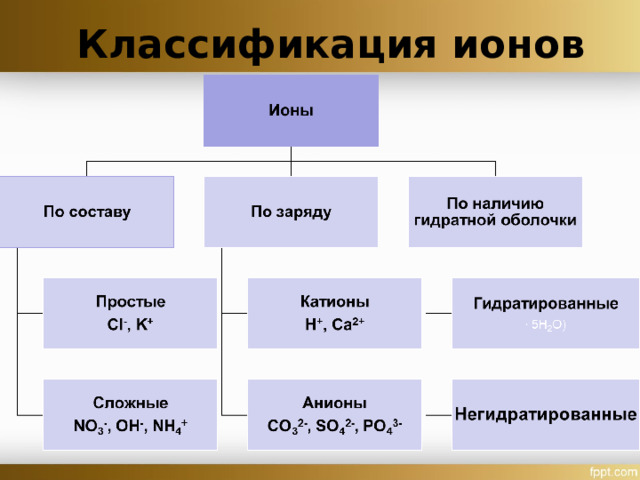
Классификация ионов
![Все в этом мире относительно! Относительной истиной является утверждение о том, что ионная связь — это результат взаимодействия типичных металлов с типичными неметаллами. Например, соли аммония, образованные за счёт ионной связи между катионами аммония и анионами кислотного остатка (например, NH 4 Cl, NH 4 NO 3 ), имеющие ионную связь, состоят исключительно из неметаллов. Аналогично состоят из ионов соли органических оснований — аминов, например [CH 3 NH 3 ] + Cl - , хотя в их составе нет металлов.](https://fsd.multiurok.ru/html/2021/10/18/s_616dd16f57213/img4.jpg)
Все в этом мире относительно!
Относительной истиной является утверждение о том, что ионная связь — это результат взаимодействия типичных металлов с типичными неметаллами. Например, соли аммония, образованные за счёт ионной связи между катионами аммония и анионами кислотного остатка (например, NH 4 Cl, NH 4 NO 3 ), имеющие ионную связь, состоят исключительно из неметаллов. Аналогично состоят из ионов соли органических оснований — аминов, например [CH 3 NH 3 ] + Cl - , хотя в их составе нет металлов.
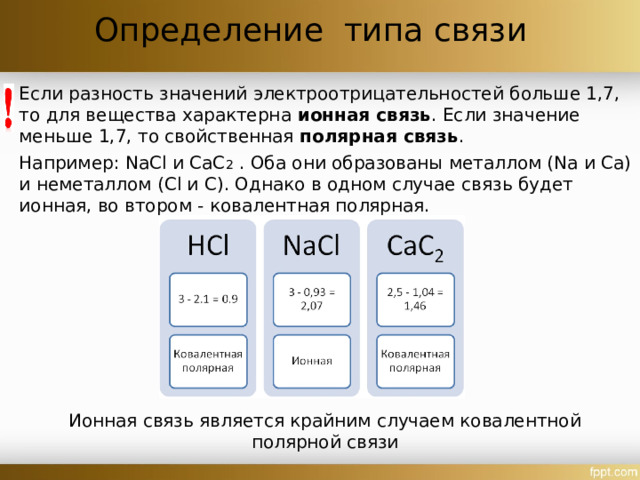
Определение типа связи
Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь . Если значение меньше 1,7, то свойственная полярная связь .
Например: NaCl и СаС 2 . Оба они образованы металлом (Na и Са) и неметаллом (Cl и С). Однако в одном случае связь будет ионная, во втором - ковалентная полярная.
Ионная связь является крайним случаем ковалентной полярной связи

Не все вещества, состоящие из металлов и неметаллов, имеют только ионную связь.
К примеру, если вещество имеет сложный ион, состоящий из неметаллов, то внутри этого иона ковалентная полярная химическая связь.
В сульфате натрия существует два вида связи: между ионами Na + и SO 4 2 связь ионная, а в ионе SO 4 2 — ковалентная полярная.
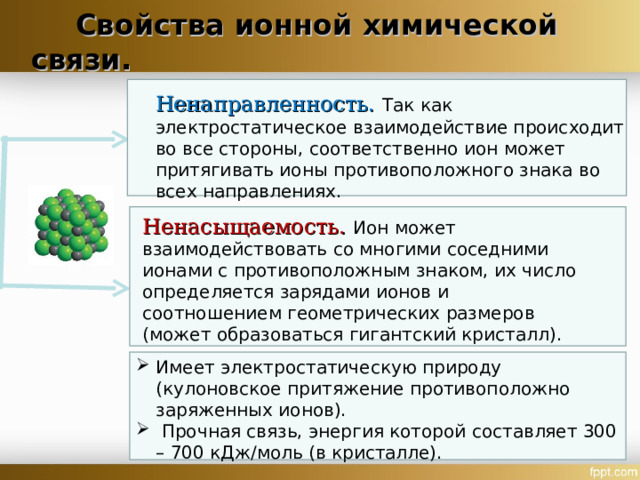
Свойства ионной химической связи.
Ненаправленность. Так как электростатическое взаимодействие происходит во все стороны, соответственно ион может притягивать ионы противоположного знака во всех направлениях.
Ненасыщаемость. Ион может взаимодействовать со многими соседними ионами с противоположным знаком, их число определяется зарядами ионов и соотношением геометрических размеров (может образоваться гигантский кристалл) .
- Имеет электростатическую природу (кулоновское притяжение противоположно заряженных ионов).
- Прочная связь, энергия которой составляет 300 – 700 кДж/моль (в кристалле).

Ионная кристаллическая решетка
Вещества с ионной связью при н.у. находятся в твердом агрегатном состоянии и образуют кристаллы с ионной кристаллической решеткой
В узлах ионной кристаллической решетки находятся ионы, между которыми присутствует ионная связь
Эту решетку образуют все вещества с ионным типом связи – соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов.
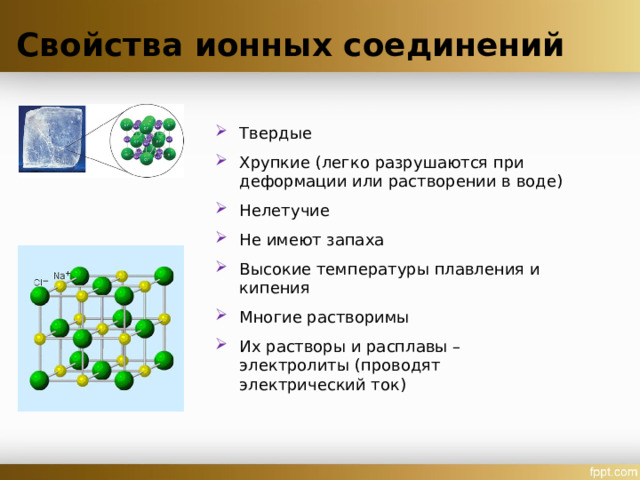
Свойства ионных соединений
- Твердые
- Хрупкие (легко разрушаются при деформации или растворении в воде)
- Нелетучие
- Не имеют запаха
- Высокие температуры плавления и кипения
- Многие растворимы
- Их растворы и расплавы – электролиты (проводят электрический ток)

Сравнение ковалентной и ионной связи
Ковалентная связь
Ионная связь
Возникает в результате обобществления электронов в пары, одновременно принадлежащие обоим атомам
Возникает в результате притяжения разноименных ионов
Имеет электростатическую природу (общая пара притягивается обоими ядрами)
Имеет электростатическую природу (кулоновское притяжение противоположно заряженных ионов)
Характеризуется кратностью, направленностью и насыщенностью
Не имеет кратности, не направлена и не насыщена
Образуется между атомами, электроотрицательности которых одинаковы или различаются незначительно (меньше чем 2 на ), — между неметаллами
Образуется между атомами, электроотрицательности которых сильно различаются (на 2 и более), — между типичными металлами и типичными неметаллами
Число ковалентных связей, которые образует атом, называют валентностью
Число ближайших соседей, окружающих данный атом, называют координационным числом

Определите тип химической связи в соединениях: N 2 , P 2 O 5 , NaOH, H 2 SO 4 , K 2 O, CsF, P 4 , Na, Cl 2 O 7 , KCl, S 8 , SO 3 , CaCl 2 , H 2 O 2 , H 3 PO 4.









![Все в этом мире относительно! Относительной истиной является утверждение о том, что ионная связь — это результат взаимодействия типичных металлов с типичными неметаллами. Например, соли аммония, образованные за счёт ионной связи между катионами аммония и анионами кислотного остатка (например, NH 4 Cl, NH 4 NO 3 ), имеющие ионную связь, состоят исключительно из неметаллов. Аналогично состоят из ионов соли органических оснований — аминов, например [CH 3 NH 3 ] + Cl - , хотя в их составе нет металлов.](https://fsd.multiurok.ru/html/2021/10/18/s_616dd16f57213/img4.jpg)
























