
ХИМИЧЕСКОЕ РАВНОВЕСИЕ и способы его смещения

Химическое равновесие состояние равновесия характерно для обратимых химических реакций
ХИМИЧЕСКИЕ РЕАКЦИИ
( по направлению )
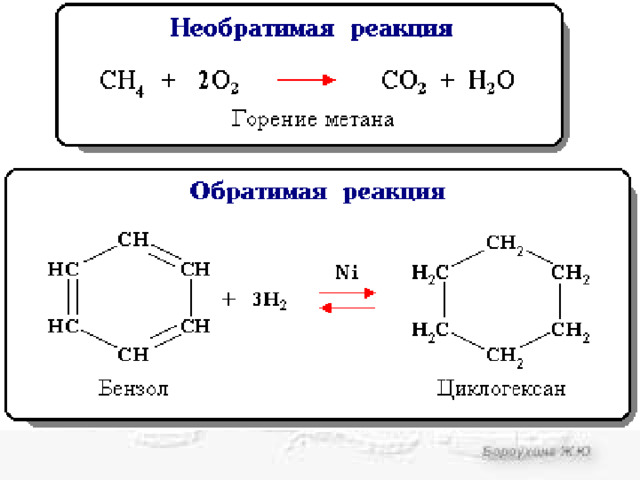
ОБРАТИМЫЕ РЕАКЦИИ
НЕОБРАТИМЫЕ РЕАКЦИИ
A + B C + В
A + B C + В
которые протекают
протекающие в одном
одновременно
направлении
в противоположных
направлениях
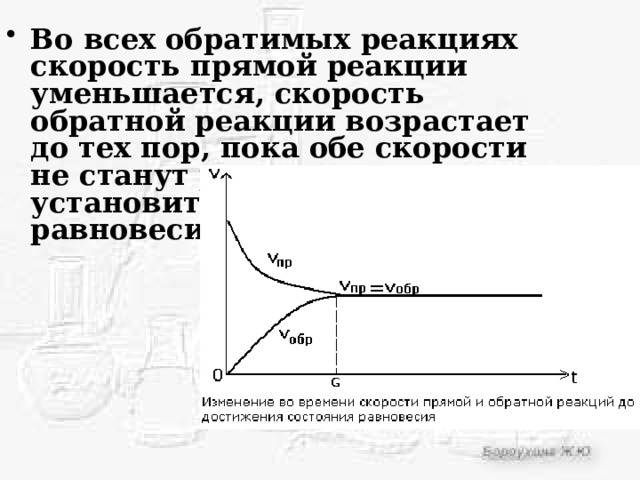
- Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия.

Химическое равновесие
состояние системы, в котором скорость прямой реакции равна скорости обратной реакции.
Химическое равновесие имеет динамический характер.
Это значит, что и прямая и обратная реакции при равновесии не прекращаются.

Смещение равновесия в нужном направлении достигается изменением условий реакции ( принцип Ле-Шателье ).
Принцип Ле-Шателье
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия.
![Для одностадийной обратимой реакции При равновесии выражения для скоростей прямой V 1 и обратной реакций V 2 имеют вид: Где [a] [b] [c] и [d] - равновесные молярные концентрации веществ a, b, c и d; a b c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию); k1 k2 -коэффициенты пропорциональности, называемые константами скоростей.](https://fsd.multiurok.ru/html/2023/02/10/s_63e61b2029695/img6.jpg)
Для одностадийной обратимой реакции
При равновесии выражения для скоростей прямой
V 1 и обратной реакций V 2 имеют вид:
Где [a] [b] [c] и [d] - равновесные молярные концентрации веществ a, b, c и d; a b c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию); k1 k2 -коэффициенты пропорциональности, называемые константами скоростей.
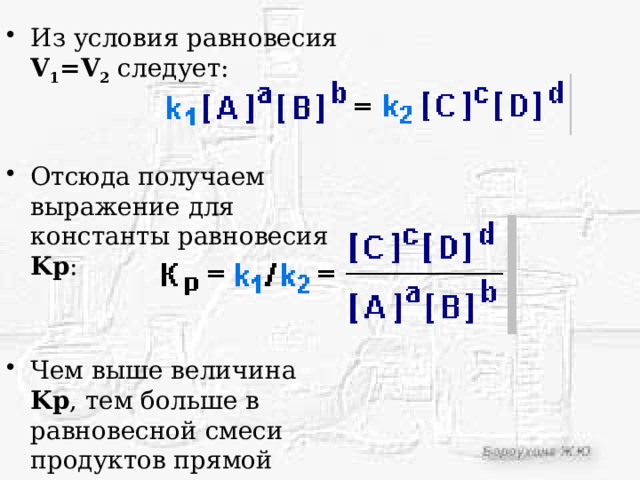
- Из условия равновесия V 1 =V 2 следует:
- Отсюда получаем выражение для константы равновесия Kp :
- Чем выше величина Kp , тем больше в равновесной смеси продуктов прямой реакции.

Влияние температуры на смещение равновесия
- Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
- Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому.

Влияние температуры на смещение равновесия
- Чтобы сместить равновесие вправо (для экзотермической реакции)
нужно понизить температуру.
наоборот, повысить температуру .

- При повышении температуры химическое равновесие смещается в направлении эндотермической реакции,
- При понижении температуры - в направлении экзотермической реакции.

Влияние концентрации на смещение равновесия
Равновесие сместится ВПРАВО, если:
- Увеличить концентрацию одного из реагирующих веществ
- Отводить из зоны реакции продукт

Влияние давления на смещение равновесия
Влияние давления на состояние равновесия проявляется только при наличии в системе газов !!!

Влияние давления на смещение равновесия
- При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом; При понижении давления равновесие сдвигается в направлении образования веществ с большим объемом
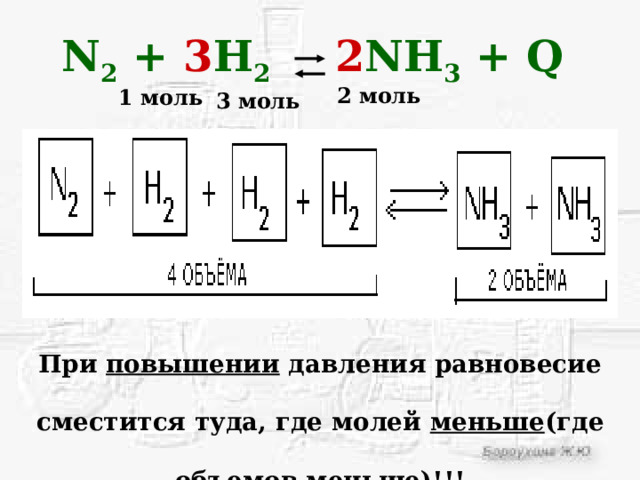
N 2 + 3 H 2 2 NH 3 + Q
2 моль
1 моль
3 моль
При повышении давления равновесие сместится туда, где молей меньше (где объемов меньше)!!!

Катализаторы не влияют на положение равновесия!

Задача
Укажите, как повлияет:
а) повышение давления;
б) повышение температуры;
в) увеличение концентрации кислорода на равновесие системы :
2CO (г) + O 2 (г) ↔ 2CO 2 (г) + Q

а) Изменение давления смещает равновесие реакций с участием газообразных веществ (г). Определим объёмы газообразных веществ до и после реакции по стехиометрическим коэффициентам:
По принципу Ле Шателье, при увеличении давления, равновесие смещается в сторону образования веществ, занимающих меньший объём, следовательно равновесие сместится вправо, т.е. в сторону образования СО2, в сторону прямой реакции (→)

б) По принципу Ле Шателье, при повышении температуры, равновесие смещается в сторону эндотермической реакции (-Q), т.е. в сторону обратной реакции – реакции разложения СО2 (←), т.к. по закону сохранения энергии:
в) При увеличении концентрации кислорода равновесие системы смещается в сторону получения СО 2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции.













![Для одностадийной обратимой реакции При равновесии выражения для скоростей прямой V 1 и обратной реакций V 2 имеют вид: Где [a] [b] [c] и [d] - равновесные молярные концентрации веществ a, b, c и d; a b c и d - соответствующие стехиометрические коэффициенты (при условии, что реакция идет в одну стадию); k1 k2 -коэффициенты пропорциональности, называемые константами скоростей.](https://fsd.multiurok.ru/html/2023/02/10/s_63e61b2029695/img6.jpg)





























