
ГИДРОЛИЗ
ГИДРОЛИЗ ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ

Гидро́лиз ( от древне греческого «ὕδωρ»— вода и «λύσις» — разложение)
— один из видов химических реакций, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений.

1. Гидролиз органических соединений
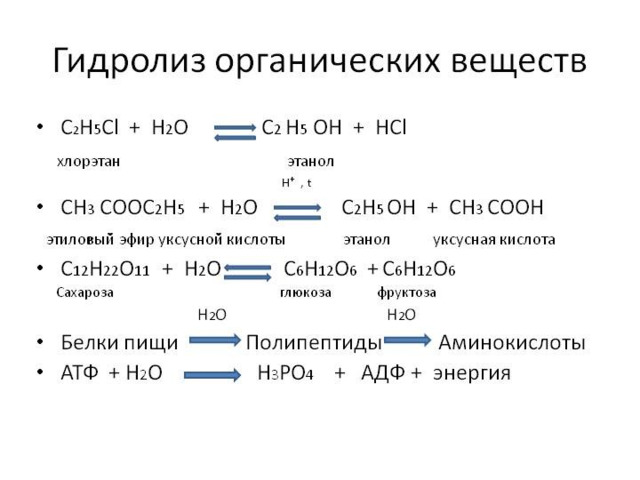
- жиры гидролизуются с получением глицерина
и карбоновых кислот ( с NaOH – омыление):

- крахмал и целлюлоза гидролизуются
до глюкозы:

ТЕСТ
1. При гидролизе жиров образуются
1) спирты и минеральные кислоты 2) альдегиды и карбоновые кислоты
3) одноатомные спирты и карбоновые кислоты 4) глицерин и карбоновые кислоты
ОТВЕТ: 4
2. Гидролизу подвергается:
3) Этанол 4) Метан
ОТВЕТ: 2
3. Гидролизу подвергается:
3) Жир 4) Уксусная кислота
ОТВЕТ: 3

4. При гидролизе сложных эфиров образуются:
1) Спирты и альдегиды
2) Карбоновые кислоты и глюкоза
3) Крахмал и глюкоза 4) Спирты и карбоновые кислоты
ОТВЕТ: 4
5. При гидролизе крахмала получается:
1) Сахароза 2) Фруктоза
3) Мальтоза 4) Глюкоза
ОТВЕТ: 4

2. Обратимый и необратимый гидролиз
Почти все рассмотренные реакции гидролиза органических веществ
обратимы. Но есть и необратимый гидролиз.
Общее свойство необратимого гидролиза - один ( лучше оба) из
продуктов гидролиза должен быть удален из сферы реакции в виде:
- ОСАДКА , - ГАЗА.
СаС ₂ + 2Н₂О = Са(ОН)₂↓ + С₂Н₂↑
При гидролизе солей:
Al ₄C₃ + 12 H₂O = 4 Al(OH)₃↓ + 3CH₄↑
Al₂S₃ + 6 H₂O = 2 Al(OH)₃↓ + 3 H₂S↑
CaH₂ + 2 H₂O = 2Ca(OH)₂↓ + H₂↑

Г И Д Р О Л И З С О Л Е Й
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах
(водных) растворимых солей-электролитов.
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или молекулярном виде (« связывание ионов »).
Различают обратимый и необратимый гидролиз солей.
- 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону ).
- 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз
по катиону ).
- 3. Гидролиз соли слабой кислоты и слабого основания
( необратимый )
Соль сильной кислоты и сильного основания не подвергается гидролизу

 [H]⁺ ЩЕЛОЧНАЯ СРЕДА СОЛЬ КИСЛАЯ, гидролиз по АНИОНУ " width="640"
[H]⁺ ЩЕЛОЧНАЯ СРЕДА СОЛЬ КИСЛАЯ, гидролиз по АНИОНУ " width="640"
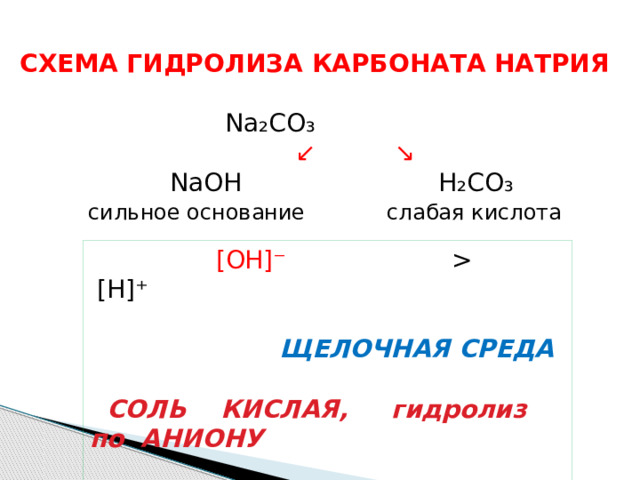
СХЕМА ГИДРОЛИЗА КАРБОНАТА НАТРИЯ
Na ₂ CO ₃
↙ ↘
NaOH H₂CO₃
сильное основание слабая кислота
[OH]⁻ [H]⁺
ЩЕЛОЧНАЯ СРЕДА
СОЛЬ КИСЛАЯ, гидролиз по АНИОНУ
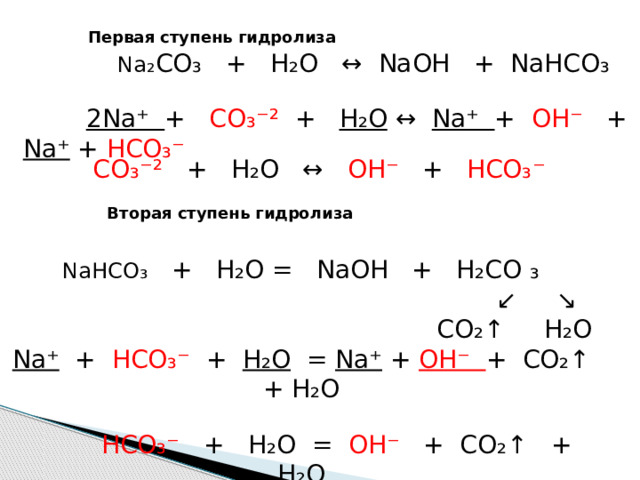
Na ₂ CO₃ + H₂O ↔ NaOH + NaHCO₃
2Na⁺ + CO₃⁻² + H₂O ↔ Na⁺ + OH⁻ + Na⁺ + HCO₃⁻
Первая ступень гидролиза
CO ₃⁻² + H₂O ↔ OH⁻ + HCO₃⁻
Вторая ступень гидролиза
NaHCO ₃ + H₂O = NaOH + H₂CO ₃
↙ ↘
CO₂↑ H₂O
Na⁺ + HCO₃⁻ + H₂O = Na⁺ + OH⁻ + CO₂↑ + H₂O
HCO₃⁻ + H₂O = OH⁻ + CO₂↑ + H₂O
![СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ ( II) CuCl ₂ ↙ ↘ Cu(OH)₂↓ HCl слабое основание сильная кислота [OH]⁻ КИСЛАЯ СРЕДА СОЛЬ ОСНОВНАЯ, гидролиз по КАТИОНУ](https://fsd.multiurok.ru/html/2022/02/03/s_61fbff7ccd824/img12.jpg)
СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ ( II)
CuCl ₂
↙ ↘
Cu(OH)₂↓ HCl
слабое основание сильная кислота
[OH]⁻
КИСЛАЯ СРЕДА
СОЛЬ ОСНОВНАЯ, гидролиз по КАТИОНУ
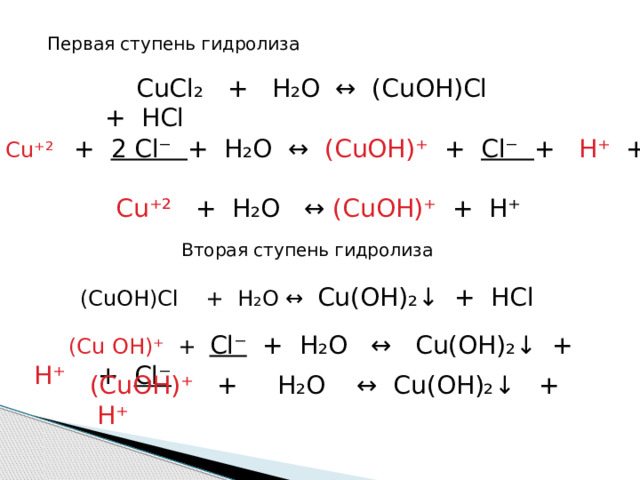
Первая ступень гидролиза
CuCl ₂ + H₂O ↔ (CuOH)Cl + HCl
Cu ⁺² + 2 Cl⁻ + H₂O ↔ (CuOH)⁺ + Cl⁻ + H⁺ + Cl⁻
Cu⁺² + H₂O ↔ (CuOH)⁺ + H⁺
Вторая ступень гидролиза
(СuOH)Cl + H ₂ O ↔ Cu(OH)₂↓ + HCl
(Cu OH) ⁺ + Cl⁻ + H₂O ↔ Cu(OH)₂↓ + H⁺ + Cl⁻
(CuOH) ⁺ + H₂O ↔ Cu(OH)₂↓ + H⁺
![СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ Al ₂ S ₃ ↙ ↘ Al(OH)₃↓ H₂S↑ слабое основание слабая кислота [ OH ]⁻ = [H]⁺ НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ гидролиз необратимый](https://fsd.multiurok.ru/html/2022/02/03/s_61fbff7ccd824/img14.jpg)
СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ
Al ₂ S ₃
↙ ↘
Al(OH)₃↓ H₂S↑
слабое основание слабая кислота
[ OH ]⁻ = [H]⁺
НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ
гидролиз необратимый
![Al ₂ S ₃ + 6 H₂O = 2Al(OH)₃↓ + 3H₂S↑ ГИДРОЛИЗ ХЛОРИДА НАТРИЯ NaCl ↙ ↘ NaOH HCl сильное основание сильная кислота [OH]⁻ = [ H ]⁺ НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ гидролиз не идет NaCl + H ₂ O = NaOH + HCl Na ⁺ + Cl⁻ + H₂O = Na⁺ + OH⁻ + H⁺ + Cl⁻](https://fsd.multiurok.ru/html/2022/02/03/s_61fbff7ccd824/img15.jpg)
Al ₂ S ₃ + 6 H₂O = 2Al(OH)₃↓ + 3H₂S↑
ГИДРОЛИЗ ХЛОРИДА НАТРИЯ
NaCl
↙ ↘
NaOH HCl
сильное основание сильная кислота
[OH]⁻ = [ H ]⁺
НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ
гидролиз не идет
NaCl + H ₂ O = NaOH + HCl
Na ⁺ + Cl⁻ + H₂O = Na⁺ + OH⁻ + H⁺ + Cl⁻

РОЛЬ ГИДРОЛИЗА В ПРИРОДЕ
Преобразование земной коры
Обеспечение слабощелочной среды морской воды
РОЛЬ ГИДРОЛИЗА В ЖИЗНИ ЧЕЛОВЕКА
Стирка Умывание с мылом
Мытье посуды Процессы пищеварения
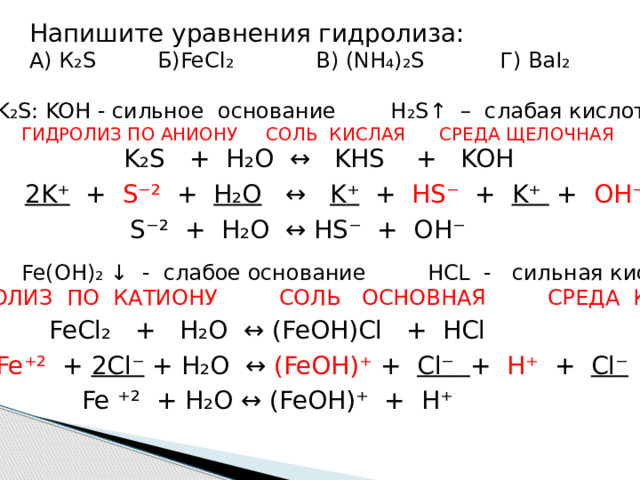
Напишите уравнения гидролиза:
А) К ₂ S Б)FeCl ₂ В) (NH₄)₂S Г) BaI₂
K ₂ S: KOH - сильное основание H ₂ S ↑ – слабая кислота
ГИДРОЛИЗ ПО АНИОНУ СОЛЬ КИСЛАЯ СРЕДА ЩЕЛОЧНАЯ
K ₂ S + H ₂ O ↔ KHS + KOH
2K ⁺ + S ⁻² + H ₂ O ↔ K ⁺ + HS ⁻ + K ⁺ + OH ⁻
S ⁻² + H ₂ O ↔ HS ⁻ + OH ⁻
FeCl ₂ : Fe(OH)₂ ↓ - слабое основание HCL - сильная кислота
ГИДРОЛИЗ ПО КАТИОНУ СОЛЬ ОСНОВНАЯ СРЕДА КИСЛАЯ
FeCl ₂ + H ₂ O ↔ (FeOH)Cl + HCl
Fe ⁺² + 2Cl ⁻ + H ₂ O ↔ (FeOH) ⁺ + Cl ⁻ + H ⁺ + Cl ⁻
Fe ⁺² + H ₂ O ↔ (FeOH) ⁺ + H ⁺
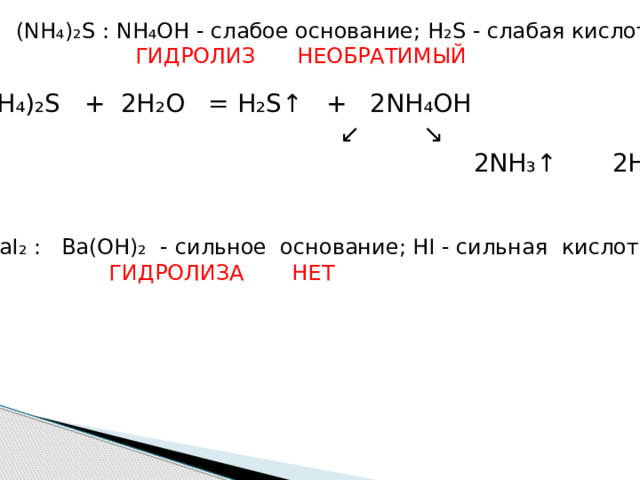
(NH ₄ ) ₂ S : NH ₄ OH - слабое основание; H ₂ S - слабая кислота
ГИДРОЛИЗ НЕОБРАТИМЫЙ
(NH ₄ ) ₂ S + 2H ₂ O = H ₂ S ↑ + 2NH ₄ OH
↙ ↘
2NH₃↑ 2H₂O
BaI ₂ : Ba(OH)₂ - сильное основание; HI - сильная кислота
ГИДРОЛИЗА НЕТ



7. Водный раствор какой из солей имеет нейтральную среду?
а) Al(NO ₃)₃ б) ZnCl ₂ в) BaCl ₂ г) Fe(NO ₃)₂
8. В каком растворе цвет лакмуса будет синим?
а) Fe₂(SO₄)₃ б) K₂S в) CuCl₂ г) (NH₄)₂SO₄

9. Гидролизу не подвергаются
1) карбонат калия 2) этан 3) хлорид цинка
4) жир
10. При гидролизе клетчатки ( крахмала ) могут образовываться:
1) глюкоза 2) только сахароза 3) только фруктоза 4) углекислый газ и вода
11. Среда раствора в результате гидролиза карбоната натрия
1) щёлочная 2) сильно кислая 3) кислая 4) нейтральная
12. Гидролизу подвергается
1) CH 3 COOK 2) KCI 3) CaCO 3 4)Na 2 SO 4

13.Гидролизу не подвергаются
1) сульфат железа 2) спирты
3) хлорид аммония 4) сложные эфиры
14.Среда раствора в результате гидролиза хлорида
аммония:
1) слабощёлочная 2) сильнощёлочная
3) кислая 4) нейтральная
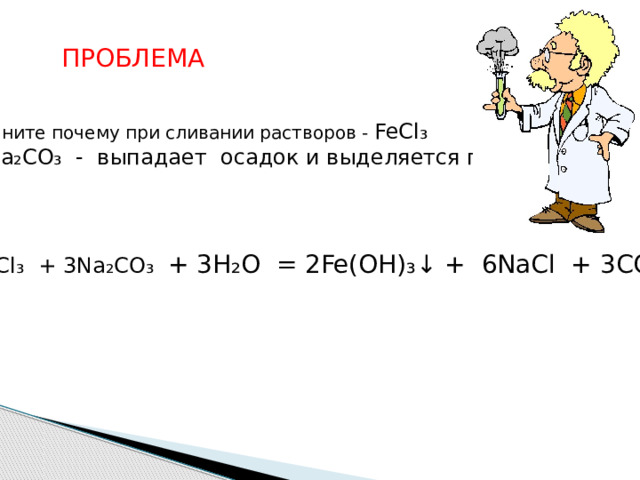
ПРОБЛЕМА
Объясните почему при сливании растворов - FeCl ₃
и Na₂CO₃ - выпадает осадок и выделяется газ?
2FeCl ₃ + 3Na ₂ CO ₃ + 3H₂O = 2Fe(OH)₃↓ + 6NaCl + 3CO₂↑
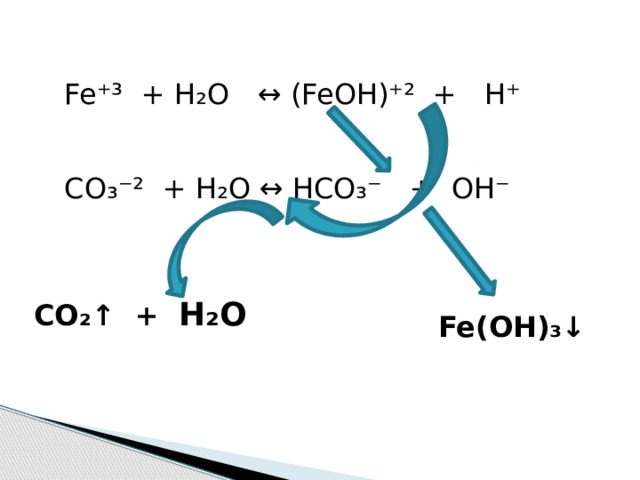
Fe ⁺³ + H₂O ↔ (FeOH)⁺² + H⁺
CO₃⁻² + H₂O ↔ HCO₃⁻ + OH⁻
CO ₂↑ + H₂O
Fe(OH) ₃↓

Гидролиз органических веществ
Живые организмы осуществляют гидролиз различных органических веществ в ходе реакций при участии ФЕРМЕНТОВ.
Например, в ходе гидролиза при участии пищеварительных ферментов БЕЛКИ расщепляются на АМИНОКИСЛОТЫ ,
ЖИРЫ — на ГЛИЦЕРИН и ЖИРНЫЕ КИСЛОТЫ ,
ПОЛИСАХАРИДЫ ( например, крахмал и целлюлоза) — на МОНОСАХАРИДЫ (например, на ГЛЮКОЗУ ),
НУКЛЕИНОВЫЕ КИСЛОТЫ — на свободные НУКЛЕОТИДЫ .
При гидролизе жиров в присутствии щёлочей получают мыло ; гидролиз жиров в присутствии катализаторов применяется для получения глицерина и жирных кислот . Гидролизом древесины получают этанол , а продукты гидролиза торфа находят применение в производстве кормовых дрожжей , воска , удобрений и др.

















 [H]⁺ ЩЕЛОЧНАЯ СРЕДА СОЛЬ КИСЛАЯ, гидролиз по АНИОНУ " width="640"
[H]⁺ ЩЕЛОЧНАЯ СРЕДА СОЛЬ КИСЛАЯ, гидролиз по АНИОНУ " width="640"

![СХЕМА ГИДРОЛИЗА ХЛОРИДА МЕДИ ( II) CuCl ₂ ↙ ↘ Cu(OH)₂↓ HCl слабое основание сильная кислота [OH]⁻ КИСЛАЯ СРЕДА СОЛЬ ОСНОВНАЯ, гидролиз по КАТИОНУ](https://fsd.multiurok.ru/html/2022/02/03/s_61fbff7ccd824/img12.jpg)

![СХЕМА ГИДРОЛИЗА СУЛЬФИДА АЛЮМИНИЯ Al ₂ S ₃ ↙ ↘ Al(OH)₃↓ H₂S↑ слабое основание слабая кислота [ OH ]⁻ = [H]⁺ НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ гидролиз необратимый](https://fsd.multiurok.ru/html/2022/02/03/s_61fbff7ccd824/img14.jpg)
![Al ₂ S ₃ + 6 H₂O = 2Al(OH)₃↓ + 3H₂S↑ ГИДРОЛИЗ ХЛОРИДА НАТРИЯ NaCl ↙ ↘ NaOH HCl сильное основание сильная кислота [OH]⁻ = [ H ]⁺ НЕЙТРАЛЬНАЯ РЕАКЦИЯ СРЕДЫ гидролиз не идет NaCl + H ₂ O = NaOH + HCl Na ⁺ + Cl⁻ + H₂O = Na⁺ + OH⁻ + H⁺ + Cl⁻](https://fsd.multiurok.ru/html/2022/02/03/s_61fbff7ccd824/img15.jpg)






























