Просмотр содержимого документа
«Презентация "Ионный обмен"»

«Ум заключается не только в знании,
но и в умении прилагать
знания на деле» (Аристотель)

Тест. Диссоциация кислот, оснований, солей. Сильные и слабые электролиты.
1. К электролитам не относится:
1) MgCl 2 2) Ba(OH) 2 3) Na 3 PO 4 4) С aCO 3
2. К электролитам относится:
1) BaO 2) С aCO 3 3) K 3 PO 4 4) Al(OH) 3
3. Слабая кислота – это:
1) HNO 3 2) H 2 SiO 3 3) H 2 SO 4 4) H С lO 4
4. Сильная кислота – это:
1) H 2 SO 3 2) H 2 SiO 3 3) H 2 S 4) H 2 SO 4
5 .Вещество, которое при растворении в воде диссоциирует с образованием карбонат – ионов, - это:
1) Na 2 CO 3 2) CO 2 3) H 2 CO 3 4) MgCO 3
6 .Слабое основание – это:
1) Mg ( OH ) 2 2) Ba(OH) 2 3) KOH 4) NaOH

- 7. Ионы металла и гидроксид-ионы при электролитической диссоциации образует:
- 1) гидроксид меди ( II ) 3) азотная кислота
- 2) гидроксид калия 4) нитрат кальция
- 8. Ионы водорода и кислотного остатка при электролитической диссоциации образует:
- 1) серная кислота 3) аммиак
- 2) хлорид аммония 4) сульфат калия

- Ответ:
- 1.(4)
- 2.(3)
- 3.(2)
- 4 .(4)
- 5.(1)
- 6.(1)
- 7.(2)
- 8.(1)

Эксперимент
1. Слить растворы хлорида магния и сульфата натрия.
2. Слить растворы хлорида железа ( III ) и гидроксида натрия.

ТЕМА УРОКА
Реакции ионного обмена

Основные понятия:
полное и сокращённое ионные уравнения, реакции ионного обмена
Цель урока: изучить реакции ионного обмена, продолжить формирование умения записывать уравнения и предвидеть продукты реакции ионного обмена. Дать первоначальное понятие об условиях течения реакций между растворами до конца.

Реакции ионного обмена
- Реакции между ионами называют ионными реакциями, а уравнения таких реакций - ионными уравнениями .
- Правила составления ионных уравнений:
- - вещества, выпадающие в осадок, малодиссоциирующие вещества, газообразные записываются в молекулярном виде.
- ↓ - осадок, ↑- газ.
- Сильные электролиты записывают в виде ионов.

- Реакции обмена протекают до конца:
- - если образуется осадок;
- - выделяется газ;
- - малодиссоциирующие вещества - (слабые электролиты, например вода).
- Правило: если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т.е. является обратимой. При этом ставится знак обратимости.


- Молекулярное уравнение
- FeCl 3 + 3NaOH →Fe(OH) 3 ↓ + 3NaCl
- Полное ионное уравнение (ПИУ)
- Fe 3+ + 3С l - + 3Na + + 3OH - → Fe(OH) 3 ↓+ 3Na + + 3С l -
- Сокращенное ионное уравнение (СИУ)
- Fe 3+ + 3OH - → Fe(OH) 3 ↓

Реакции, идущие с образованием малодиссоциирующего вещества
- Задание для группы № 1
- Если в результате реакции выделяется малодиссоциирующее вещество – вода .
- Проделайте реакцию между гидроксидом натрия (добавьте фенолфталеин) и соляной кислотой до исчезновения окраски, признак реакции(вспомните – эта реакция обмена называется реакцией нейтрализации)- образование малодиссоциирующего вещества- воды. Запишите молекулярное, полное и сокращённое ионное уравнение.

Реакции, идущие с образованием осадка
- Задание для группы № 2.
- Если в результате реакции выделяется нерастворимое в воде вещество – осадок
- Проделайте реакцию между сульфатом меди (II) и гидроксидом натрия. Какой признак этой реакции? Запишите молекулярное, полное и сокращённое ионное уравнение.

Реакции, идущие с образованием газообразного вещества
- Задание для группы № 3
- Если в результате реакции выделяется газообразное вещество .
- Проделайте реакцию между карбонатом натрия и серной кислотой. Какой признак этой реакции? Запишите молекулярное, полное и сокращённое ионное уравнение.


Одно из взятых исходных веществ практически нерастворимо
- CuO, Fe 2 O 3 , Cu(OH) 2 , Zn(OH) 2 , CaCO 3 , Fe(OH) 3 и др.
- 1группа – действие серной кислоты на гидроксид меди ( II )
- 2 группа – действие соляной кислоты на оксид меди ( II )
- 3группа – действие соляной кислоты на карбонат кальция

Задание. Составьте молекулярные и полные ионные уравнения – по сокращенным ионным уравнениям.
- 1 группа
- SO 3 2- + 2H + →H 2 O + SO 2 ↑
- Fe 2+ + 2OH - →Fe(OH) 2 ↓
- 2 группа
- CO 3 2- + 2H + → H 2 O + CO 2 ↑
- NH 4 + + OH - →NH 3 ↑ + H 2 O
- 3 группа
- 2PO 4 3- + 3Ba 2+ →Ba 3 (PO 4 ) 2
- Al 3+ + 3OH - →Al(OH) 3 ↓
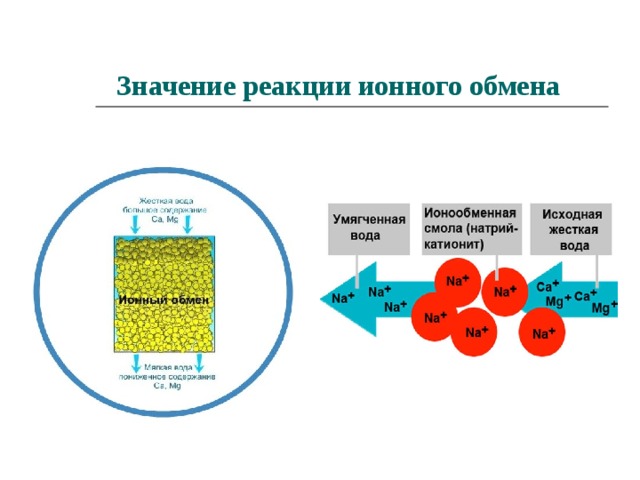
Значение реакции ионного обмена

- Закончите предложение
- Мне больше всего удалось…
- Сегодня я узнал…
- Было сложно…
- Было интересно…
- Теперь я могу…
- Я попробовал…

Упр.1,2,3,4,5 стр. 39
Задания: №2-21, 2-25, 2-26 стр. 21
- Творческое задание. Составьте кроссворд по теме «Электролитическая диссоциация».











































